缺氧对大鼠心肌细胞损伤的影响及机制
宋佳卉 牛 楠 朱明星 佟雪琪 赵殷奇 徐士梅 宋 熔 赵 巍
(宁夏医科大学基础医学院,宁夏 银川 750004)
缺氧对大鼠心肌细胞损伤的影响及机制
宋佳卉 牛 楠1朱明星1佟雪琪2赵殷奇1徐士梅 宋 熔3赵 巍1
(宁夏医科大学基础医学院,宁夏 银川 750004)
目的 探讨缺氧对大鼠心肌细胞系H9C2的损伤及机制。方法 在1%O2+5%CO2+94%N2条件下培养大鼠心肌细胞株H9C2 3、6、12、24、48 h,并以正常大鼠心肌细胞株作对照,使用台盼蓝进行细胞计数;CCK-8法检测细胞存活率;实时监测心肌细胞生长状态;透射电镜观察细胞内部结构;活性氧检测试剂盒检测胞内活性氧(ROS);Western印迹法检测线粒体色素C蛋白表达水平;流式细胞术检测细胞凋亡率;乳酸脱氢酶(LDH)试剂盒检测细胞坏死程度。结果 缺氧状态下,随着缺氧时间的不断增加,大鼠心肌细胞株H9C2的细胞生长、存活率均明显降低、细胞形态明显改变,细胞器结构明显损伤,ROS水平升高,线粒体细胞色素释放增加,细胞凋亡率明显增加,LDH的释放率明显增高。结论 缺氧会造成大鼠心肌细胞的生长速度减慢、形态改变及心肌线粒体损伤,最终导致细胞凋亡和细胞坏死。
缺氧;线粒体损伤;凋亡;坏死
心肌梗死的发病率和死亡率均居于心血管疾病的首位〔1〕。心肌梗死是冠状动脉闭塞、血流中断,使部分心肌因严重的持久性缺血从而发生局部坏死。而冠状动脉闭塞必然导致心肌细胞缺氧,所以氧气是重要的病理生理调节因素,心脏的功能活动是否正常取决于心肌细胞是否获得足够的氧气,而心肌细胞较其他类型细胞对缺氧更敏感〔2〕。心肌缺氧能够导致心肌细胞损伤,从而引发各类心脏疾病。因此,如何纠正缺氧对心肌细胞造成的损伤,这可能是治疗、缓解各种心脏类疾病的研究方向〔3,4〕。本研究以缺氧为基本条件,探究细胞在缺氧环境中生长、形态的损伤程度以及相关机制,为药物治疗及生物技术治疗提供理论依据。
1 材料与方法
1.1 材料 大鼠心肌细胞H9C2(上海中科院细胞库)。DMEM高糖培养基(Thermo公司)、胎牛血清(Sigma公司)、台盼蓝(北京中生瑞泰科技有限公司)、0.25%胰酶(美国Hyclone公司)、CCK-8细胞周期检测试剂盒(贝博公司)、乳酸脱氢酶(LDH)试剂盒(南京建成生物工程研究所)、Annexin V-APC(伯乐公司)、7-AAD(伯乐公司)、细胞色素C单克隆抗体(兔抗大鼠,Abcam公司)、山羊抗兔辣根过氧化物酶标抗体(中杉金桥)、细胞线粒体分离试剂盒(碧云天生物技术公司)。三气培养箱(Thermo公司)、CellAsic Onix(德国 Merck)、透射电镜(日立H7650)、流式细胞仪(BD Accuri C6)等。
1.2 方法
1.2.1 细胞计数 取生长状态良好的大鼠心肌细胞H9C2,胰酶消化,计数,将细胞按照相同的细胞数2×105个/ml接种在两块96孔板上,每组设置5个复孔,培养过夜,将一组细胞取出,放置在5%CO2+1%O2+94%N2的三气培养箱中培养3、6、12、24、48 h,另一组正常培养3、6、12、24、48 h,然后使用台盼蓝染色并计数两组细胞数,绘制细胞生长曲线。
1.2.2 细胞活力的检测 取生长状态良好的大鼠心肌细胞H9C2,待其融合度为80%左右时,使用胰酶消化,计数细胞后密度为2×105个/ml。加细胞悬液于96孔板中(每孔100 μl),每组设置5个孔,置37℃,5%CO2培养箱中过夜;第2天,将一组细胞取出,放置在1%O2缺氧培养箱中培养,另一组正常培养,缺氧培养至1.5 h后,两组细胞每孔加入10 μl CCK-8溶液,继续缺氧培养1.5 h,共缺氧培养3 h后,取出96孔板,避光,测定450 nm各孔的吸光值。缺氧6、12、24、48 h 细胞活力的检测也如上述步骤。细胞活力的计算:细胞活力=(缺氧细胞OD-空白OD)/(正常细胞OD-空白OD)×100%。
1.2.3 细胞形态变化的检测 利用CellAsic实时细胞检测仪,将仪器配套细胞板(M04S)进行前处理,5%CO2、95%空气、37℃。每孔导入细胞2×105个/ml,12 h贴壁后,5%CO2、5%空气、90%N2、37℃开始缺氧。6、12、24、48 h同一观测地点,10×放大倍数,分别拍摄形态图。
1.2.4 透射电镜观察 收集正常培养细胞和缺氧培养24 h的细胞,分别用2%戊二醛固定,1%锇酸固定1 h,洗涤后丙醛脱水,环氧树脂包埋,切片。使用透射电子显微镜观察并摄片。
1.2.5 细胞活性氧(ROS)检测 取6孔板中正常培养的大鼠心肌细胞与缺氧24 h的细胞,更换新培养基后每孔加入1 μl DCFH-DA,37℃细胞培养箱内避光孵育50 min后消化,无血清培养基重悬。利用流式细胞仪488 nm激发和525 nm发射检测平均荧光强度代表ROS量。
1.2.6 Western印迹检测胞浆细胞色素C蛋白的表达水平 取大鼠心肌细胞H9C2正常培养与缺氧24 h后,使用线粒体分离试剂盒分离出线粒体蛋白。BCA试剂盒测定蛋白浓度,每孔以50 μg样品上样,并进行SDS-PAGE电泳。PVDF膜转膜,5%脱脂奶粉封闭2 h,加入一抗(细胞色素C)4℃孵育过夜,二抗37℃孵育1 h,ECL化学显色,Image Lab软件进行分析。
1.2.7 流式细胞术检测细胞凋亡 使用7-AAD及Annexin V-APC对细胞进行标记,首先取生长状态良好的细胞,胰酶消化后,计数2×106个/ml接种于两块6孔板中,置37℃,5%CO2培
养箱中过夜;其中一块板放入三气培养箱缺氧培养24 h,胰酶消化收集细胞,用含有2% BSA的PBS洗涤细胞2次,收集细胞后,加入500 μl的上样缓冲液重悬,然后加入5 μl AnnexinV-APC冰浴10 min,加入1 μl 7-AAD冰浴10 min后,使用流式细胞仪检测细胞凋亡水平。
1.2.8 坏死细胞检测 使用LDH试剂盒并按照试剂盒说明书进行操作,用于大鼠心肌细胞坏死的检测。
1.3 统计学分析 采用SPSS17.0软件行t检验。
2 结 果
2.1 使用台盼蓝染色法对不同时间段的细胞进行计数 与正常培养的细胞相比,缺氧后细胞数量均明显降低。而随着缺氧时间的延长,缺氧3、6、12、24、48 h后细胞数量呈现下降趋势。见表1。
2.2 细胞形态检测 经CellAisc实时观察,正常氧气浓度培养的心肌细胞全部贴壁生长,细胞核突出明显,贴壁后细胞为菱形、梭形或多角形,伸出伪足,形成不规则的星形并形成放射状排列的细胞簇。开始缺氧6 h后心肌细胞活力开始下降,搏动次数减少,心肌细胞形态开始发生改变,细胞簇周围有部分脱落,使细胞单层由椭圆形变成梭形,缺氧12 h后形态发生很大变化,心肌细胞的胞质出现空泡和粗大颗粒样物质,细胞皱缩、脱落,见图1。
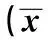
表1 台盼蓝染色细胞计数±s,OD值)
与正常培养组比较:1)P<0.01

图1 利用CellAsic观测缺氧状态下的大鼠心肌细胞(×10)
2.3 透射电镜观察细胞超微结构 正常对照组心肌细胞结构基本正常,核结构正常,线粒体结构清晰。缺氧组可见心肌细胞线粒体排列紊乱、肿胀,空泡或囊泡化,细胞核形状不规则,核膜溶解个被地方甚至消失。外膜不完整,少部分线粒体损伤严重,破裂,溶解,见图2。
2.4 ROS检测结果 缺氧24 h处理能显著提高细胞内的ROS水平,荧光强度也显著增加(P<0.01)。正常培养组与缺氧24 h组中细胞内ROS表达水平分别为0.90±0.20,7.73±1.25,差异有统计学意义(P<0.001)。
2.5 Western印迹检测细胞色素C蛋白的表达水平 正常培养组与缺氧24 h组中细胞色素C表达水平分别为0.48±0.20和1.41±0.30;与正常组比较,缺氧24 h组细胞色素C蛋白的表达水平升高了1.94倍(P<0.05)。见图3。

图2 透射电镜显示的心肌细胞超微结构变化(×25 000)

图3 正常培养组与缺氧24 h组细胞色素C表达水平
2.6 流式细胞术检测结果 正常培养组与缺氧24 h组中细胞凋亡水平分别为0.27±0.02和0.53±0.03,与正常培养组比较,缺血24 h组升高了0.97倍(P<0.05)。
2.7 LDH检测结果 与正常培养组相比(0 h:6.23±3.12,3 h:6.58±3.21,6 h:6.64±0.54,12 h:7.43±2.89,24 h:5.31±4.36,48 h:11.43±2.83),缺氧组的LDH水平(0 h:6.23±3.12,3 h:12.57±0.78,6 h:16.03±2.19,12 h:37.87±7.42,24 h:44.57±3.03,48 h:46.84±6.82)明显上升(P<0.01)。
3 讨 论
缺氧能够造成心肌细胞损伤,最终导致心脏疾病加重。因此,如何抵御缺氧对心肌细胞造成的损伤是延缓心脏病发生发展的有效途径。目前研究表明,缺氧可影响细胞的存活及生长〔5〕,对于缺氧造成的细胞凋亡及细胞损伤的机制也进行了相关的分析〔6,7〕,但这些研究并不系统全面。缺氧会导致细胞生长减慢〔8〕,活力降低。本研究结果也说明缺氧造成细胞活力降低可能会引起细胞死亡。本实验通过实时动态观察,发现随着缺氧6 h开始心肌细胞形态明显受损,直至缺氧48 h完全失去细胞形态而死亡。通过对细胞生长、活力以及形态的观察,同时考虑到时间和细胞受损程度,该实验选择24 h作为最佳缺氧时间点。超微病理改变是反映细胞损伤最直观、最有效的指标〔9,10〕。结果显示,缺氧状态对大鼠心肌细胞的细胞膜、核膜尤其是线粒体可以造成明显损伤。线粒体是心肌细胞中最主要、含量最多的细胞器,也是产生ROS的重要场所。心肌缺氧过程中,在缺氧的作用下氧化应激平衡失调,心肌细胞线粒体内产生大量ROS,导致线粒体膜和细胞膜脂质过氧化、线粒体DNA损伤及细胞凋亡启动〔11〕。因此,线粒体ROS过表达是缺氧损伤机制中的一个重要环节。本研究提示缺氧可能造成了线粒体的损伤。而线粒体在细胞凋亡的过程中起着枢纽作用〔12〕,在细胞受到刺激凋亡时线粒体释放细胞色素C和凋亡诱导因子,从而激发下游的凋亡执行者,在凋亡中线粒体的作用是相当重要的,也比较复杂,是近年来科研的热点。线粒体释放的细胞色素C是重要的凋亡诱导分子〔13〕。本实验利用Western印迹方法和流式细胞术对缺氧24 h细胞进行检测,发现线粒体释放的细胞色素C大量增加,细胞凋亡率也明显增加。说明可能是缺氧造成的线粒体损伤从而引发细胞凋亡〔14〕。有文献表明,缺氧可抑制大鼠心肌细胞的增殖,促进心肌细胞的凋亡,凋亡程度随缺氧时间的延长而加重,随着缺氧时间的延长死亡细胞逐渐增多〔15〕。细胞死亡的方式又分为细胞凋亡和细胞坏死。对细胞坏死,目前普遍的检测手段是LDH检测。LDH是机体能量代谢中的一种重要酶,LDH漏出量多少可反映细胞膜的损伤,其外漏程度可间接反映缺氧受损程度〔16〕,细胞损伤后,胞内LDH大量漏出,从上清液中LDH的含量可反映细胞的损伤程度〔17,18〕。本实验发现,缺氧状态下造成大鼠心肌细胞中LDH的释放量明显增加,细胞死亡率显著上升。
综上所述,本实验说明大鼠缺氧状态下会造成心肌细胞生长减慢、活力降低、形态改变、线粒体损伤和细胞凋亡以及细胞坏死,为深入研究损伤机制和寻求损伤后的保护措施奠定了基础,为临床治疗提供参考依据。
1 Guilbert JJ.The world health report 2002-reducing risks,promoting healthy life〔J〕.Educ Health(Abingdon),2003;16(2):230.
2 Kim JH,Hong SJ,Park CY,etal.Intramyocardial adipose-derived stem cell transplantation increases pericardial fat with recovery of myocardial function after acute myocardial infarction〔J〕.PLoS One,2016;11(6):e0158067.
3 Zhang B,Rong R,Li H,etal.Heat shock protein 72 suppresses apoptosis by increasing the stability of X-linked inhibitor of apoptosis protein in renal ischemia/reperfusion injury〔J〕.Mol Med Rep,2015;11(3):1793-9.
4 Harold F,Philippe M,Claude C,etal.Program and Abstracts of the 5th joint Italian-German purine club meeting:"Fostering translational research on purines by italian-german joint efforts"〔J〕.Purinerg Sig,2014;10(2):369-417.
5 Semenza GL.Hypoxia-inducible factor 1 and cardiovascular disease〔J〕.Ann Rev Phys,2014;(76):39-56.
6 周梦晨,姜桂青,李倩倩,等.IL-37抑制缺氧诱导的细胞凋亡的研究〔J〕.中国病理生理杂志,2016;30(8):1519-20.
7 Aboutabl ME.Constitutive expression and inducibility of CYP1A1 in the H9c2 rat cardiomyoblast cells〔J〕.Toxicol Vitro,2007;21(8):1686-91.
8 郑甲林,郭 涛,张新金,等.乳兔单一左心房肌细胞原代培养及鉴定〔J〕.中国老年学杂志,2015;35(8):4154-6.
9 阮长武,陈 锐,王占成,等.脑钠肽对缺血再灌注心肌细胞凋亡的影响〔J〕.中国民康医学,2010;22(21):2701-3.
10 张晓京,来丽娜,张晓一,等.山茱萸多糖对大鼠心肌缺血再灌注损伤的保护作用及机制探讨〔J〕.中国临床药理学与治疗学,2016;21(7):759-64.
11 涂荣会,钟国强,曾志羽,等.缺氧后处理对缺氧复氧心肌线粒体活性氧及细胞凋亡的影响〔J〕.中国动脉硬化杂志,2012;20(6):499-502.
12 Sarawut K,Sirirat S,Siriporn C,etal.Inhibition of p38 MAPK activation protects cardiac mitochondria from ischemia/reperfusion injury〔J〕.Pharmaceut Biol,2015;53(12):1831-41.
13 Abdelwahid E.Hot topic:why apoptosis in pediatric disorders〔J〕?Curr Pediatr Rev,2011;7(4):262-5.
14 Liu H,Cui C.Role of microRNA-195 in cardiomyocyte apoptosis induced by myocardial ischaemia-reperfusion injury〔J〕.J Genet,2016:95(1):99-108.
15 王 钰,陈长春,尹晓娟.新生鼠体外神经干细胞缺氧模型的建立〔J〕.2015;23(12):23-6.
16 高 丽,张 哲,许树钦,等.赤芍总苷对过氧化氢所致H9C2心肌细胞损伤的保护作用〔J〕.时珍国医国药,2011;5(22):1194-5.
17 张 敏,郭彩霞,杜凤和.sRAGE对缺氧/复氧心肌细胞氧化应激的影响〔J〕.首都医科大学学报,2012;33(4):488-93.
18 胡 玥.厚朴对大鼠心肌缺血/再灌注损伤的保护作用〔J〕.中国当代医药,2016;15:103-5.
〔2016-10-27修回〕
(编辑 李相军)
The mechanism of hypoxia on rat myocardial cell damage
SONG Jia-Hui,NIU Nan,ZHU Ming-Xing,etal.
Basic Medical College of Ningxia Medical University,Yinchuan 750004, Ningxia, China
Objective To investigate the damage and the mechanism of hypoxia on rat cardiomyocytes H9C2 of rats.Methods The cardiac muscle cell line H9C2 of rats was cultured under the conditions of 1%O2, 5%CO2, 94%N2and keeping for 3,6,12,24, 48 h.The cell count and the cell growth curves were plotted using the Trypan Blue,the cell survive rate was detected by CCK-8 assay. The degree of cell necrosis was detected by lactate dehydrogenase (LDH) kit, the flow cytometry was used to detect the apoptosis rate, mitochondrial cytochrome C was detected by Western blot, the reactive oxygen was tested by reactive oxygen assay kit, the intracellular structure was observed by TEM.Results Under the condition of hypoxic, while the time of hypoxia increasing, the cell growth and survival rate were significantly decreased, cell morphology had been changed significantly, the release rate of LDH was obviously increased, the apoptosis rate was clearly increased, the cytochrome enzymes was increased, the levels of reactive oxygen species were elevated, cell structure was damaged apparently.Conclusions Hypoxia could change the myocardial cell morphological, slow down the rate of cell growth, causing the cell necrosis or apoptosis and damaging the myocardial mitochondrial.
Hypoxia; Mitochondrial damage; Apoptosis; Necrosis
国家自然科学基金项目资助(81360042)
宋 熔(1971-),女,副主任医师,主要从事心力衰竭发病机制与防治研究。 赵 巍(1960-),男,教授,主要从事分子遗传研究。
宋佳卉(1991-),女,在读硕士,主要从事分子遗传学研究。
R34
A
1005-9202(2017)05-1044-04;
10.3969/j.issn.1005-9202.2017.05.002
1 宁夏医科大学科技中心 2 宁夏医科大学临床医学院
3 中国人民解放军第五医院重症医学科

