血管紧张素Ⅱ对血管内皮细胞线粒体转录因子A表达的影响
侯维娜 王瑞鹃 王鹏飞 侯瑞田 董文超 丁振江
(承德医学院,河北 承德 067000)
血管紧张素Ⅱ对血管内皮细胞线粒体转录因子A表达的影响
侯维娜 王瑞鹃1王鹏飞1侯瑞田1董文超1丁振江1
(承德医学院,河北 承德 067000)
目的 探讨血管紧张素(Ang)Ⅱ对血管内皮细胞线粒体转录因子A(TFAM)表达及细胞功能的影响。方法 将不同浓度的Ang Ⅱ(1×10-7~1×10-5mol/L)与原代人脐静脉细胞(HUVECs)共孵育,在24 h用免疫印迹技术和RT-PCR分别检测TFAM的表达量;在12 h用流式细胞仪检测线粒体膜电位及细胞的凋亡率变化。结果 Ang Ⅱ以浓度依赖的方式降低TFAM的表达量;随着Ang Ⅱ浓度升高,线粒体膜电位降低水平、细胞凋亡率增加(P<0.01)。结论 Ang Ⅱ降低HUVECs TFAM表达量及导致细胞损伤。
血管紧张素Ⅱ;人脐静脉内皮细胞;线粒体转录因子A
血管紧张素(Ang)Ⅱ作用于内皮细胞后可产生大量的活性氧(ROS),ROS大量累积引起的氧化应激会导致细胞损伤,尤其是早期对线粒体的影响可贯穿动脉粥样硬化(AS)病变产生的早期阶段〔1~3〕。适量的ROS可上调存活途径增强抗氧化应激基因的表达;随着其浓度的升高,可诱导DNA损伤,甚至细胞凋亡。有研究显示,线粒体转录因子A(TFAM)在一定程度上可对抗ROS产生的氧化应激,使细胞免受损伤〔4〕,但是高浓度的ROS可抑制TFAM表达,导致线粒体功能障碍,甚至引起细胞死亡。本实验将不同浓度的AngⅡ作用于内皮细胞,观察内皮细胞中TFAM的表达及细胞的功能变化。
1 材料与方法
1.1 主要试剂和仪器 原代脐静脉内皮细胞(HUEVCs,ScienCell),Ang Ⅱ(Millipore Corporation),完全培养基(ScienCell,Catalog Number:1001),单克隆兔抗人一抗(Abcam),山羊抗兔二抗(KPL),Trizol(ambion),FastQuant RT Kit(with gDNA)第一链合成系统试剂盒(TIANGEN 公司),SuperRealPreMixPlus(SYBR Green)试剂盒(TIANGEN 公司),引物设计合成(TaKaRa Biotechnology公司),检测细胞膜电位试剂盒(SIGMA-ALDRICH),凋亡试剂盒(BD),DYY-III2稳压稳流电泳仪(北京六一仪器厂),RT-PCR 扩增仪(Roche公司),流式细胞仪(CYTOMICS FC 500)。
1.2 HUVES细胞培养 将原代细胞置于37℃、5%CO2培养箱,用ScienCell公司的内皮培养基隔1 d换液1次,培养至6~7代时取对数生长期的细胞用于实验,细胞消化液为0.25%+EDTA的胰蛋白酶。
1.3 不同浓度的Ang Ⅱ对HUVECs的影响 收集对数生长期的HUVECs细胞,调至1×106/ml接种于6孔板培养12 h,加入药物终浓度为10-7、10-6、10-5mol/L的Ang Ⅱ作为实验组(分别为B、C、D组),对照组(A组)不加药物。实验组和对照组均在于不加血清的培养基中培养24 h。
1.3.1 Western印迹检测细胞TFAM蛋白表达 提取蛋白,进行BCA蛋白定量,煮沸蛋白,配胶,加样后进行电泳、转膜、封闭。将膜置于TFAM、β-actin一抗中4℃孵育过夜,洗膜后将膜置于二抗中孵育2 h。曝光,定影,扫描胶片并用软件进行分析。
1.3.2 RT-PCR检测各组细胞TFAM mRNA表达 引物设计:TFAM上游引物5′ GTTGCAACTTCTGTGGAAGCAT 3′,下游引物5′TCCGCCCTATAAGCATCTTGA 3′;β-actin上游引物5′AGGCGAGCATCCCCCAAAG 3′,下游引物5′GGGCACGAAGGCTCATCATT 3′,由TaKaRa Biotechnology有限公司合成。总RNA的提取:使用美国Invitrogen公司Trizol试剂,按照试剂说明书中方法对总RNA进行提取。逆转录RT反应,按TIANGEN 生物工程公司两步法反转录试剂盒说明书操作。PCR扩增:每个反应体系均为 25 μl,TFAM 反应条件:预变性 95℃,10 min;变性95℃,10 s;退火64℃,20 s;延伸72℃,15 s;进行45个循环。
1.3.3 流式细胞仪监测细胞内活性氧、线粒体膜电位、细胞凋亡率 按照线粒体膜电位试剂盒说明书,JC-10孵育20 min,离心后收集细胞,加入Assay buffer,置于流式细胞仪检测。按照试剂盒说明书进行FITC、PI双染色,37℃避光放置30 min,置于流式细胞仪检测。
1.4 统计学方法 采用SPASS19.0软件行t检验,单因素方差分析。
2 结 果
2.1 不同浓度Ang Ⅱ作用于HUVECs TFAM蛋白、mRNA的表达水平 不同浓度的Ang Ⅱ(0,10-7,10-6,10-5mol/L)作用于细胞24 h后,各组TFAM蛋白相对表达量为0.94±0.04、0.78±0.09、0.48±0.09、0.40±0.73,实验组蛋白表达量均较对照组减少,具有一定的浓度依赖性(均P<0.01);同时,A、B、C、D组TFAM mRNA的相对表达量分别为0.94±0.08、0.78±0.09、0.44±0.07、0、40±0.08,与TFAM蛋白的表达水平相似,B、C、D组TFAM mRNA相对表达量与A组相比明显减少(均P<0.01)。见图1。
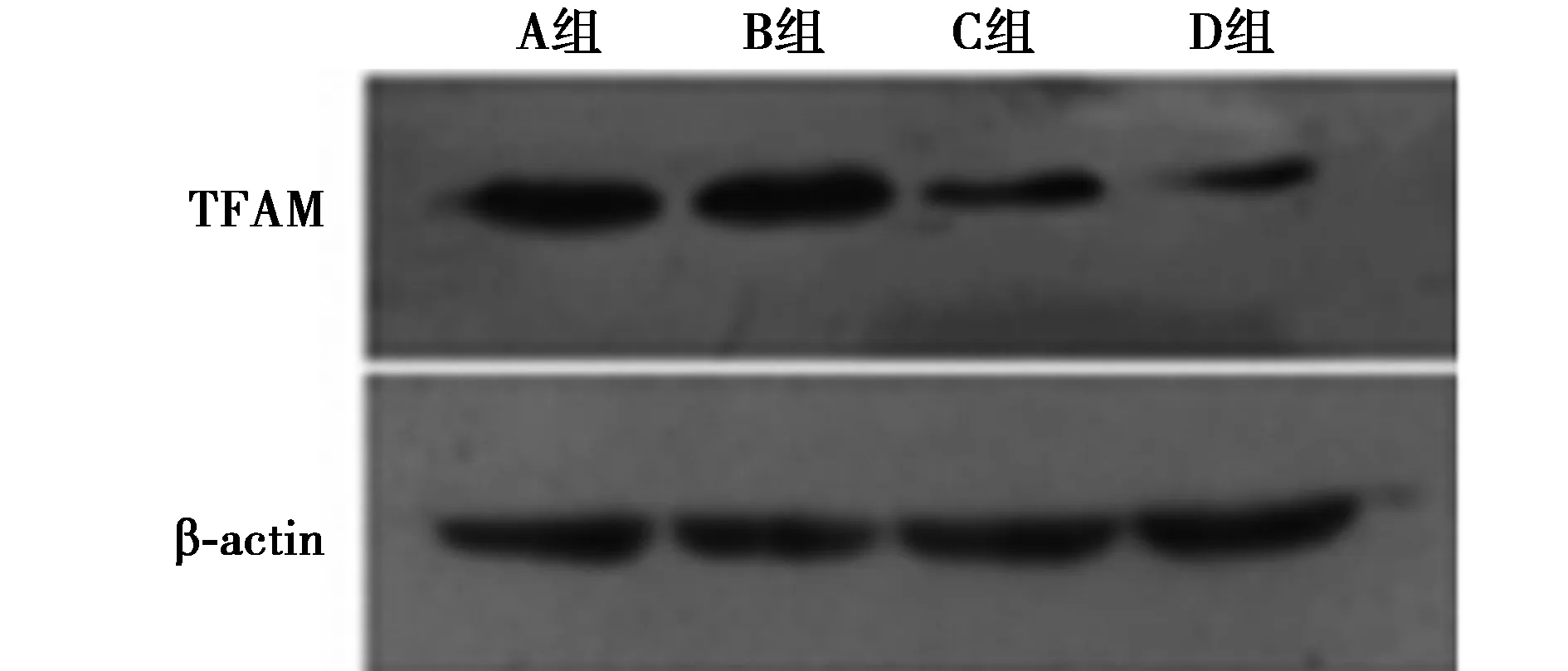
图1 不同浓度的Ang Ⅱ作用于HUVECs后TFAM的表达量
2.2 流式细胞术检测不同浓度的Ang Ⅱ对HUVECS膜电位水平、凋亡率 细胞膜电位检测:JC-10 在线粒体内形成多聚体,其发射光为红色荧光;细胞发生早期凋亡前,线粒体膜电位即表现下降,JC-10以单体的形式存在于胞质内发绿色荧光。不同浓度的Ang Ⅱ作用细胞24 h后,A、B、C、D组细胞的线粒体膜电位减低水平为26.98±4.46、41.74±4.24、60.47±4.52、70.16±3.07,实验组较对照组线粒体膜电位下降增多(P<0.01)。细胞凋亡显示,不同浓度的Ang Ⅱ作用于细胞后,各组的早期凋亡率及晚期凋亡率分别为4.0%、1.8%,10.8%、2.9%,5.2%、8.2%,1.4%、15%。实验组早期凋亡多于A组,随着Ang Ⅱ浓度的增加早期凋亡减少,晚期凋亡增加。
3 讨 论
冠状动脉AS主要表现为炎症引起血管内皮细胞功能紊乱及泡沫细胞形成的慢性退行性病变〔5〕,内皮细胞的功能失调可直接导致AS的发生发展〔6〕。本研究结果显示,Ang Ⅱ可下调HUVECs TFAM表达量,增加线粒体膜电位的下降率及细胞的凋亡率。
ROS主要在线粒体电子传递、氧化磷酸化和三羧酸(TCA)循环的过程中产生。正常情况下,ROS参与关键信号通路调节细胞适应性反应,包括细胞生长和分化〔7〕,一旦失去平衡,ROS过量积累产生的氧化应激可对内皮细胞线粒体、DNA、蛋白质的空间结构造成损伤〔8〕。研究显示机体内存在Ang Ⅱ刺激细胞使细胞产生ROS的途径:过多Ang Ⅱ通过调节NADPH氧化酶(NOX)的活性增加ROS的产生〔9,10〕;另外研究显示,刺激产生的ROS可作为信号传导因子,诱导Rac及P40向细胞膜移动,激活蛋白激酶C,诱导内皮细胞NADPH氧化酶活化,导致线粒体的氧化损伤〔11,12〕。
线粒体的早期损伤主要表现为调节组成线粒体生物合成的蛋白合成减少,其中作为线粒体转录及复制的关键激活因子及TFAM在氧化应激中起着重要的作用。TFAM是核基因编码的一种小分子多肽,可维护线粒体DNA的完整性,从而抑制细胞凋亡〔13〕。正常机体中氧化应激损伤时,TFAM增加的表达量可导致线粒体的含量增加,线粒体膜电位增高及凋亡量减少〔14,15〕。Picca等〔16〕报道显示细胞受到氧化应激时,细胞内的PKA-CREB(G蛋白耦联-cAMP 反应原件结合蛋白)通路激活,上调过氧化物酶体增生物激活受体γ共激活因子(PGC-1α)、核呼吸因子(NRF)-1的表达量,进而增加TFAM 的表达量;TFAM 与线粒体DNA的亲和力增加,调节线粒体DNA的拷贝数,维护线粒体DNA的完整和稳定,促进线粒体DNA的损伤修复。然而,氧化应激产物的异常积累会损伤细胞核DNA的功能导致TFAM的表达量降低。本研究显示Ang Ⅱ下调 TFAM表达量,说明细胞对抗氧化应激过度刺激时细胞发生不可逆的损伤,导致TFAM表达量减少;也有研究显示可能与细胞内自身的负反馈相关,细胞受到ROS刺激后,线粒体内TFAM的含量增加导致核内的TFAM与NRF-1结合形成免疫共沉淀,导致NRF-1的表达量降低,细胞质内的TFAM表达量降低〔17〕;同时有研究显示,细胞质中Lon 的蛋白水解酶可以使磷酸化的TFAM裂解,高浓度的ROS抑制HSP60-70-TFAM复合物形成,从而抑制线粒体的生物合成〔18〕。
目前认为线粒体在细胞的死亡中起关键作用,承载着为细胞制造能量的重要功能,其功能受损会导致整个细胞的功能障碍。功能障碍及细胞的完整性遭到破坏的内皮细胞,会使脂质代谢紊乱,形成脂质斑块,最终形成AS。TFAM在线粒体的生物合成中发挥重要作用,其含量的变化必然引起线粒体功能改变,线粒体膜电位的变化便是最敏感的指示〔19〕,本研究发现TFAM表达量减少将直接引起线粒体功能障碍。血管内皮细胞作为血管壁的第一层屏障,其完整性具有重要的作用,在导致细胞凋亡的三条基本途径和诱导的不同类型的细胞凋亡过程中均出现了MMP表达下降其,往往早于细胞形态学的改变。Lodha等〔20〕对肾脏细胞的研究发现,Ang Ⅱ会引起ROS的产生使细胞直接进入凋亡程序,进而发展为肾小管硬化。本研究也同时发现了高浓度Ang Ⅱ(10-5mol/L)可直接导致细胞不经过早期凋亡直接过渡到晚期凋亡。
近期研究显示,可通过检测外周血TFAM mRNA的表达量预测骨关节疾病,同时外周血TFAM mRNA的表达量与软骨细胞TFAM的表达量呈正相关〔21〕。冠心病患者内皮细胞功能损伤严重,由此可推断TFAM在体内表达量减少,在进一步的研究中,可以通过与正常人进行对照观察TFAM在冠心病中的表达量,进一步研究其可否作为早期检测冠心病的标志因子。另外,研究显示在治疗心力衰竭中,体外将TFAM mRNA引入细胞内治疗心力衰竭,可增加细胞线粒体的功能〔19〕。推测在治疗AS时可以通过靶向治疗改善内皮细胞线粒体功能进而保护内皮细胞和修复内皮细胞的损伤。
1 Morales MG,Abrigo J,Meneses C,etal.The Ang-(1-7)/Mas-1 axis attenuates the expression and signalling of TGF-β1 induced by AngⅡ in mouse skeletal muscle〔J〕.Clin Sci (Lond),2014;127(4):251-64.
2 Nishimura S,Manabe I,Nagasaki M,etal.In vivo imaging visualizes discoid platelet aggregations without endothelium disruption and implicatescontribution of inflammatory cytokine and integrin signaling〔J〕.Blood,2012;119(8):e45-56.
3 Park M,Vittinghoff E,Ganz P,etal.Role of soluble endothelial cell-selective adhesion molecule biomarker in albuminuria and kidney function changes in patients with coronary artery disease:the heart and soul study/significance〔J〕.Arterioscler Thromb Vasc Biol,2014;34(1):231-6.
4 Choi BJ,Matsuo Y,Aoki T,etal.Coronary endothelial dysfunction is associated with inflammation and vasa vasorum proliferation in patients with early atherosclerosis〔J〕.Arterioscler Thromb Vasc Biol,2014;34(11):2473-7.
5 Verma S,Wang CH,Li SH,etal.A self-fulfilling prophecy:C-reactive protein attenuates nitric oxide production and inhibits angiogenesis〔J〕.Circulation,2002;106(8):913-9.
6 Vita JA.Endothelial function〔J〕.Circulation,2011;124(25):906-12.
7 Hamanaka RB,Chandel NS.Mitochondrial reactive oxygen speciesregulate cellular signaling and dictate biological outcomes〔J〕.Trends Biochem Sci,2010;35(9):505-13.
8 BalabanRS,Nemoto S,Finkel T.Mitochondria,oxidants,and aging〔J〕.Cell,2005;120(4):483-95.
9 Touyz RM.Reactive oxygen species and angiotensin II signaling in vascular cells-implications in cardiovascular disease〔J〕.Braz J Med Biol Res,2004;37(8):1263-73.
10 Wilkinson-Berka JL,Rana I,Armani R,etal.Reactive oxygen species,Nox and angiotensin Ⅱ in angiogenesis implications for retinopathy〔J〕.Clin Sci(Lond),2013;124(10):597-615.
11 Elnakish MT,Hassanain HH,Janssen PM,etal.Emerging role of oxidative stress in metabolic syndrome and cardiovascular diseases:important role of Rac/NADPH oxidase〔J〕.J Pathol,2013;231(3):290-300.
12 Höll M,Koziel R,Schäfer G,etal.ROS signaling by NADPH oxidase 5 modulates the proliferation and survival of prostate carcinoma cells〔J〕.Mol Carcinog,2016;55(1):27-39.
13 Danisovic L,Varga I,Zamborsky R,etal.The tissue engineering of articular cartilage:cells,scaffolds and stimulating factors〔J〕.Exp Biol Med (Maywood),2012;237(1):10-7.
14 Chakrabarty S,D′Souza RR,Bellampalli R,etal.Comprehensive DNA copynumber profile and BAC library construction of an Indian individual〔J〕.Gene,2012;500(2):186-93.
15 Sanjiban Chakrabarty,Reena Reshma D′Souza.Upregulation of TFAM and mitochondria copy number in human lymphoblastoid cells〔J〕.Mitochondrion,2014;14(1):52-8.
16 Picca A,Lezza AM.Regulation of mitochondrial biogenesis through TFAM-mitochondrial DNA interactions:usefu linsights from aging and caloria restriction studies〔J〕.Mitochondrion,2015;15(1):67-75.
17 Lee EJ,Kang YC,Park WH,etal.Negative transcriptional regulation of mitochondrial transcription factor(TFAM)by nuclear TFAM〔J〕.Biochem Biophys Res Commun,2014;450(1):166-71.
18 Wenz T.Regulation of mitochondrial biogenesis and PGC-1 alpha under cellular stress〔J〕.Mitochondrion,2013;13(2):134-42.
19 Ikeda M,Ide T,Fujino T,etal.Overexpression of TFAM or twinkle increases mtDNA copy number and facilitates cardioprotection associated with limited mitochondrial oxidative stress〔J〕.PLoS One,2015;10(3):e0119687.
20 Lodha S,Dani D,Mehta R,etal.Singhal,Angiotensin Ⅱ-induced mesangial cell apoptosis:role of oxidative stress〔J〕.Mol Med,2002;8(12):830-40.
21 陈斌伟,杨进顺,黄 彦,等.骨关节炎患者线粒体转录因子A表达与线粒体DNA拷贝数关系的研究〔J〕.临床和实验医学杂志,2015;14(12):976-9.
〔2016-08-31修回〕
(编辑 郭 菁)
国家自然科学基金(81000068);河北省引进留学人员资助项目(C2015005001)
王瑞鹃(1975-),女,博士,副主任医师,主要从事心血管疾病研究。
侯维娜(1989-),女,在读硕士,主要从事心血管内科研究。
R3
A
1005-9202(2017)05-1059-03;
10.3969/j.issn.1005-9202.2017.05.008
1 承德医学院附属医院心脏内科

