黑猩猩肠道阿米巴原虫的纯化培养及形态观察
邹 莹, 陈 蓉, 章小小, 李俊娴, 王德云
(1.南京农业大学动物医学院, 江苏南京210095 ; 2.南京红山森林动物园, 江苏南京210028)
黑猩猩肠道阿米巴原虫的纯化培养及形态观察
邹 莹1, 陈 蓉2, 章小小2, 李俊娴2, 王德云1
(1.南京农业大学动物医学院, 江苏南京210095 ; 2.南京红山森林动物园, 江苏南京210028)
1915年,本园1只黑猩猩经常反复出现腹泻症状,粪便镜检发现阿米巴原虫包囊,用药后病愈。现采集该黑猩猩慢性感染期粪便进行形态学鉴定,发现该黑猩猩为结肠内阿米巴和迪斯帕内阿米巴或溶组织内阿米巴混合感染。使用营养琼脂双向培养基进行纯化培养成滋养体(后期进行分子鉴定为迪斯帕内阿米巴滋养体)并对其进行形态观察,为日后镜检鉴定提供了依据,并为其分子学鉴定提供了虫体原料。
1 材料与方法
1.1 培养基配制 本试验采用经杨光友等人改良后的营养琼脂双相培养基[1-2],其中A固体部分包括牛肉浸膏1.5 g、蛋白胨2.5 g、琼脂7.5 g和B部分液体。B液体部分包括NaCl 8 g、KCl 0.2 g、CaCl20.2 g、MgCl20.01 g、Na2HPO42 g、KH2PO40.3 g、蒸馏水1 000 mL。
先配制液体部分,CaCl2和MgCl2分装于不同的容器,其他液体部分同装一个容器,高压灭菌,充分冷却后混合均匀。取500 mL混合液加入固体部分,沸水浴2~3 h,完全溶解后趁热分装试管,每管5 mL。高压灭菌后趁热放成斜面,冷却,放入冰箱中保存备用,余下的500 mL液体保留。接种前,每管中加B部分液体4.5 mL、兔血清0.5 mL、灭菌米粉20 mg、青霉素1 000 lU和链霉素2 000 μg。
1.2 粪样处理与形态观察 粪样取自本园的圈养黑猩猩。取新鲜粪样常规碘染镜检,初步鉴定是否有碘染的阿米巴包囊。向盛有50 g粪便的小烧杯加入适量蒸馏水,搅拌至混合均匀,结合260目筛过滤。将滤液于离心机中3 000 r/min离心5 min,弃上清,沉淀的粪泥作接种用[3]。吸取处理后的粪样接种至配好的营养琼脂双向培养基,每管100 μL,于37 ℃恒温培养箱培养,后每24 h取培养液进行1次形态学观察。出现大量的成熟期四核包囊后,取100 μL培养液接种于新的培养基中促进包囊破解为滋养体及滋养体的繁殖[4-5]。
2 结果
2.1 粪便中阿米巴包囊及囊后滋养体 粪样直接镜检可见未成熟的、成熟的迪斯帕内阿米巴包囊、成熟的结肠内阿米巴包囊以及由于染色质量不高而分辨不出的包囊和囊后滋养体。所见的未成熟迪斯帕内阿米巴包囊多为单核包囊,圆球形,直径为15 μm左右,有囊壁,1个核,拟染色体和糖原泡染色不明显(图1a)。成熟的迪斯帕内阿米巴包囊为感染期包囊,无拟染色体和糖原泡,有4个泡状核,包囊碘染后呈淡棕色,直径13 μm左右,内外质分解明显[6](图1b)。成熟的结肠内阿米巴包囊(图1c)包囊较大,10~20 μm,圆球形,染色较浅,可见近8个细胞核,未见到糖原体和拟染色体,可见核仁,内外质分解明显。核周染色质粒分布不均,核仁大,多偏位。囊后滋养体(图1d)呈不规则扁圆形,较包囊稍大,直径约20 μm,不运动,内质与外质分界不明显。
2.2 培养基中阿米巴包囊与滋养体 培养1周后,培养基中基本变为成熟即将破解逸出的四核迪斯帕内阿米巴包囊[7](图2a)。接种入新培养基的阿米巴包囊48 h后基本消失,培养基中可见大量运动力不足的滋养体(图2b)与少数活性强盛快速运动的滋养体(图2c),折光性较强。虫体圆形或椭圆形,直径9~20 μm,进行二分裂繁殖。内置颗粒小而均匀,细胞核1个,核膜内缘有一层排列整齐的染色质粒,中央有一核仁。能运动的个体大多呈长葫芦形,具透明伪足,以翻滚、摆动和旋转的方式行定向运动[8-9]。
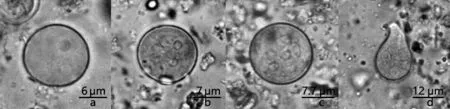
图1 阿米巴包囊与囊后滋养体
a:未成熟迪斯帕内阿米巴包囊(400×);b:成熟迪斯帕内阿米巴包囊(400×); c:成熟结肠内阿米巴包囊(400×);d:囊后滋养体(400×)
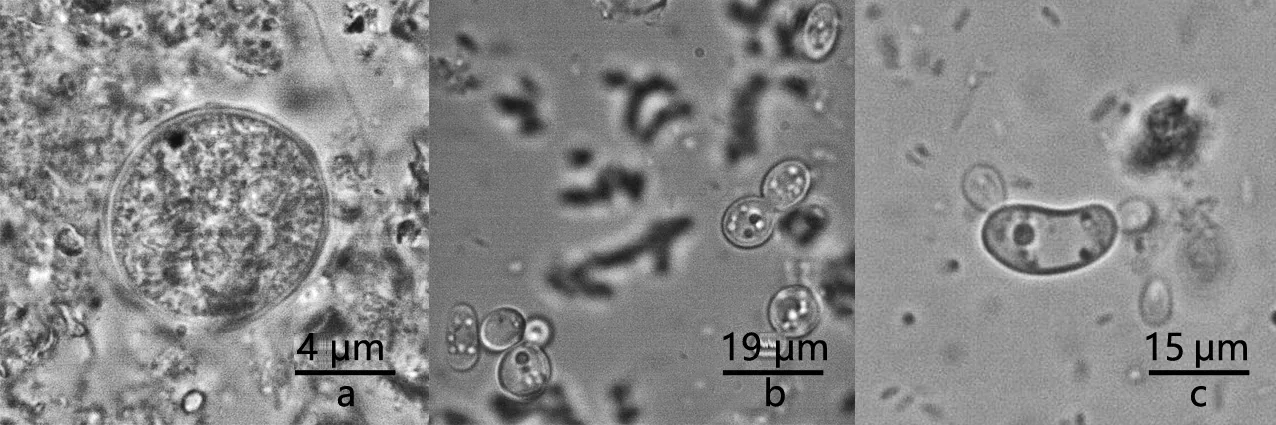
图2 迪斯帕内阿米巴包囊与滋养体
a:成熟迪斯帕内阿米巴包囊(1 000×); b:运动力不足的滋养体(400×); c:快速运动的滋养体(400×)
3 讨论
阿米巴类感染在动物园动物中发现率不低,尤以灵长类的肠道感染居多[10~12]。肠道阿米巴原虫,种类虽多,但惟有溶组织内阿米巴被认为有致病力,可引起脓血痢疾、肝脓肿、肺脓肿等病变。因此,不同种肠道阿米巴的形态观察及鉴别在临床诊断上有着重要意义。1993年重新划出的新的种-迪斯帕内阿米巴与溶组织内阿米巴形态相似、生活史相同,从形态上无法鉴定[13],常误诊。结肠内阿米巴直径略大于溶组织内阿米巴,在我国与其平行分布,发现时有必要继续寻找后者[14]。
结肠内阿米巴和迪斯帕内阿米巴在包囊形态上有较为明显的区别。本试验有以下总结:两者包囊都有囊壁,且其未成熟的包囊都常有较大糖原泡,但结肠内阿米巴包囊较大,细胞核1~8个,多为8个,呈亮圈状。迪斯帕内阿米巴滋养体内质颗粒小而均匀,结肠内阿米巴则含有食物泡。若显像清楚,可看见迪斯帕内阿米巴核周染色质粒大小均匀,排列整齐,核仁小,多位于中央。结肠内阿米巴则核周染粒粗,排列不规则,核仁也较大,常为偏心位。拟染色体偶见,呈碎片状。
结肠内阿米巴和迪斯帕内阿米巴能够通过包囊形态直接区别,但是迪斯帕内阿米巴和溶组织内阿米巴在形态和生活史上相同。此外,迪斯帕内阿米巴是无侵袭性的阿米巴[13],感染率是溶组织内阿米巴的9倍,过去估计的溶组织内阿米巴感染率中很可能90%属于迪斯帕内阿米巴感染[6]。因此,在临床中发现溶组织内阿米巴感染或发病时,注意排除迪斯帕内阿米巴感染,从而指导临床用药。
该黑猩猩粪样直接镜检时发现了较大量结肠内阿米巴包囊与一些囊后滋养体,说明其为两种阿米巴原虫混合感染。但在接种培养基后,仅迪斯帕内阿米巴生长为滋养体。造成这种现象是由于迪斯帕内阿米巴活力较强,并且所采集为用药后的粪便,结肠内阿米巴较为敏感,导致纯化培养时仅迪斯帕内阿米巴生长。
在众多阿米巴分离培养基中,仅血清和米粉是不可缺少的。采用传统的LES培养基多次培养后的阿米巴虫体会出现生长衰退、伪足变短、虫体变圆、甚至无繁殖能力等退化现象[15]。经杨光友等人改良后的培养基改进了这一状况,降低了培养成本,缩短了培养时间,提高了培养质量,其繁殖的滋养体数在48 h后能达到最大值[1-2]。但在本试验中,繁殖出一定量的滋养体用时较长,并且由粪样直接培养的培养基内包囊成熟后难以破裂,需再一次接种于新的培养基才能逸出滋养体。其原因是在体内感染时,感染性包囊摄入后需在回肠末端或结肠中性或碱性环境中,通过虫体运动和肠道内酶的作用才能使虫体脱囊逸出。本次试验的粪样采取并非在宿主发病期,且宿主前期有甲硝唑服用史,粪便中包囊基本为单核包囊,因此包囊前期的培养比较困难,也用时很长。同时,该培养基作为多生态培养基,经过长时间的培养,其pH值下降,甚至变为酸性环境,不利于虫体脱囊。
迪斯帕内阿米巴与结肠内阿米巴均为无致病力的阿米巴,可见该黑猩猩粪检见大量阿米巴包囊应该是腹泻的继发现象,也不排除虫体内共生菌致病的可能性。临床遇见此类情况时,应在对症治疗的同时对虫体进行鉴定,以确定其是不是真正病原,以免误诊延长病程。此类阿米巴虽无致病力,当也可在动物疾病发生时大量增殖加重病情,因此要注意饲料、饮水卫生,做好消毒与灭虫,避免不同品种不同个体间的交叉感染。此外,已感染个体的粪便内包囊数量也可做肠道健康状况的指征,指导兽医在动物出现临床症状前的预防性用药。
[1] 杨光友,黄道超,姜波,等. 凹甲陆龟溶组织内阿米巴原虫病的病原分离培养与鉴定[J]. 中国预防兽医学报,2007,29(4):248-251.
[2] 姜波.猕猴溶组织内阿米巴原虫病病原分离鉴定及凝集素hgl基因的原核表达[D].雅安:四川农业大学.2008.
[3] 刘慧,孙晓东,聂仁华,等. 3种方法检测粪便中溶组织内阿米巴的结果比较[J]. 中国病原生物学杂志,2008,3(9):679-680,789.
[4] Clark C G,Diamond L S. Methods for Cultivation of Luminal Parasitic Protists of Clinical Importance[J]. Clin Microbiol Rev,2002,15(3):329-341.
[5] Thelma H Dunnebacke. The Ameba Balamuthia mandrillaris Feeds by Entering into Mammalian Cells in Culture[J]. J EUKARYOT MICROBIOL,2007,54(5):452-464.
[6] 夏梦岩,高飞,李小静,等.阿米巴病的实验诊断研究进展[J]. 国外医学临床商务化学与检验学分册,2002,23(2):91-92
[7] 陈建平,王光西. 人体寄生虫学彩色图谱[M]. 成都:四川大学出版社,2004:I-5.
[8] 刘鸣一. 在不同条件下溶组织内阿米巴滋养体的形态观察[J]. 动物学杂志,1988,23(3):1-2.
[9] 崔黎明,刘利,施雨露,等. 溶组织内阿米巴滋养体在液体培养基中运动方式的观察[J]. 白求恩医科大学学报,1998,24(6):589.
[10] 李健,全琛宇,施维,等.广西地区人工驯繁猕猴、食蟹猴胃肠道寄生虫感染情况的初步调查[J].实验动物与比较医学,2013,33(4):279-284.
[11] 吕向辉,陈旭旭,袁美群,等. 圈养川金丝猴、猕猴肠道寄生虫感染及其形态观察[J]. 经济动物学报,2010,14(2):92-95.
[12] 蔡娟,乔继英,张旭,等. 陕西圈养珍稀野生动物肠道寄生虫感染及其形态观察[J]. 动物学杂志,2009,44(3):63-69.
[13] Myjak Przemyslaw, Kur Józef, Pietekiewicz Halina, Kotlowski Andrzej,etal. Molecular Differentiation of Entamoeba histolytica and Entamoeba dispar from Stool and Culture Samples Obtained from Polish Citizens Infected in Tropics and in Poland[J]. Acta Protozool,2000,39: 217-224.
[14] 叶砒婧,姚辉,向左甫. 非人灵长类肠道寄生虫研究进展[J]. 安徽农业科学,2013,41(12):5384-5388,5391.
[15] 陶红,施自伦,周丽丽,等. 阿米巴原虫病的实验诊断研究进展[J]. 中外健康文摘,2010,29(7):28-30.
2016-04-28
邹莹(1991—),女,硕士生,主要从事动物疾病研究, E-mail: 2015807152@njau.edu.cn
王德云,E-mail: dywang@njau.edu.cn
S852.71
B
0529-6005(2017)02-0104-02

