论中药质量源于设计
徐冰+史新元+吴志生+张燕玲+王耘+乔延江

[摘要]药品质量源于设计(quality by design,QbD),形成于生产过程,优化提高于生命周期。该文在回顾制药QbD发展历程的基础上,围绕质量设计、质量控制和质量改进详细解读了制药QbD实施方略。在分析中药研发和生产应用QbD难点和特点的基础上,提出中药QbD的“四全”模式,即全局设计、全息分析、全面控制和全程优化,体现了中药质量设计的系统观和整体观。在全局设计中,构建以临床疗效为导向和以多学科理论知识为基础的中药质量问题空间和解决方案空间。全息分析中重视“析”的方法和技术,具备更高层次的中药质量理解和设计整合功能。提出综合应用检验质量控制、统计质量控制、预测质量控制和智能质量控制实现中药产品质量一致性和工艺系统可靠性。全程优化致力于生命周期内的中药质量和过程能力改进。实施QbD有利于化解中药研发和制造生态系统内在矛盾,为中药质量和产业效益的提升提供保障。
[关键词]质量源于设计; 中药; 设计思维; 质量一致性; 工艺系统可靠性
[Abstract]The pharmaceutical quality was built by design, formed in the manufacturing process and improved during the product′s lifecycle Based on the comprehensive literature review of pharmaceutical quality by design (QbD), the essential ideas and implementation strategies of pharmaceutical QbD were interpreted Considering the complex nature of Chinese medicine, the "4H" model was innovated and proposed for implementing QbD in pharmaceutical development and industrial manufacture of Chinese medicine product "4H" corresponds to the acronym of holistic design, holistic information analysis, holistic quality control, and holistic process optimization, which is consistent with the holistic concept of Chinese medicine theory The holistic design aims at constructing both the quality problem space from the patient requirement and the quality solution space from multidisciplinary knowledge Holistic information analysis emphasizes understanding the quality pattern of Chinese medicine by integrating and mining multisource data and information at a relatively high level The batchtobatch quality consistence and manufacturing system reliability can be realized by comprehensive application of inspective quality control, statistical quality control, predictive quality control and intelligent quality control strategies Holistic process optimization is to improve the product quality and process capability during the product lifecycle management The implementation of QbD is useful to eliminate the ecosystem contradictions lying in the pharmaceutical development and manufacturing process of Chinese medicine product, and helps guarantee the cost effectiveness
[Key words]quality by design (QbD); Chinese medicine; design thinking; quality consistence; process system reliability
1985年,著名質量管理学家Julan J M博士在总结其质量管控经验和方法的基础上,提出质量源于设计(quality by design,QbD)[1],与Deming的质量十四点原则和PDCA循环[2]、Feigenbaum的全面质量管理(TQC)[3]、今井正明的持续改善(Kaizen)[4]等方法和理念共同奠定了现代质量管理的基础。进入21世纪,人用药品注册技术国际协调会(ICH)认识到科学知识可提高产品开发和控制的自由度,并于2003年成立质量专家工作组(EWG),针对创建新的适用于产品生命周期的制药质量体系达成一致认识[5]。2005年,在ICH Q8指南中定义了制药QbD[6],旨在将先进的管理学原则和以科学为本的药品研发制造规律融合集成,以提高药品质量,更好地保护患者利益。
中药作为我国独特和具有原创优势的卫生资源,在防病治病和健康服务中发挥着重要作用。与化学药品相比,中药原料质量的不确定性、物质基础和生产工艺的复杂性、以及中药质量标准和临床疗效之间的模糊性,增加了中药研发和生产实施QbD的难度。自2013年起,国内部分高校、中药制药企业和监管机构就QbD在中药生产工艺、中药质量标准制定和质量控制、以及中药二次开发中的应用进行了若干前瞻性思考[711],但尚未形成一致的认识和模式。本文尝试在分析QbD核心思想的基础上,提出符合中医药自身规律和特点的中药QbD模式,为QbD在中药研究中的应用提供参考。
1QbD概述
美国食品药品监督管理局(FDA)颁布的21世纪制药cGMP(2002年)和过程分析技术(PAT)工业指南(2004年)促成了以技术为依据的法规环境[1213],鼓励药企采用科学方法和工程原理来理解制药过程,为质量标准的建立提供科学依据。随后,ICH出台Q系列指南文件,用于指导药物开发和生产过程的质量管理,其中Q8(2005年)[6]、Q9(2005年)[14]、Q10(2008年)[15]和Q12(2014年)[16]分别对应药物研发、质量风险管理、制药质量体系和生命周期管理。2015年,FDA推出新兴技术工业指南[17],继续鼓励制药业采用连续制造和3D打印等多学科交叉成果进行技术和产品创新[1819]。
ICH Q8引入QbD原则,并提供一套术语,如目标产品质量概况(quality target product profile,QTPP),关键质量属性(critical quality attribute,CQA)、关键物料属性(critical material attribute,CMA)、关键工艺参数(critical process parameters,CPP)、设计空间(design space,DSp)和控制策略等,用于规范药物开发与监管[20]。为促进上述概念的理解和QbD应用,美国FDA于2005年和2008年分别启动了小分子药物和生物技术产品QbD试点[21],欧洲药品管理局(EMA)和美国FDA于2011—2014年联合开展了小分子药物QbD应用评估试点[22]。欧洲制药工业协会联合会(EFPIA)、美国FDA和日本国家健康科学研究所(NIHS)等相继发布了基于QbD进行新药或仿制药开发的示例,供工业界讨论和参考,研究对象涉及速释片剂(Examplain,ACE,Sakura,Acetriptan)、缓释片剂(Z)、以及单克隆抗体(AMab)和疫苗(AVax)等生物制品[2329]。
QbD鼓励采用实验设计(DOE)、过程分析技术、多变量分析(MVA)和风险评估等工具获取药物处方、生产工艺和工艺控制知识[30],鼓励在生命周期中采用创新方法来提高工艺稳健性和产品质量一致性,制药工艺和监管政策的灵活性取决于提供的相关科学知识的水平。据统计,日本在2008—2014年,有33个化学药物和生物制品采用QbD方法开发并获得药品与医疗器械管理局(PMDA)批准,其中9个产品建立了生产工艺设计空间[31]。2013年,美国FDA批准了首个的基于QbD原则开发的生物技术产品Gazyva,表明设计空间可用于复杂生产工艺[32]。与常规经验式药物开发模式相比,QbD可缩短开发时间、提高开发一次成功率(right first time,RFT),在引进和使用新的工艺分析和控制技术方面具有较高灵活性,在生产运行中可降低OOS事件发生频率和产品缺陷率,设计空间的建立可避免工艺批准后变更、方便持续质量改进等[3334]。
此外,QbD适用于药物分析方法开发和验证[3536]。2015年,FDA颁布药品和生物制品分析规程和方法验证指南[37],鼓励在分析方法开发阶段系统运用风险评估和DOE等手段,充分理解方法参数对分析性能的影响,确保分析方法耐用性。目前,QbD已应用于高效液相色谱法(HPLC)、毛细管电泳法(CE)、近红外光谱法(NIRS)、以及LCMS、GCMS等分析联用技术[3841]。
2QbD实施方略
ICH Q8(R2)将制药QbD定义为:一种用于药品开發和生产的系统方法,该方法以预先定义的目标为起始,采用科学原则和质量风险管理,强调对生产过程的理解。在QbD框架下,药品质量不仅是检验出来的,也是设计、生产和管理出来的。QbD可应用于不同类型的药物开发和生产,证明其核心方法是普遍适用的。
徐冰等:论中药质量源于设计21质量设计
211设计思维在药品研发和生产中应用QbD,首先应树立设计思维。“设”即假设与想象,“计”即计划、策略与方法,设计就是通过计划、策略和方法将设想在现实中实现的过程。在产品开发中,设计的核心是推理的过程,即从产品的价值出发,对需求、功能和属性,直至产品的最终形态和使用条件进行反绎推理的过程。设计从观念、思维方法、知识和评价体系等各方面来整合科学,弄清事物的本质,因此设计对产品质量起着决定性作用。
QbD强调“以终为始(begin with the end)”[42],是对设计思维的贯彻。以终为始即以临床患者为目的、为根本,先分析理解患者的需求,再把问题分解为对药品的功能要求(即QTPP),将药品治疗功能赋予恰当的理化、生物学特征,再找到合理的药物开发和制造方案,最后组合各级控制策略形成全局的解决方案,实现特定的药品功能并满足预期的需求。QbD遵循一个通用的、系统的设计步骤和药品开发路线图(图1),但系统化设计并不是束缚创新性,而是让设计决策更加优化,药品质量更加优良。
徐冰等:论中药质量源于设计
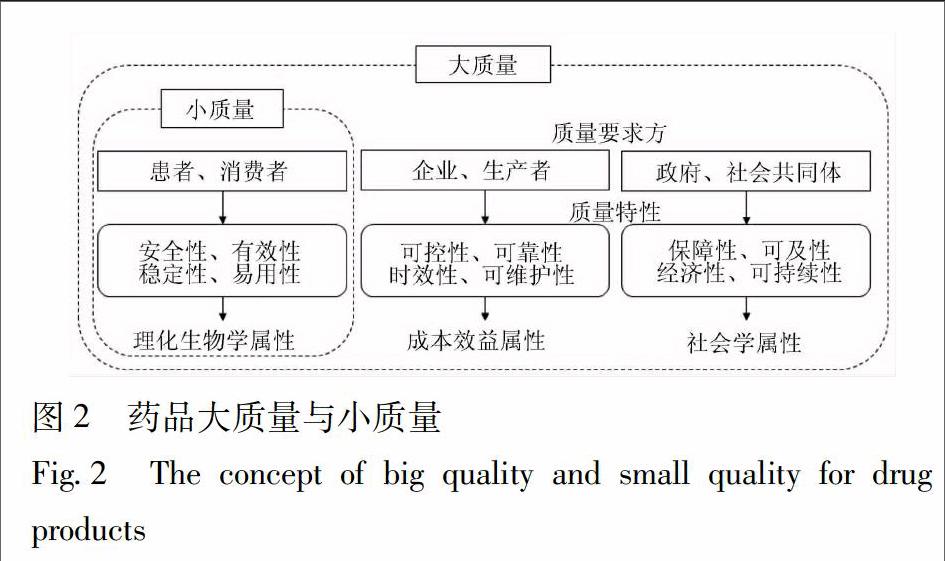
212质量范畴在《ISO 9000:2015质量管理体系——基础和术语》指出“产品和服务质量取决于满足顾客的能力以及对有关的相关方预期或非预期的影响。产品和服务的质量不仅包括其预期的功能和性能,而且还涉及顾客对其价值和利益的感知”。在ICH Q10中,质量指产品、体系和流程的一系列内在特性符合要求的程度。上述定义中,“要求”指产品应满足明示或隐含的需求或期望,隐含的要求通常指质量相关方的惯例。药品质量“要求”可由不同的利益相关方提出,如患者、生产企业、药品监管机构和行业协会,他们分别代表广义上的消费者、生产者、政府和社会组织,并由此形成了药品的大质量和小质量(图2)。其中小质量以满足患者需求为本,药品“安全有效、稳定可控”是所有利益相关方必须遵循的首要原则。在大质量框架下,不同质量特性之间是有矛盾的,但整体上遵循平衡协调的规律。随着社会的进步,对药品的要求不仅是技术和功能上的,而且要求有利于人类的健康生存和可持续发展。
图2中质量特性是定性的,在实际应用中应转换为定量或半定量的质量指标,并结合质量风险管理的原则判断质量指标的关键性。影响药物安全、作用强度、鉴别、纯度的物理、化学、微生物方面的特性以CQA表示,如体现中药临床安全性和有效性的质量标志物(Qmarker)及其限度[43]。企业方关注的成本效益属性,在应用中以关键绩效指标(key performance indicator,KPI)表示,如产率、成品率、缺陷率、返工率、生产周期等[44]。美国FDA为判断制药企业质量体系的有效性和工艺控制能力而发布的质量度量(quality metrics,QM)指标,如批次合格率、质量投诉率、无效OOS率、质量文化等,则在更高层次上实现了质量透明化[45]。当质量指标在一定范围内获得最佳秩序,并以规范化的文件形式由公认机构批准,便形成质量标准。中药历来具备“简、便、效、廉”的特点,中医药理论有较好的群众接受度和基础,介于社会学和理化生物学之间的本草学属性,是中药质量的特色。提升并完善中药质量标准体系,应采用QbD理念,回归中医临床对中药品质的需求,继承并革新中药制备工艺,充分保证中药质量。
22质量控制
221工艺理解QbD鼓励采用科学的方法和风险管理的原则增强对制药过程的理解。药品研究和开发的目的在于设计具有质量要求的产品及持续生产出符合预期性能的制药工艺。在实验室规模开发工艺时,对于关键工艺单元或工序,应深入理解关键原料属性、关键工艺参数和关键质量属性的之间的关系,建立如下式所示的过程模型。
Y=f(Z,X)(1)
其中,Y为工艺输出,即产品CQAs;Z为CMAs;X为工艺输入,即CPPs;f为反映Z,X和Y之间函数关系的模型,该模型可以是统计的或数据驱动型的,如基于最小二乘法(LS)的回归模型、偏最小二乘(PLS)回归模型等[4647];可以是基于第一性原则(first principle)建立的过程机制模型或半统计半机制模型,如湿法制粒过程regime map[48]。美国Merck研究室调查显示[49],约1/3的制药企业80%~100%的过程单元使用数据驱动型建模方法,另有1/3的企业40%~60%的过程采用数据驱动型建模,半数企业56%的过程单元采用基于PLS或PCA等潜变量模型的质量控制和优化方法。基于过程模型明确原辅料性质、工艺参数、环境因素的变动范围,构建工艺设计空间,提高工艺稳健性和产品质量可控性。
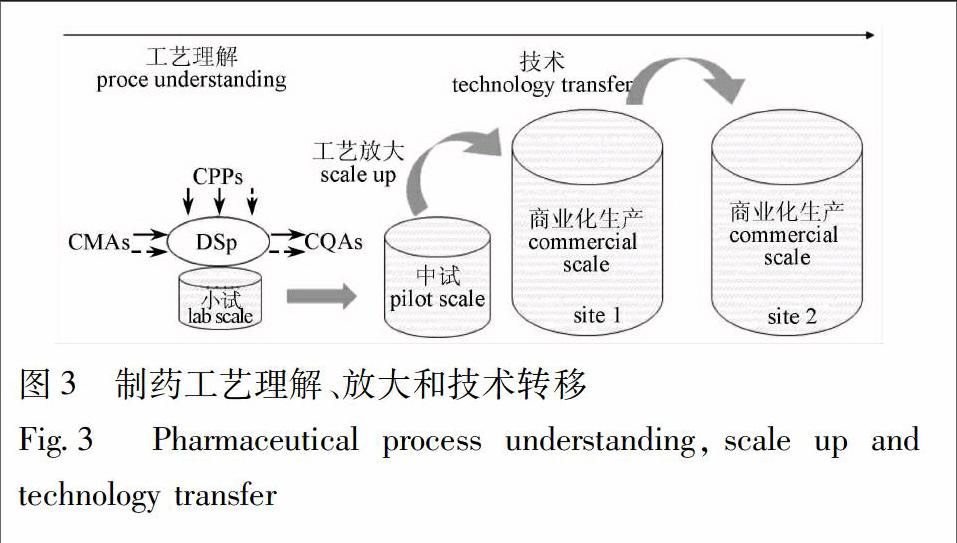
在从实验室规模向中试或生产规模的放大过程中,基于过程相似性原理,采用量纲分析和基于模型的中试放大技术,实现工艺技术和设计空间转移,降低中药产业化实施的风险[48]。至商业化生产阶段,研发和放大阶段获得的知识和理解分解转化到生产工艺和过程控制中,同时结合各种工作流程的管理,保证产品质量可控(图3)。工艺设计空间的有效性只有在生产规模条件下得到确认,才能用于生产质量控制策略。若研发阶段工艺理解不充分或技术转移不完全,生产过程中出现质量变异和偏差时,则很难调查原因或制定有效的纠正和预防措施(CAPA)。此外,在生产条件下,随着规模的增大和生产批量增加,可遇到实验室和中试规模未发现的工艺问题,可在先验知识的基础上,借助历史批记录、工艺验证数据等工艺信息加深对生产规模工艺的理解[5051]。
中药制剂产品与化学药品最根本的区别是原料,在从原料到产品的过程中,呈现“多输入多输出(MIMO)”特征,过程质量传递中应保持中药或方剂原有的功能。在中药种植、采收、加工和炮制等前处理工艺中,隐性知识的大量使用在中药品质保证中起到重要作用,同时增加了过程理解的难度和复杂性。现代化的中药制药工厂通过传感器、控制器和计算机一体化,把智能机器与中药传统工艺技术知识和谐的结合在一起,具备产出品质更高的工艺与产品的能力[5254]。智能地利用数字化整合的增值,理解中药质量传递规律,积极主动对潜在的质量问题进行识别和控制,有望使中药复杂性从问题变成竞争优势。
222变异控制质量变异(波动)指预期或目標质量与实际质量之间的差异。质量管理学家Deming曾指出,如果不了解质量变异,则95%的质量管理活动是无效的[55]。美国贝尔电话实验室Shewhart将产品质量变异分为偶然变异和异常变异2类。偶然变异是由偶然因素引起的,是生产过程固有的,不可避免,对产品质量影响微小;而异常变异由异常因素引起,对产品质量影响较大,但可避免或消除。当过程仅包含偶然变异时,过程输出的质量特性服从正态分布N(μ,σ2),Shewhart推荐使用μ± 3σ界限来管控过程,并由此奠定统计质量控制(statistical quality control,SQC)的基础[5657]。
药品质量变异取决于药品的生产、检验、储存使用的整个过程中产生的、积累的总误差。当对药品生产工艺不了解,无法建立如公式(1)所示的CMAs,CPPs,CQAs之间的关系时,为减少产品CQAs的变异,只能将原料和工艺参数限定在一个较窄的范围,即固定工艺参数的生产模式。如果充分理解了原料、制药工艺和产品之间的关系,理解原料变异和工艺条件的改变对产品质量的影响,并建立了工艺设计空间,则当原料质量发生变化时,为保证产出符合预定质量目标的产品,可根据设计空间调节工艺参数,即基于QbD设计空间的生产模式。美国FDA的Yu等[58]将上述2种生产模式对应的工艺控制策略定义为级别3(level 3)和级别2(level 2),并认为更高级别的控制策略(level 1)可通过CMAs和CQAs的在线实时监测,以及CPPs的闭环实时调控,实现药品质量的实时放行(real time release,RTR)。
Blackburn研究表明[59],在传统的以质量源于检验(quality by testing,QbT)原则为核心的药品研发和制造模式下,药品生产系统处于25~35 sigma水平,表明其一次成功率较低(%RFT,约84%~98%)且制造成本较高,PAT等先进工艺控制技术在化解工艺系统矛盾的方面的作用有限;而QbD可有效应对QbT的不足,提高药品生产系统的sigma水平。在实际应用中,sigma水平、不良率和过程能力指数之间存在定量转换关系,因此Yu等建议采用过程能力指数(Cpk)或过程性能指数(Ppk)来衡量工艺可靠性,评价质量改进效果,并指导药品研发设计、放大生产和批准后的持续改进与变更管理[60]。
中药原料批次间的均匀性、生产过程关键工艺指标的稳定性及设备参数的可靠性是决定产品批内、批间质量一致性的关键因素。而且中药原料成分复杂、均一性差、受控难度大,是造成产品理化指标和质量波动的主要变异源。目前,通过中药原料混批调配提高工艺输入的稳定性,采用自动化、智能化设备将工艺参数控制在固定点,是中药制造过程保证产品质量一致性的主要手段,属于Yu等定义的较低级别的控制策略。笔者曾根据某制药企业一定时期内清开灵注射液产品质量内控数据,以黄芩苷、胆酸、栀子苷和总氮浓度为指标计算其Ppk分别为11,20,16,09,其中Ppk<133的质量指标相关的工序的控制能力有待加强[61]。
23质量改进
在药物开发、技术转移、商业生产、直至产品终止的整个生命周期中,应采用知识管理和风险管理的方法促进产品质量的持续理解和改进。在药物开发过程中应用QbD的方法,可获取增强的工艺和产品知识,用于支撑工艺放大、技术转移和生产控制策略制订。企业实施制药质量体系(PQS)有利于产品质量改进、工艺改进、减少质量变异,为持续的工艺适用性和过程能力提供保证。制药质量体系包括:工艺性能和产品质量监测系统、纠正和预防措施系统、变更管理系统和管理评审系统。
在药品生产过程中,由于未知变异的存在,需借助有效的工艺性能和产品质量的监测系统,实现原料、中间体、产品、设施设备运行条件和过程能力的持续监控。在风险评估的基础上,借助统计质量控制方法,建立CQAs的趋势分析方法。在临床试验数据和注册批次数据的基础上,可预先建立相应CQAs的监控限或警戒限,并随着生产批次的增加,逐步修正完善限度。与质量标准相比,CQAs的趋势监控限应更为严格。除产品CQAs外,应关注中间控制(in process control,IPC)和非关键质量属性(nonCQAs)的持续监测。在回顾性分析的基础上,可结合风险管理调整并修订CQAs、nonCQAs和IPCs的监测方法和频率,改进工艺控制策略,确保性能处于受控状态。
依据风险分析的结果,工艺参数分为CPPs和非关键工艺参数(nonCPP)。其中nonCPPs又可分为重要工艺参数(key process parameter,KPP)和一般工艺参数(general process parameter,GPP)。借助历史批记录,可实现CPPs,KPPs,GPPs的趋势监控。若CPPs发生变化,则需采用风险管理方法评估变化的级别,并判断变化是否发生在设计空间之内。设计空间内的CPPs改变应纳入企业变更管理系统,设计空间外的CPPs改变需报监管部门批准[62]。制药生产规模下,难以实现覆盖设计空间的批次变化,因此并不需要对整个设计空间的进行有效性确认;在产品生命周期中,可选择性的对设计空间的不同区域进行确认[63]。KPPs的改变对CQAs的影响较小,主要评估其对KPI的影响。随着对工艺和产品质量理解的加深,应注意CQAs和nonCQAs,CPPs和nonCPPs的相互转化,以及设计空间的丰富和完善。
知识是生产工艺、控制策略和产品质量持续改进的基础,在药品生命周期过程中,应建立知识管理方法和系统。工艺和产品知识不仅来源于先验经验和药物开发研究,也来源于技术转移活动、工艺验证、生产经验和历史、偏差调查结果、CAPA报告、技术创新、变更管理、年度产品质量回顾(APR)、投诉和不良反应报告、其他同类或相关产品开发活动等。今井正明认为改善催生过程导向的思维方式,可缩小目标和措施之间的差距,有助于看清全局愿景;持续的改善将产生累加效应,实现质量和标准的升级[3]。
3中药QbD模式
采用QbD的原则和方法提升中药生产质量控制水平,是中药制造业深化工艺理解、提高产品质量、优化成本效益的迫切需求。在中药研究、开发和生产中应用QbD,应结合系统科学的方法,认识中药质量的形成和传递规律,并在此基础上对设计质量、制造質量、检验质量和使用质量进行全面控制和优化。在方法学层面,本文提出基于系统观和整体观的中药QbD“四全”模式,即全局设计、全息分析、全面控制和全程优化(图4)。
31全局设计
中药质量设计要综合考虑有用性、可用性、必要性、适当性和平衡性,要包括各种系统,以利于创建更优的解决方案。中药质量设计过程是启发式的,当质量目标确定时,在既往的经验、通用的标准以及经验法则的基础上,选择、组织、整合各种可能的理解、方法、手段和框架,形成完整的贯穿中药产品生命周期的全局解决方案,并对中药开发和生产过程进行有效管理,指引设计过程进入期望的方向。
在中药研发和生产中实施QbD,设计成功的关键在于能否同时开发设计问题空间和解决方案空间(图5)。在问题空间中,设计者应明晰中药产品的临床需求和定位,从整体上认识中药质量的复杂性。中医临床强调辨证论治、以证为纲,其药效评价也应该建立在中医证候分类的基础上[6465]。中药药性理论是对中药性质与功能的高度概括,应进一步发掘传统知识,研究中药药性与功效之间的关系规律[6669]。中药质量问题的解决方案空间由彼此重叠的知识空间构成,而不是一连串的步骤。图5为笔者试图从已知信息中提取一种广泛的模式,该模式无法涵盖所有情况,其中不同框架体系是相互兼容的,并可不断完善,支持多样性理解和创造性解决问题的方式。
中药质量设计是一项复杂的活动,其趋势是关注整个系统,其形式不一而足。设计方法和路径的选择取决于具体项目的任务、目标、环境、以及设计团队的知识背景和经验。只
有将设计方法与实际情况相结合,灵活应变,在执行的过程中精简各种可能性,才能在人财物和时间等资源有限的条件下,以及满足合规性要求的前提下,尽可能找到最优解。
32全息分析
分析的目标是研究信息的产生、处理和评价,包括“分”和“析”两部分。“分”即把复杂的整体分解为简单的子系统或元素,分解得到的各部分信息之间是分离的、稳定的线性关系,难以获得对复杂体系和工艺系统的全面理解。“析”即综合过程,是利用各种隐性和显性知识来产生新的信息、知识和理解,辨别其中有意义的规律或进行复杂技术创新,其特点是结合、集成,以及各子系统或元素之间的持续变化作用。
在中药质量设计过程中,大量理化、生物学量测工具的使用,以及自动化、数字化制药设备的应用可积累汇聚大量的数据,全息分析代表了对这些物质和能量交换过程中产生的数据和信息的过滤和设计整合能力。其种与“析”相关的方法和技术,如潜变量空间投影等化学计量学方法,以及深度神经网络、支持向量机、决策树和模型融合等随统计学和计算机科学发展而形成的新型模式识别和机器学习方法[7076],可辅助判断数据的准确性和相关性,阐明产品中药复杂物质系统的功能单元、界限和相互作用模式,具备更高层次的整合的能力,在中药QbD中应予以重视。
33全面控制
中药质量形成过程的每一个环节都是相互影响、相互制约的,是一个有机体,对影响中药产品质量的各种因素应从宏观、微观、人员、设备、物料、方法和环境等方面进行全面控制,建立从药材源头到成品的质量控制体系。全面控制的结果是让设计质量持续保持与目标水平的一致,在中药生产过程中达到物质基础、中药药性和方剂配伍功效的稳定传递,维持中药产品质量的批间和批内一致性。从中药质量控制方法学角度,全面控制包括以下4个层次。
331检验质量控制采用各种离线(offline)或在线(online)分析方法,分析CMAs和CQAs,对原料、中间体和产品进行质量检验[7783];在不同的质量特性指标之间进行权衡,选择最优的质量体系,建立产品质量标准及限度,依据标准判断中药产品质量是否合格或进行质量等级的分类。该层次对应符合性质量控制或QbT质量控制模式。
332统计质量控制针对中药原料、制药过程和产品质量的多变量特点,在企业资源管理系统(ERP)、制造执行系统(MES)、分布式控制系统(DCS)、实验室信息系统(LIMS)、PAT系统、药品质量信息可追溯系统等数据源的基础上,综合运用单变量统计过程控制(SPC)、多变量统计过程控制(MSPC)和批次统计过程控制(batch statistical process control,BSPC)方法[8487],通过控制限和过程能力指数实时识别过程或产品是否受控,寻找造成不稳定的原因,提出解决方案。如本课题组采用SPC方法建立了清开灵注射液中间体(水解液总氮含量、板蓝根提取液总氮含量、六混液总氮含量、八混液pH、八混液黄芩苷含量)、工艺用水(纯化水电导率、纯化水TOC、注射用水电导率、注射用水TOC)和成品(pH、黄芩苷含量、胆酸含量、栀子苷含量、总氮含量)关键质量属性监控模型[85]。基于历史工艺参数,建立了清开灵注射液实际生产中栀子和金银花多工序前处理工艺的整体MSPC监控模型[8889]。
333预测质量控制其核心是建立对质量属性进行精确预测的模型。采用多块分析、网络分析等系统建模方法将各关键的过程步骤参数和原料数据组合起来,预测并判断最终产品的质量,从系统模型的因果关系中提取主要控制因素,对系统输出进行前饋或反馈干预,或对产品质量进行实时放行。如本课题组联合运用正交偏最小二乘(OPLS)和多模块偏最小二乘(MBPLS)等多种工艺建模方法,通过三七总皂苷(PNS)片混合、湿法制粒、干燥、总混和压片多工序工艺参数预测片剂抗拉强度和体外溶出度,在此基础上辨识PNS片工艺系统关键控制点,并建立了基于跨工序工艺数据的PNS片COAs的实时放行测试(RTRT)模型[90]。
334智能质量控制智能是应付新情况和新问题所需的能力,以及有效使用推理和推断力的能力。实现中药质量智能控制的过程是将数据转化为信息,将信息抽象化建模后转化为知识,然后利用知识去认识、解决和避免产品质量问题。如本课题组采用在线MEMS近红外传感器监控中药配方颗粒混合过程,创新建立了批内自适应建模算法,避免了固定校正模型的定期重新校准,有利于中药配方颗粒多种类、辅料配比变化的混合操作;在均匀度分析过程中,自动设置监控限,避免人为干预并提高混合终点判断的准确性[91]。
上述4个层次质量控制策略体现了中药质量控制由被动检验向主动预防、由经验控制向科学决策的转变。质量标准仍是判断中药产品质量的金标准,子系统和整个技术系统的性能标准须整合在一起,实现系统设计要求。检验质量控制以事后检验为主,存在漏检、误判等弊端,大批量生产条件下成本较高。统计质量控制可在制造过程中保证产品质量,有助于操作人员实施纠正措施和避免对终产品质量检验的依赖,但只关注生产阶段对产品质量的影响,忽略了产品质量形成过程的全局意识。中药生产工艺系统的复杂性使CMAs、CPPs和CQAs因果关系很难辨识或维持,是目前中药实施预测控制和智能控制等先进质量控制策略的难点所在。
34全程优化
中药生产线由若干工艺单元(或工序)组成,各单元按照既定的工艺路线组合连接,构成中药制药过程系统。过程质量从原料药材经由一系列单元操作逐步传递到最终产品。以单元为主的常规优化控制方法不考虑单元相互作用,无法达到全局最优。中药生产过程全程优化,是突破单元界限,建立中药制药过程质量传递模型,从整体角度表征中药制药过程系统的质量累积效应、时变效应和耦合效应,通过工艺参数的优化调节操作精准控制中药生产过程质量轨迹,保证中药生产过程朝着确定的方向发展,最终达到稳定并提高终产品质量的目的(图6)。
本课题组在国内率先提出中药制剂生产工艺全程优化的概念[92],在清开灵注射液多单元前处理工艺系统模型建立的基础上,首次将递进PLS建模策略和Bayes优化方法集成,建立了“目标导向全程优化策略(targetoriented overall process optimization,TOPO)”,并利用概率轨迹实现中药生产过程系统的逐步优化,发现全程优化可应对原料变异和过程扰动,从而提高中药产品(中间体)质量的一致性[9394]。在中药工艺系统中,因素之间的相互作用越来越显现出非线性特征,强调不断从正反馈和负反馈中学习,强调控制过程的适应,通过不断对变化的、多样的知识进行综合,可创造出前所未有的性能特点的产品和工艺。可靠性是生产系统的质量属性之一,用于描述过程能力在时间上的维持特性。全程优化将质量控制目标和系统可靠性提升到一个更高的维度并加以实现,将优化后的状态加以维持和控制,可确保产品质量持续改进。
4总结和展望
本文提出的中药QbD的“四全”模式,与ICH QbD理念一脉相乘,但更具中药特色。全局设计旨在系统整合多学科研究方法,深入认识人体生命复杂系统与中药复杂系统的交互作用,为中药设计和质量控制指明方向;全息分析是从多个维度提高对中药复杂体系不确定性的认识,在此基础上提出符合中药特点的产品和工艺质量评价模式;全面控制综合应用检验质量控制、统计质量控制、预测质量控制和智能质量控制方法,为中药产品质量一致性提供保障;全程优化将建模、控制和优化方法集成,将预测、反馈、前馈结合,基于数据和知识,致力于提高产品质量和工艺系统可靠性,以及生命周期内的质量改进。
在中药研发和生产的复杂生态系统内,任何单向技术的价值都依赖于是否存在可以与之连接或集成在一起的其他技术。系统的相互依赖型意味着一旦建立起技术与技术的相互联系,这种关联就成了转向新技术路径的障碍。QbD是为了应对系统兼容性的需要,在QbD框架内,设计的发展依靠新事物对已有模式进行补充,进而改变系统的功能和关系,它开启并界定了容纳未来新理论、新方法和新技术的路径。
[参考文献]
[1]Juran J M Juran on quality by design: the new steps for planning quality into goods and services[M] New York: Free Press, 1992
[2]Deming W E Out of the crisis[M] Cambridge:MIT Press, 2000
[3]Feigenbaum A V Total quality control[M] New York:McGrawHill,1961
[4]Imai M Kaizen: the key to Japan′s competitive success[M] New York:McGrawHill, 1986
[5]AAPS advances in the pharmaceutical sciences series Quality by design for biopharmaceutical drug product development[M] Berlin:Springer, 2015
[6]International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH). Pharmaceutical development. Q8[S]. 2005.
[7]徐冰, 史新元, 乔延江, 等 中药制剂生产工艺设计空间的建立[J] 中国中药杂志, 2013,38(6):924
[8]劉雳, 瞿海斌 在中药注射剂安全性再评价工作中践行“质量源于设计”的思考[J] 世界科学技术——中医药现代化,2013,15(6):1433
[9]周刚, 何燕萍 中药复方新药研发中质量标准研究需关注的问题[J] 中国中药杂志, 2014, 39(17):3389
[10]冯怡, 洪燕龙, 鲜洁晨, 等 基于QbD理念的中药新药成型工艺研发模式的探讨[J] 中国中药杂志, 2014,39(17):3404
[11]阳长明, 王建新 论中药复方制剂质量源于设计[J] 中国医药工业杂志,2016,47(9):1211
[12]FDA Pharmaceutical cGMPS for the 21st century[S] 2002
[13]FDA Guidance for industry: PAT—a framework for innovative pharmaceutical development, manufacturing, and quality assurance[S] 2004
[14]International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH) Quality risk management Q9 [EB/OL] [20161228] http://wwwichorg/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q9/Step4/Q9_Guidelinepdf
[15]International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH) Pharmaceutical quality system Q10 [EB/OL] [20161228] http://wwwichorg/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q10/Step4/Q10_Guidelinepdf
[16]International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH) Technical and regulatory considerations for pharmaceutical product lifecycle management Q12 [EB/OL] [20161228] http://wwwichorg/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q12/Q12_Final_Concept_Paper_July_2014pdf
[17]FDA Advancement of emerging technology applications to modernize the pharmaceutical manufacturing base: guidance for industry[S] 2015
[18]Allison G, Cain Y, Cooney C, et al Regulatory and quality considerations for continuous manufacturing May 2021, 2014 continuous manufacturing symposium[J] J Pharm Sci, 2015, 104(3): 803
[19]Jonathan G, Karim A 3D printing in pharmaceutics: a new tool for designing customized drug delivery systems[J] Int J Pharm,2016,499(1/2): 376
[20]Lionberger R, Lee S, Lee L, et al Quality by design: concepts for ANDAs[J] AAPS J, 2008,10(2):268
[21]FDA Submission of quality information for biotechnology products in the office of biotechnology products: notice of pilot program [J]Fed Regist, 2008, 73(128):37972
[22]European medicines agencyEMA website on Quality by Design[EB/OL] [20170108]http://wwwemaeuropaeu/ema/indexjsp?curl=pages/regulation/document_listing/document_listing_000162jsp&mid=WC0b01ac058076ed73
[23]EFPIA Topic Group Mock P2 for "Examplain" hydrochloride[EB/OL] [20161228] http://wwwgmpeyecokr/gmpguidesandguidelines/quality%20by%20design/MockP2discussionpaper200709 04002ENv1pdf.
[24]CMCIM Working Group Pharmaceutical development case study: “ACE tablets”[EB/OL] [20161228] http://wwwispeorg/pqli/casestudyacetabletspdf.
[25]CMC Biotech Working Group AMab: a case study in bioprocess development[EB/OL] [20161228] http://cymcdncom/sites/wwwcasssorg/resource/resmgr/imported/AMab_Case_Study_Version_21pdf
[26]FDA Quality by design for ANDAs: an example for modified release dosage forms[EB/OL] [20161228] https://www.pharmamedtechbi.com/~/media/Supporting%20Documents/The%20Gold%20Sheet/46/6/QbD%20MR%20Final_508%20Compliant_0pdf
[27]FDA Quality by design for ANDAs: an example for immediaterelease dosage forms[EB/OL] [20161228] http://wwwfdagov/downloads/Drugs/DevelopmentApprovalProcess/HowDrugsareDevelopedandApproved/ApprovalApplications/AbbreviatedNewDrugApplicationANDAGenerics/UCM304305pdf
[28]CMC Vaccines Working Group AVax applying quality by design to vaccines[EB/OL] [20161228] http://wwwispeorg/2013biotechconference/avaxapplyingqbdtovaccinespdf
[29]MHLW sponsored QbD Drug Product Study Group Sakura Bloom Tablets P2 Mock[EB/OL] [20161228] http://wwwnihsgojp/drug/section3/QbD_P2mock_SakuraBloom141114_E.pdf.
[30]Ferreira A, Tobyn M Multivariate analysis in the pharmaceutical industry: enabling process understanding and improvement in the PAT and QbD era [J] Pharm Dev Technol, 2015, 20(5): 513
[31]Kuno K, Toyoshima S Review experiences and regulatory challenges for pharmaceutical development in Japan using a qualitybydesign approach[J] Ther Innov Regul Sci, 2016,50(3):368
[32]FDA Approval letter for genentech BLA125486 obinutuzumab (Gazyva)[EB/OL] [20161228] http://www.accessdata.fda.gov/drugsatfda_docs/nda/2013/125486Orig1s000ChemR.pdf
[33]Kourti T, Davis B The business benefits of quality by design (QbD)[J] Pharm Eng, 2012, 32:1
[34]Alasandro M, Little T Process and method variability modeling to achieve QbD targets [J] AAPS Pharm Sci Tech, 2016,17(2):523
[35]Rozet E, Ziemons E, Marini R D, et al Quality by design compliant analytical method validation [J] Anal Chem,2012,84:106
[36]Rozet E, Lebrun P, Debrus B, et al Design spaces for analytical methods [J] Trac Trend Anal Chem, 2013, 42: 157
[37]FDA Analytical procedures and methods validation for drugs and biologics[S] 2015
[38]Li Y, Terfloth G, Kord A A systematic approach to RPHPLC method development in a pharmaceutical QbD environment [J] Am Pharmaceut Rev,2009,12:87
[39]戴胜云, 徐冰, 张毅, 等 质量源于设计(QbD)在药物分析方法开发中的应用研究进展[J] 药物分析杂志,2016,36(6):950
[40]Dai S, Xu B, Zhang Y,et al Robust design space development for HPLC analysis of five chemical components in Panax notoginseng saponins[J] J Liq Chromatogr Relat Technol, 2016,39(10):504
[41]Xue Z, Xu B, Shi X, et al Overall uncertainty measurement for near infrared analysis of cryptotanshinone in tanshinone extract [J] Spectrochim Acta A, 2017, 170: 39
[42]FDA Guidance for industry and review staff: target product profile—a strategic development process tool[S] 2007
[43]劉昌效, 陈士林, 肖小河, 等 中药质量标志物(QMarker):中药产品质量控制的新概念[J] 中草药,2016,47(9):1443
[44]Vega H, Rivera R Quality risk management for legacy products in CMOs[J] Pharm Eng, 2016,36(2):84
[45]FDA Draft guidance for industry: request for quality metrics[S]. 2015
[46]Dai S, Xu B, Zhang Y, et al Establishment and reliability evaluation of the design space for HPLC analysis of six alkaloids in Coptis chinensis (Huanglian) using Bayesian approach[J] Chin J Nat Med, 2016,14(9):697
[47]Sun F, Xu B, Zhang Y, et al Latent variable modeling to analyze the effects of process parameters on the dissolution of paracetamol tablet[J] Bioengineered,2017, 8(1): 61
[48]Luo G, Xu B, Zhang Y, et al Scaleup of a high shear wet granulation process using a nucleation regime map approach[J] Particuology,2016, doi: 101016/jpartic201604007
[49]Troup G, Georgakis C Process systems engineering tools in the pharmaceutical industry[J] Comput Chem Eng, 2013, 51:157
[50]Rathore A, Bansal A, Hans J Knowledge management and process monitoring of pharmaceutical processes in the quality by design paradigm [J] Adv Biochem Eng Biotechnol,2013, 132:217
[51]Meneghetti N, Facco P, Bezzo F, et al Knowledge management in secondary pharmaceutical manufacturing bymining of data historians—a proofofconcept study [J] Int J Pharm,2016,505(1):394
[52]吴志生, 徐冰, 王耘, 等 朝向过程系统工程的中药制药工业发展战略[J] 中华中医药杂志,2016,31(9):3417
[53]程翼宇, 瞿海斌, 张伯礼 中药工业40:从数字制药迈向智慧制药[J] 中国中药杂志,2016,41(1):1
[54]杨明, 伍振峰, 王芳, 等 中药制药实现绿色、智能制造的策略与建议[J] 中国医药工业杂志,2016,47(9):1205
[55]Deming W E The new economics: for industry, government, education [M] Cambridge: MIT Press, 1993
[56]Shewhart W A Economic control of quality of manufactured product [M] New York:ASQ Quality Press, 1931
[57]Western Electric Company Statistical quality control handbook[M] New York:AT&T Technologies, 1984
[58]Yu L, Amidon G, Khan M, et al Understanding pharmaceutical quality by design [J] AAPS J, 2014,16(4):771
[59]Blackburn T Quality by design (QbD) and production system fundamental sigma limits with a pharmaceutical industry example[D] Washington:The George Washington University, 2012
[60]Yu L, Peng D, Lionberger R, et al Using process capability to ensure pharmaceutical product quality[J] Pharm Eng, 2015, 35(2):35.
[61]徐冰, 周海燕, 史新元, 等 清开灵注射液生产过程性能指数研究[J] 中国中药杂志, 2015,40(10):1930
[62]ICH ICH harmonized tripartite guideline: Q11 development and manufacture of drug substances[S] 2012
[63]FDA/EMA Questions and answers on design space verification[EB/OL] [20161228] http://wwwemaeuropaeu/docs/en_GB/document_library/Other/2013/11/WC500153784pdf
[64]Lu A, Liu X, Ding X Methodology of pharmacodynamic evaluation on Chinese herbal medicine based on syndrome differentiation[J] Chin J Integr Med, 2009,7(6):501
[65]王耘, 史新元, 張燕玲, 等 系统生物学意义下的中药研发与药性理论[J] 世界科学技术——中医药现代,2006,8(1):39
[66]姚美村, 张燕玲, 袁月梅, 等 中药药性量化方法对补虚药功效归类预测的研究[J] 北京中医药大学学报,2004,27(4):7
[67]周密, 王耘, 乔延江 利用数据挖掘方法预测中药缺失药性的初步研究[J] 中国中医药信息杂志,2008,15(6):93
[68]Yan J, Wang Y, Luo S, et al TCM grammar systems: an approach to aid the interpretation of the molecular interactions in Chinese herbal medicine[J] J Ethnopharmacol, 2011,137(1):77
[69]袁斌, 张燕玲, 王耘, 等 基于自相似性原理的药性理论系统观[J] 中国中药杂志, 2014, 39(13):2371
[70]乔延江, 吴刚, 王玺, 等 中药蟾酥质量的人工神经网络化学模式识别研究[J] 分析化学,1995,23(6):630
[71]Lin Z, Xu B, Li Y, et al Application of orthogonal space regression to calibration transfer without standards [J] J Chemometr, 2013, 27(11):406
[72]Lin Z, Pan X, Xu B, et al Evaluating the reliability of spectral variables selected by subsampling methods[J] J Chemometr,2015,29(2):87
[73]徐冰, 王星, Dhaene T, 等 基于遺传算法的多目标最小二乘支持向量机在近红外多组分定量分析中的应用[J] 光谱学与光谱分析,2014,34(3):638
[74]Zhai C, Liu Q, Zhang Y, et al Identification of natural compound carnosol as a novel TRPA1 receptor agonist[J] Molecules, 2014, 19(11):1873
[75]Zhao N, Wu Z, Zhang Q, et al Optimization of parameter selection for partial least squares model development [J] Sci Rep,2015,5:11647
[76]He S, Li M, Ye X, et al Site of metabolism prediction for oxidation reactions mediated by oxidoreductases based on chemical bond [J] Bioinformatics, 2016, doi: 101093/bioinformatics/btw617
[77]史新元, 张燕玲, 王耘, 等 中药生产过程中质量控制的思考[J] 世界科学技术——中医药现代化,2008,10(5):121
[78]Xu B, Wu Z, Lin Z, et al NIR analysis for batch process of ethanol precipitation coupled with a new calibration model updating strategy [J] Anal Chim Acta, 2012, 720: 22
[79]Wu Z, Xu B, Du M, et al Validation of a NIR quantification method for the determination of chlorogenic acid in Lonicera japonica solution in ethanol precipitation process[J] J Pharmaceut Biomed,2012,62:1
[80]Wu Z, Sui C, Xu B, et al Multivariate detection limits of online NIR model for extraction process of chlorogenic acid from Lonicera japonica[J] J Pharmaceut Biomed,2013,77:16
[81]Xue Z, Xu B, Yang C, et al Method validation for the analysis of licorice acid in the blending process by near infrared diffuse reflectance spectroscopy[J] Anal Method, 2015,7:5830
[82]Luo G, Xu B, Shi X, et al Rapid characterization of tanshinone extract powder by near infrared spectroscopy[J] Int J Anal Chem, 2015, doi: 101155/2015/704940
[83]张毅, 徐冰, 孙飞, 等 中药提取物粉末物理指纹谱研究及应用[J] 中国中药杂志,2016,41(12):2221
[84]徐冰, 史新元, 乔延江, 等 金银花醇沉多阶段多变量统计过程控制研究[J] 中华中医药杂志,2012,27(4):784
[85]周海燕 清开灵注射液生产的统计过程控制技术研究[D] 北京:北京中医药大学, 2012
[86]Xu B, Luo G, Lin Z, et al Endpoint detection of the alcohol adding process in alcohol precipitation of Lonicerae Japonicae based on design space and process analytical technology[J] Chem J Chin Univ, 2013,34(10):2284
[87]Li J, Xu B, Zhang Y, et al Determination of geniposide in Gardenia jasminoides Ellis fruit by near infrared spectroscopy and chemometrics[J] Anal Lett, 2016,49(13): 2063
[88]周海燕, 徐冰, 史新元, 等 清开灵注射液中金银花液生产工艺多元统计过程监控研究[J] 世界科学技术——中医药现代化,2012,14(4):1877
[89]周海燕, 徐冰, 史新元, 等 统计过程控制在栀子前处理生产工艺中的应用[J] 中国实验方剂学杂志,2012,18(11):16
[90]Sun F, Xu B, Zhang Y, et al Statistical modeling methods to analyze the impacts of multiunit process variability on critical quality attributes of Chinese herbal medicine tablets [J] Drug Des Dev Ther, 2016,10: 1177
[91]徐冰, 史新元, 乔延江, 等 中药配方颗粒混合过程终点在线监控方法:中国,201610836387 [P]. 20160921.
[92]徐冰 中药制剂生产过程全程优化方法学研究[D] 北京:北京中医药大学,2013
[93]Xu B, Lin Z, Wu Z, et al Targetoriented overall process optimization (TOPO) for reducing variability in the quality of herbal medicine products [J] Chemometr Intell Lab, 2013,128:144
[94]Xu B, Sun F, Li J, et al Application of TOPO to the multistage batch process optimization of gardenia extracts[J] Lect Notes Comput Sci, 2015,9243:267[责任编辑孔晶晶]

