中药制剂生产过程中的质量风险分析与对策
杨明+杨园珍+王雅琪+伍振锋+王学成+罗晶
[摘要]产品质量的优劣不仅依靠检验方法,更依靠设计开发、生产控制及物流管理等产品制造的所有环节,质量源于过程控制水平。因此,准确识别药品生产过程可能诱发质量风险的因素,及其合理的质量控制措施非常重要。该文系统分析中药制剂生产过程各环节质量风险来源,探讨中药制剂质量风险识别的途径和方法,并对如何控制中药制剂过程中的质量风险的产生提出相应的措施和建议,为完善中药制剂全过程质量管理提供参考。
[关键词]GMP; 中药制剂; 质量风险; 生产过程
[Abstract]Product quality relies on not only testing methods,but also the design and development, production control and product manufacturing all aspects of logistics management Quality comes from the process control levelTherefore, it is very important to accurately identify the factors that may induce quality risk in the production process and quality control measures correspondinglyThis article systematically analyzes the source of the quality risk of all aspects of the production process in traditional Chinese medicine preparation Discussing ways and methods of quality risk identification of traditional Chinese medicine preparation and providing references for perfecting the whole process quality management of traditional Chinese medicine preparation
[Key words]GMP; traditional Chinese medicine preparations; quality risk; manufacture process
2015年,我國中药类产品的进出口额达4795亿美元,出口额3770亿美元,其中,以中草药原料为主要形式的中药材及饮片和提取物分别达到1058亿,2163亿美元,占中药类产品出口总额的854%;而附加价值相对较高的中成药和保健品分别只有262亿,287亿美元,占比只有146%。中成药作为中药类产品最重要的表现形式在国际市场的附加价值仍未得到有效体现。为此,国家为加快中药工业转型升级给予了极大的支持,对中药产业技术升级、质量标准提升提出了更高的要求。2010年国家工信部、卫生部、国家食品药品监督管理局联合印发的《关于加快医药行业结构调整的指导意见》中,明确提出“加快现代技术在中药生产中的应用,推广先进提取、分离、纯化、浓缩、干燥、制剂、过程质量控制技术”。2016年2月,国务院发布了“中医药发展战略规划纲要(2016—2030年)”,将提升中药产业的发展水平列为重点任务;加速中药生产工艺、流程标准化、现代化,构建中药材生产流通全过程质量管理和质量追溯体系,完善标准体系,加强中药质量管理。
一系列国家政策的提出,对中药产业全过程质量管理体系的建立提出了更高的要求。药品生产质量管理规范(GMP)认为,产品质量的优劣不仅依靠检验方法,更依靠设计开发、生产控制及物流管理等产品制造的所有环节,质量源于过程控制水平[1]。因此,准确识别药品生产过程可能诱发质量风险的因素,及其合理的质量控制措施显得尤为重要。目前,质量风险理念主要集中在管理、法规等方面。尚无针对中药制剂质量过程中各环节可能出现风险的综合分析及其切实的质量控制方案的分析总结。因此,本文对中药制剂生产过程中可变因素的来源进行系统分析,并对如何控制中药制剂过程中的质量风险的产生提出相应措施和建议,为完善中药制剂全过程质量管理提供参考。
1质量风险的定义及发展历程
11质量及风险的基本定义
人用药品注册技术要求国际协调会(ICH)Q6A中将质量定义为:“对于一个产品,系统或过程实现需求的内在性质程度”。2005年国际质量管理标准将其定义为:“一组固有特性满足要求的程度”。风险通常被理解为危害出现的可能性和危害严重性的结合。药品的生产制备过程不可避免地会承担一定程度的风险,准确分析产品在整个产品生命周期内质量风险来源有助于完善质量标准体系,提高制剂质量控制水平。质量风险管理理念可以运用于从原料药到制剂成品整个生命周期内的评估、控制、沟通、审核的系统过程[2]。
12药品质量风险管理发展历程
风险管理是研究风险发生规律以及风险控制技术的新兴学科,其理念被有效运用于降低风险事故造成的损失,在各领域发挥极大作用。20世纪90年代,美国食品药品监督管理局(FDA)出台了药品风险管理框架,首次在药品领域中引入风险管理思想[3]。2005年,ICH发布了Q9(质量风险管理),对药品生命周期内风险管理提出系统规定和控制思路,确定了风险管理的基本概念,对风险管理的基本程序和依据进行了基本原则性的规范。2006年,美国FDA发布了ICH Q9的工业指南。其后,2008年欧盟出台了相关质量风险管理的指南性文件,正式将ICH Q9纳入GMP认证体系。2008年7月,我国SFDA药品评价中心暨药品不良反应监测中心发布“高风险品种风险管理计划推进行动”。2011年3月,SFDA发布新版GMP中,国内首次引入风险管理思想,提出了质量风险管理的基本原则和要求。综上可见,对药品质量实施风险管理,不仅适应国际形势的日新月异的发展需求,也是对药品安全、稳定、可控的基本属性提出更全面的控制方案。
2中药制剂生产过程中的质量风险来源
中药制剂生产过程是从原料药到成品的加工制造环节,中药制剂(冲剂、片剂、丸剂、口服液等)的生产都需要经过一系列操作单元,如前处理(提取、浓缩、干燥)、制剂成型、包装贮藏等组成,不同阶段产品,经一次或多次物理、化学和生物学信息传递或整合后,构成产品的质量内涵,并最终影响产品效能的发挥。受制于中药制剂原料的不确定性,工艺操作环节复杂性,中药制剂的生产过程存在不同层次质量风险来源,根据风险类型可以归纳为4个主要方面:原料、工艺、设施、管理风险等。
21原料来源及辅料选择的风险
我国有丰富的中药材资源,可作药用的植物种数有11 020种[4]。种类繁多的药用品种导致同名异物、同物异名现象普遍,影响制剂原料的来源稳定。我国幅员辽阔,中药材分布地域广阔,同一药用植物产地多样,加之多地气候、土壤、采收期不固定性,导致制剂原料质量差异较大。常规的中药药材鉴定包括:中药的真实性鉴定、安全性检查及质量优劣鉴定,经典的鉴定方法有来源鉴定、性状鉴定、显微鉴定、理化鉴定。然而物种本身进化变异往往是渐变和连续的,药材市场始终处于动态变化中,基原变化和不同的药材类型(自然选择、人工培育等)不断出现,传统中药鉴定大多停留于定性描述和经验判断,其结论也具有一定的模糊性和较强的主观性,导致原料差异成为中药制剂质量波动最为重要的因素之一。
现行版《中国药典》采用单味药材分类,性状结合指标性成分的方法判断药材是否合格,对不同处方、不同功效类型未进行明确划分,导致指标性成分往往是药材中的大类成分,而此一刀切的指标性成分(大类成分)是否与最终用药需求相关存在不确定性。个性化和标准化是建立原料质量控制方案的指南,企业根据自身产品特点,标准化地建立符合自身产品特点的中药原料内控质量标准,有效降低原料质量风险。
中药制剂辅料是中药制剂生产环节中使用的附加物料,包括炮制辅料和制剂辅料。中药炮制辅料,指对中药饮片具有辅助作用的附加物,会对主药产生影响[5]。中药制剂辅料包括中药制剂过程辅料和中成药辅料。中药制剂过程辅料是在中药制备过程中,帮助有效成分提出与富集,最后又被移除的物料,不存在于最终产品之中。中成药辅料是存在于最终产品,除主药以外一切附加物料的总称,不与主药反应,不影响主药的释放吸收和含量的测定。由于辅料品种不同、性能不同,在制剂中所起的作用也不同,辅料选择不当会影响其质量。
22工艺风险
221中药饮片产地加工与炮制的影响
中藥材原料采收后需经过一系列的净选、切制、干燥、炮制等饮片加工过程,发生细胞缩水、破裂、变型、酶解、干燥等变化,通过产地加工与炮制不但可以去除杂质和非药用部位,还可以杀菌灭活、减毒、干燥,提高药材质量,利于包装、运输、储存等[6]。在我国常用中药材中,需进行初加工者约占70%,加工炮制的程度和方法在很大程度上影响后续制剂的质量和疗效。
净制是中药材净选加工以达到净度要求的药材前处理的一种方式,包括筛选、风选、水选、剪、切、刮、削、剔除、酶法、剥落、挤压、燀、刷、擦、火燎、烫、撞、碾串等方法。主要目的是为了除去非药用部位及分离药用部位,以减少杂质的干扰。清除非药用部位,需根据具体的临床疗效来选择。何首乌用其根,生用发挥其截疟解毒的功效,熟用则发挥其补益精血的功效;而用其藤,则称为夜交藤,具有养心安神的功效。麻黄根能收敛止汗,而麻黄茎则发汗解表,功效完全相反。藕节(茎节)止血散瘀,而藕(地下根茎)清热凉血。虽然都为同一中药,却因为药用部位不同,有不同的疗效。
杨明等:中药制剂生产过程中的质量风险分析与对策切制是把软化后的中药材按照一定的规格,切成片、丝、块、段等,可供中医临床调配处方或中成药生产用。钟燕珠认为目前部分饮片切制粗大,难以煎透,是影响中药汤剂质量的最大因素[7]。王艳萍认为切制规格会对煎煮效果有影响,而且部分中药符合药典切制要求,但是仍然难以煎透[8]。徐智毅发现不同切制方法确实会对天麻质量产生影响[9]。中药切制前,均需进行软化处理。滕菲等按洗润法、淋润法、泡润法3种方法对当归进行软化,洗润法最佳[10]。李凯等用不同的软化方法处理白芍,浸出物和有效成分溶出量与所用的软化方法不一致[11]。而在生产过程中,对中药软化程度的判别主要依据老药工“看水性”来判断,常用弯曲法,指掐法,穿刺法,手捏法等进行检查。以人的感官为评判依据,没有确定的标准依据。软化不当,可能会形成连刀片、油片、掉边、炸心、药材伤水、翘片等现象,应根据各种药材的不同性质和气候的变化,以及地区差异,采取不同的处理方法和处理程度[12]。合理的切制方式,有利于有效成分溶出,受热均匀,利于调配与制剂。切制后,需及时干燥,干燥不及时或干燥方法不当,会导致饮片变色或走味;干燥不透、未放凉或存储在潮湿环境中,药材易发霉。
中药炮制是保证饮片质量的关键,常用炮制方法包括炒、炙、制炭、煅、蒸、煮、炖、煨等。炮制得当,则能降低或消除毒副作用,增强药物疗效,保证其用药安全。乌头虽为毒性药物,但经过炮制加工处理后,双酯性生物碱被水解为单酯性生物碱,降低了对心、肝、肾脏损伤的毒副作用,保留药效活性[13]。曾宝在巴豆制霜后,以巴豆中的有效成分巴豆苷和有毒成分巴豆毒蛋白含量作为监控指标,将炮制品与生巴豆作急性毒性试验与胃肠推进试验对比,表明炮制后有毒成分巴豆毒蛋白含量降低,缓和其峻泻作用[14]。陈嘉谟在《本草蒙荃》一书中表明“凡药制造,贵在适中,不及则功效难求,太过则气味反失”,可见,根据处方的功能主治,合理的掌握炮制工艺,是控制制剂质量的关键。
222中药制剂生产工艺的影响
2221提取工艺现代中药制剂,大多需经过提取过程,以期最大限度提取有效成分,提高制剂内在质量和临床疗效。常见中药提取方法包括:煎煮法、浸渍法、渗漉法、超声波提取法等。不同的提取方法对中药制剂质量影响不一,应根据处方、溶液性质、剂型要求和实际生产等因素选择合适的提取方法。提取工艺中的设备设施、中药的性质(药材粉碎度、表面状态)、工艺参数(溶媒种类、用量、浓度、浸泡时间、提取时间、提取温度、次数、提取压力、pH)等都会影响提取效率[15]。现代中药提取工业生产中,煎煮法具有经济、简单、易行、符合中医传统用药习惯,是应用最广的一种方法,常用的设备是多能提取罐[16]。多能提取罐是目前中药生产过程中应用最广的可调节压力、温度且具备提取或蒸馏等多功能的密闭间歇式提取设备。但也存在溶媒消耗量大、提取浓缩不能同时进行、提取液量大、浓缩时能源消耗大等缺点。多能提取罐在中药制剂实际生产中常可能出现加药太满,煎煮时堵塞了压力表,使压力表失去作用;排气口不通畅和煎煮后忘记关蒸汽等失误。在使用多能提取罐时,应尽量减少人为因素的影响。
2222纯化工艺为了改变传统制剂“黑、大、粗”现状,现代制剂往往使用大孔树脂、水提醇沉等纯化方法,最大限度保留有效成分,降低浸膏得率,减少服药剂量。制剂过程中,方法的选择、参数的设定和操作均会对制剂质量产生影响。根据中药的理化性质,选择合适的方法尤其重要。如水提醇沉,不同浓度的乙醇,可以除去不同类型的杂质,并且加醇的方式对制剂质量同样重要。慢加快搅可以防止局部浓度过高,迅速产生大量沉淀而吸附有效成分造成损失。
2223浓缩干燥工艺现行中药制剂产业化生产过程,大多采用减压浓缩、喷雾干燥等设备和方法,以避免长时间高温处理过程对热敏性成分的破坏,提高生产效率。但是不同工艺参数及操作控制水平对制剂提取物中指标性成分的含量影响甚大,必然会引起产品质量及疗效的改变。应根据不同的制剂要求、物料性状等,选择合适的干燥方式。干燥时间过长,温度过高,压力不当,都容易引起质量风险。张薇比较了4种干燥方法,微波干燥丹参药材效率高,有效成分损失少[17]。
23硬件设施风险
药品生产条件是影响药物质量的外在条件,硬件设施是制药公司生产最基本条件,是实施GMP的三要素之一。包括生产环境(厂房和车间),机械设备,环境卫生等。
231厂房和車间
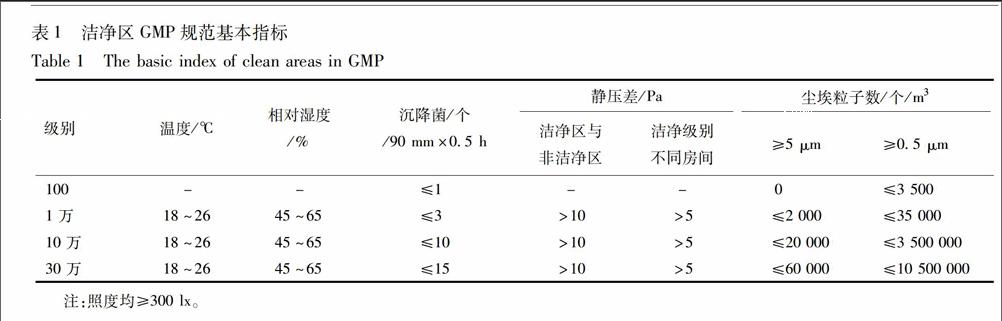
2010年版GMP中明确规定:厂房的选址、设计、布局、建造、改造和维护必须符合药品生产要求,应当能够最大限度地避免污染、交叉污染、混淆和差错,便于清洁、操作和维护。为了达到这一目的,药品生产企业必须具备其生产相适应的厂房和设施,包括与之配套的净化系统、水、气体、洗涤与卫生设施,安全设施等。洁净区为需要对尘埃及微生物含量进行控制的区域,应表面平整光滑、无裂缝、接口严密、无颗粒脱落。建筑结构、装备及其使用均具有减少该区域内污染的介入、产生和滞留功能。对于洁净区,GMP规范有以下要求:温度、湿度、压差、尘埃粒子等基本指标,只有各项指标符合标准,才能进行组织生产,见表1。
232机械设备
GMP第139条规定企业的厂房、设施、设备和检验仪器应当经过确认,采用经过验证的生产工艺、操作规程和检验方法进行生产、操作和检验,并保持持续的验证状态。机械设备风险主要包括:操作风险、清洁风险、维护风险、验证风险[18]。如制药设备是否符合生产工艺的要求,配套的仪器、仪表能否按工艺要求实现控制,制造设备所用材质是否合理,设备的校验是否合规,设备设施是否按要求操作等操作风险;设备的有关零部件是否方便拆卸与清洗和设备清洗是否恰当等清洁风险;设备运行是否稳定、可靠和能否达到无故障或故障率极小等维护风险[19];设备是否存有详细历史记录、是否存在同样设备和相似设备,操作和存放条件的温度和湿度是否稳定、输电线用电情况是否清楚、是否存在磁场干扰,设备置于清洁区域,人流物流通过是否对设备有影响,临时变更设备是否按要求操作等验证风险[20]。设备的设计和选型应符合药品生产质量的要求;生产前必须满足设备的净化、清洗和灭菌要求;设备的材质、外观、结构设计应符合药品安全需求,不能影响药品质量;应该严格执行设备安全管理制度,保证设备安全正常运行。
233卫生环境
卫生包括生产厂房卫生,生产工艺卫生,原辅料与包装材料的卫生,人员卫生等。其中人员卫生是主要的风险来源。人员的健康、卫生习惯和着装均会影响药品质量。GMP中对人员卫生进行详细的要求,制剂生产过程中应严格控制人员卫生。如进入生产厂房时,应当仅限于经批准的人员出入,应该设有符合要求的人员卫生通道与物料通道等;在进行操作时,要严格各项操作规程;在生产结束后,要进行清场操作,控制生产环境,而且在批记录和生产记录上也有清场记录。
GMP中多次谈及“环境监测”,生产环境主要包括:温度,湿度,空气,光照。温度过高会使得药品理化性质改变。蛋白质类成分在温度过高的情况下,出现凝固、分层、沉淀而发生变质。生物制剂在生产过程中,应该严格控制温度;药品储存需注意湿度的控制。湿度过高,容易发霉变质,湿度过低,又会使药物干裂、发脆、变形、变硬[21];空气中的氧气和二氧化碳可能会促使药物氧化或碳酸化,使得药物变质。如酚类水杨酸钠易被氧化成醌类结构,黄芩苷也会被氧化发生变色;光是一种辐射能,会促使药物的氧化、还原、分解而变质。如尼莫地平含有对光不稳定的结构,易光化降解,在生产过程中应该注意避光。
24管理风险
管理大致可以分为4类,即人员、物料、技术、文件等管理,其中包括组织、制度、工艺、操作、记录、教育等管理规定。
241人员管理
GMP对制药企业的中层和高层管理人员的学历都有着最基本的要求,注重对企业员工培养和培训需求。2010年版GMP首次明确规定了质量授权人制度,突出对药品质量的重视。人员是GMP实施的三大要素之一,也是最重要的因素。产品质量的好坏是全体员工工作质量好坏的反映,优良的硬件设备要由人操作,好的软件系统要有人来制定和执行,对人员的教育和培训是企业GMP深入和持续的关键,将人为的差错控制在最低的限度内,是GMP的目标所在。人员风险主要包括操作风险、责任风险、技术风险和道德风险[18]。降低人员风险,切实按照GMP的要求对人员进行管理,建立相互督查检查制度,制定和落实部门责任制;制定规范工艺操作程序;各生产工艺严格复查,如称量、工艺参数设定等;对人员进行有制度,有效的卫生、药学知识、操作教育和管理,进行培训后上岗;合理控制生产人员的人数。
242物料管理
良好的物料管理系统是药品GMP管理的基础。药品生产是在生产现场将物料加工与制作转换成产品的一系列实现过程。产品质量基于物料质量,形成于药品生产的全过程。物料质量是产品质量先决条件和基础[22]。加强物料管理有利于预防污染、混淆和差错;确保储存条件适宜,保证药品质量;防止不合格物料投入使用或成品出厂;对物料、中间体及成品的数量、状态、有效期等进行有效管理和控制。
物料管理风险包括因原料药、辅料、中间体、中间产品、成品等的投料;外来因素污染中间体或原料药;物料采购、存储;选择制备工艺、系统设备设施材质、储存方式、管路消毒灭菌的措施;供应商的管理不当等因素导致的物料风险,应该按照GMP法规进行供应商的评估和批准。GMP要求物料供应商的确定及变更应当进行质量评估,建立物料供应商评估和批准的操作规程。降低物料风险,在设计厂房时就应该严格分开各操作区间,保持宽敞的工作间,并且每个生产环节之间保持一定的距离,有效消除生产的障碍;生产过程中,运送容器、生产机械都应该标明正在生产药品的名称、规格、批号等状态标志。
243技术管理
质量风险容易发生的两方面,即工艺变更和供应商变更[23]。企业必须建立完善的切实可行的工艺技术规范,关键环节都要有具体的参数要求规定,尽可能减少因为人为因素造成的交叉污染、混淆和差错。技术管理风险主要包括因温度、压力、压差、湿度、尘埃粒子、送风次数、真空度、时间、收率、质量等参数限度超出范围而引起的风险。GMP规定应当及时进行工艺验证,主要生产工艺和检验方法经过验证后才能批准放行。质量管理部门严格执行质量管理的职责定期维修校正机械设备;检查生产各阶段半成品及成品的质量;能夠进行生产技术改造,提高药品生产效率或质量;追踪药品批号;按照规定进行药品留样考察;及时反馈药品投诉情况,随时完善药品生产管理。
244文件管理
文件是质量保证系统的基本要素。从原料的采购,进厂,再投入生产,包装,出厂前的检验,以至于产品的售后服务部都有文件跟踪,做到有据可查,一旦产生质量事故可以追溯任何一个环节。文件系统包括标准部分的技术标准、管理标准,工作标准和记录部分的生产管理记录、质量管理记录。文件管理风险有因生产记录填写不完整,不规范而引起的风险;生产SOP需临时变更而引起的风险;标签发放、使用、剩余、销毁数检测过程异常发生的风险等。降低文件管理风险,首先应该建立系统性、动态性、适用性、可追溯性的文件管理制度,再落实人员培训教育工作,减少人员操作误差,最后督查人员不定期抽查进行有效监督。
3识别风险的方法
风险识别,就是识别药品生产过程中可能对药品质量产生影响的各种因素。可以通过查阅文献,现场调查和检测的基础上,运用质量风险管理工具,识别风险。药品生产过程中,质量风险是无处不在的。从“人、机、料、法、环”的管理角度进行分析,可初步对风险的来源(人员、设备、物料、生产工艺、环境风险)进行分类,全面而系统地将风险因子进行识别。此外,ICHQ9中质量风险管理工具可以应用于药品质量风险管理实践中。目前,制药行业常用的风险管理工具包括辅助性统计工具、故障树分析(FTA)、危害及可操作性分析(HAZOP)、预先危险分析(PHA)、危害分析关键控制点(HACCP)、故障模式效应分析(FMEA)等7种。
4控制中药制剂质量风险的建议
41加强中药制剂质量标准规范建设
当前我国制药企业水平良莠不齐,很多前期加工方法与工业化规模生产不相适应,造成制药过程的随意性大,甚至部分企业用提取物直接投料代替原料药,造成这种现象的主要原因之一就是缺乏有效的质量标准约束,现行的质量控制手段无法控制中药制剂的内在品质。为此,国家在2016年密集推出系列政策措施,强调中药制剂整体质量控制。医药工业“十三五”制定专栏,推进医药行业两化深度融合,强调制定和提升中药大品种的生产质量控制标准。国务院发布的中医药发展战略规划纲要(2016—2030年)推进实施中药标准化行动计划,构建中药产业全链条优质产品标准体系。
构建中药制剂全过程可追溯的质量控制体系是目前一系列政策措施提出的发展方向。而要实现制剂全过程的质量控制的目标,首先应该明确控制什么,因此,构建及完善符合中药制剂产品特点的质量标准是提升制剂质量的突破口。为此,国家中医药管理局在2016年开展了中药标准化项目,强调企业需根据自身产品特点,针对性构建从原料到成品的全过程质量可追溯控制体系,强调个性化与标准化的统一,首批建设项目涉及中药大品种59种,常用中药饮片101种,总经费737亿元。
中药制剂生产过程质量控制中,急需建立符合中医药特点的质量标准。现行中药制剂质量标准大多采用化学药的模式,局限于外观、性状、成品指标性成分含量测定等,很少对制剂生产过程中成分间相互作用与工艺环节的相关性进行系统分析。作者认为要想实现中药制剂质量的均一、稳定、有效,首先应明确关键的质量目标,建立符合中药制剂特点的质量标准,明确关键控制单元,其次,结合实际生产工艺和环境条件,实现针对性的、有目标的质量控制。
42建立多环节、多单元的全过程质量风险管理理念
中药制剂生产过程是个复杂系统,最终制剂成品的生产过程需涉及多环节、多层次、多操作单元的密切配合与衔接,任何一个环节或单元如出现失误,即对最终产品质量构成一定程度的威胁,影响产品效能的发挥。由于中药制剂的特殊性(原料来源的不确定性、工艺操作环节复杂性、质量标准不完善等),中药制剂生产过程存在不同层次质量风险来源。如何有效对最终产品进行合理质量控制,保证产品质量均一、稳定、有效。作者认为有必要借鉴现代先进的质量源于设计(QbD)理念,产品质量的优劣不仅依靠检验方法,更依靠设计开发、生产控制及物流管理等产品制造的所有环节,质量源于全过程控制水平。准确识别药品生产过程可能诱发质量风险的因素,建立多环节、多单元的全过程质量风险管理理念。首先明确各个操作单元、不同管理层次对最终产品质量影响的风险来源及影响程度;其次树立各单元操作间不是机械组合或简单相加,各要素间普遍联系、相互关联,共同构成过程链的系统整体理念。药物的化学信息、物理信息、热力学信息等信息在各单元间转化,动态传递,各信息间整体转化程度和控制水平共同决定了药物品质内涵。
[参考文献]
[1]荣晓阳, 梁毅 浅谈PAT在GMP管理中的应用[J] 机电信息, 2010, 2(5): 24
[2]International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH) Quality risk management Q9 [EB/OL] [20161228] http://wwwichorg/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q9/Step4/Q9_Guidelinepdf
[3]田英娜, 宋丽丽 浅析我国10年間药品风险管理的研究状况[J] 中国药事, 2012, 26(2): 180
[4]中国药材公司 中国中药资源志要[M] 北京: 科学出版社, 1994: 1
[5]毛淑杰, 王智民, 李先端,等 浅谈中药炮制辅料的研究[J]. 中国中医药信息杂志, 2011, 18(1): 7
[6]饶伟文, 周文杰 中药产地加工规范化研究进展[J] 中国中医药信息杂志, 2012, 19(2): 106
[7]钟燕珠, 雷旭, 区炳雄,等 中药饮片切制规格对煎煮效果的影响[J] 现代医院, 2014,14(7): 66
[8]王艳萍 中药饮片切制规格对煎煮效果的影响[J] 亚太传统医药,2015, 11(14): 19
[9]徐智毅 浅谈天麻不同切制法对质量的影响[J] 中国实用医药, 2012, 7(10): 236
[10]滕菲, 张学兰, 徐鑫 当归饮片的软化工艺研究[J] 青岛科技大学学报:自然科学版, 2009,30(2): 131
[11]李凯, 梁勇, 刘磐,等 不同软化方法对白芍饮片质量的影响[J] 中国实验方剂杂志, 2013, 19(3): 20
[12]谢杰 浅谈切制前的软化处理对饮片质量的影响[J] 中国现代药物应用, 2012, 6(18): 121
[13]刘智,张大方,曲晓波,等 炮制对乌头生物碱的影响及毒性作用研究[J] 时珍国医国药, 2012, 23(5): 1113
[14]曾宝, 黄孟秋, 唐君苹,等 巴豆炮制新工艺及其生品与炮制品的对比研究[J] 中药材, 2012, 35(3): 371
[15]唐进法, 李学林 煎药器具对肉桂中桂皮醛煎出量的影响研究[J] 中国药房, 2010, 21(31): 2900
[16]梁志国, 刘利科 中药多功能提取罐自控要求的有关问题探讨[J] 化工与医药工程, 2015, 36(6): 56
[17]张薇, 邹兆重, 刘慧珍,等 微波干燥丹参药材及其质量评价研究[J] 中国中医药信息杂志, 2010,17(12): 36
[18]周文瑜, 梁毅 浅谈新版GMP中的质量风险管理制度[J] 机电信息, 2011, 23(8): 18
[19]王双乐 从药品生产质量控制看选择制药设备的重要性[J]. 上海医药, 2011, 32(12):621
[20]赖婉枫, 解馨 “质量风险管理”在GMP管理过程中的应用[J] 中国食品药品监管, 2010(6): 60
[21]冷淑萍 浅谈中药饮片储存过程中的常见问题与养护方法[J] 中国卫生产业,2012(22): 174
[22]谢敬东 药品生产现场GMP管理策略研究[D] 沈阳: 沈阳药科大学, 2008
[23]张文慧, 袁彦稳 论质量风险管理在药品生产企业中的作用[J] 中国医药指南, 2012, 10(7): 282[责任编辑孔晶晶]

