H2S通过上调HO-1表达保护坏死性小肠结肠炎大鼠肠黏膜
曾照军钟 森王家宁唐俊明张 蕾王金堂赵 旸
湖北医药学院附属人民医院1.儿科,2.临床医学研究所(湖北十堰 442000)
H2S通过上调HO-1表达保护坏死性小肠结肠炎大鼠肠黏膜
曾照军1钟 森1王家宁2唐俊明2张 蕾2王金堂1赵 旸1
湖北医药学院附属人民医院1.儿科,2.临床医学研究所(湖北十堰 442000)
目的观察新型外源性硫化氢(H2S)供体GYY4137对坏死性小肠结肠炎(NEC)大鼠肠黏膜的保护作用,并探讨其可能的作用机制。方法取60只健康新生SD大鼠,随机分成4组。正常对照组,不施加任何干预;NEC模型组,通过人工喂养、缺氧、冷刺激、脂多糖方法制备NEC模型;H2S干预组,在NEC模型的基础上,腹腔注射H2S供体GYY4137;血红素加氧酶-1(HO-1)抑制剂组,在H2S干预组已有干预的基础上,腹腔注射HO-1抑制剂Znpp。于试验第4天处死大鼠,取回盲部肠管进行苏木精-伊红(HE)染色并作组织病理学评分;检测各组新生鼠小肠组织中丙二醛(MDA)及超氧化物歧化酶(SOD)含量,肿瘤坏死因子α(TNF-α)水平以及肠道组织HO-1表达。结果4组新生大鼠肠组织病理评分的差异有统计学意义(P<0.001),NEC模型组的病理评分最高,其次为HO-1抑制剂组、H2S干预组。NEC组病理评分≥2,表明建模方法有效。NEC组与对照组相比,MDA及TNF-α含量明显上升,T-SOD含量下降,差异有统计学意义(P<0.05);H2S干预组同NEC组相比,MDA及TNF-α含量明显降低,T-SOD含量明显升高,HO-1表达增加,差异有统计学意义(P<0.05);HO-1抑制剂组较H2S干预组相比,MDA及TNF-α含量明显升高,T-SOD含量降低,差异有统计学意义(P<0.05)。结论新型H2S供体GYY4137能够有效保护NEC大鼠肠黏膜,降低MDA及TNF-α的含量,增加T-SOD的含量;其保护作用可能与上调HO-1蛋白的表达有关。
坏死性小肠结肠炎; 硫化氢; 血红素加氧酶-1; 大鼠
新生儿坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是新生儿期严重危及生命的疾病,后期容易引起脓毒症及多器官功能障碍综合征,治疗效果差,预后不理想,死亡率高[1]。虽然目前关于NEC的确切发病机制尚无定论,但学者认为过度的氧化应激损伤及炎症反应在NEC发生发展中可能起重要作用[2]。
H2S作为人类发现的第三类气体信号分子,具有强大的抗炎、抗氧化、血管调节及神经保护等作用[3]。在胃肠疾病中,H2S在炎症性肠病(IBD)、非甾体类抗炎药(NSAIDs)所致的胃黏膜损伤、结肠肿瘤中发挥作用[4]。本研究探讨H2S对NEC大鼠肠黏膜的保护作用及作用机制。
1 材料与方法
1.1 试验动物与分组
1.2 方法
1.2.1 NEC建模与喂养 采用张丙宏等[5]在三因素联合造模[6]的基础上,改进方法制备NEC模型,即将新生12 h内的SD大鼠置入保育箱中喂养(37℃,湿度45%~55%),采用鼠乳代用品人工喂养,并定期给予脂多糖(LPS 2.5 mg/kg,美国Sigma公司)腹腔注射,缺氧冷刺激,以建立新生SD大鼠NEC模型;H2S干预组同时腹腔注射H2S供体GYY4137 10 mg/(kg·d),2次/d,共3天;HO-1抑制剂组在H2S干预组的基础上腹腔注射Znpp 10 mg/(kg·d),2次/d,共3 d。
1.2.2 标本采集 所有新生大鼠在第4天空腹12 h后断头法处死,取回盲部肠管组织3 cm,其中1 cm左右固定于10%多聚甲醛溶液中,用于病理组织学分析,另外2 cm储存在液氮中,用于生化分析及蛋白质印记技术。
1.2.3 组织病理学分析 将固定于10%多聚甲醛中的小肠组织经脱水、石蜡包埋后切取冠状面肠管组织,水化后苏木精-伊红(HE)染色,每组随机选取6张切片,由2名观察者按照Nadler标准独立评分[7]。0分:肠道绒毛及上皮完整,组织结构正常;1分:轻微黏膜下或固有层肿胀分离;2分:中度黏膜下和/或固有层分离,黏膜下和/或肌层水肿;3分:重度黏膜下和/或固有层分离,甚至局部绒毛脱落;4分:肠绒毛消失伴肠坏死。如遇意见不一致,交由第三位研究人员讨论确定病理评分。其中病理评分≥2分视为NEC建模成功。
1.2.4 HO-1表达检测 采用Western blot方法。从液氮中取出大鼠肠管组织,去湿称重后按照100 mg组织比500 μL缓冲液的比例加入蛋白裂解缓冲液,提取待测组织总蛋白,10%聚丙烯酰氨凝胶电泳后将目的蛋白质转移至硝酸纤维膜上,5%脱脂牛奶封闭后加入HO-1及GAPDH一抗,4℃冰箱孵育过夜,相应二抗孵育2 h,最后将含有目的蛋白的硝酸纤维膜置于ChemiDoc XPS发光系统显影。
1.2.5 小肠超氧化物歧化酶(SOD)及丙二醛(MDA)含量检测 取回盲部肠管组织去湿称重后,用冰生理盐水作为匀浆递质制作10%匀浆液。采用南京建成生物工程研究所提供的SOD及MDA试剂盒,严格按照说明书检测各组SOD及MDA含量。
1.2.6 炎症因子TNF-α的检测 按照深圳欣博盛生物科技有限公司提供的TNF-α ELISA试剂盒说明书提供的操作方法,以冰生理盐水作为匀浆递质制备小肠组织匀浆液,用双抗体夹心法检测各组TNF-α的含量。
1.3 统计学分析
基于动态加密因子的对称加解密通信算法,采用动态加密因子作为算法因子。动态加密因子由两部分组成,一个是登录的用户名(注:包含用户名但不限用户名,这里泛指所有可变的动态字符串,例如:时间戳、GUID(全局唯一标识符)、随机数等等,本文统一采用“登录用户名”描述),一个是可配置的混淆因子。
应用SPSS 17.0统计软件进行数据处理。正态分布计量资料以均数±标准差表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;非正态计量资料以中位数和四分位数范围表示,组间比较采用Kruskal Wallis H秩和检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 一般情况
正常对照组大鼠进食、排便正常,未出现胃肠道及其他不良反应。NEC模型组大鼠从建模第一天开始出现活动量明显减少,精神萎靡,大便变稀甚至变黑,之后陆续开始出现进奶量减少,喂养困难,排脓血样变,进而消瘦,皮肤色泽变暗甚至出现明显发绀、嗜睡。H2S干预组也出现轻微大便变稀,对刺激反应变差,但喂奶相对容易,食欲较好,体质量略有增加。HO-1抑制剂组大鼠表现基本同NEC模型组,出现不同程度排脓血样便、发绀、抽搐、嗜睡。
2.2 肠组织损伤情况及病理评分
正常对照组大鼠回盲部肠管呈乳黄色,富有弹性及光泽,病理评分多为0分。NEC组肠管明显扩张充气,弹性差,肠壁菲薄呈黑红色,部分穿孔,腹腔不同程度积液,有腥臭味,病理评分多为3分以上。H2S干预组肠管扩张充气程度较NEC组减轻,肠管暗红色,弹性及光泽度较差,腹腔积液有所改善,病理评分多为2分左右。HO-1抑制剂组肠管扩张充气程度较H2S干预组明显加重,肠管暗红色,肠壁菲薄甚至穿孔,腹腔大量积液,病理评分明显增加。4组新生大鼠肠组织病理评分的差异有统计学意义(H=19.35,P<0.001),NEC模型组的病理评分最高,其次为HO-1抑制剂组、H2S干预组。各组新生大鼠肠管HE染色见图1,光镜下表现及病理评分见表1。NEC模型组的病理评分结果及该组大鼠出现的相关症状表明NEC模型,该实验有效。
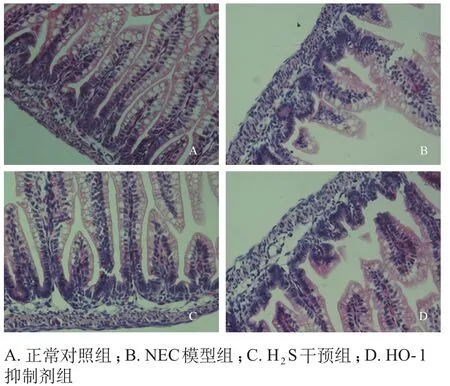
图1 大鼠小肠组织病理(HE×400)
2.3 肠组织HO-1蛋白表达的变化
正常对照组HO-1表达量很低,NEC组HO-1的表达水平有所提高,H2S干预组HO-1的表达量较NEC显著提高,HO-1抑制剂Znpp可以明显抑制HO-1的生成。见图2。
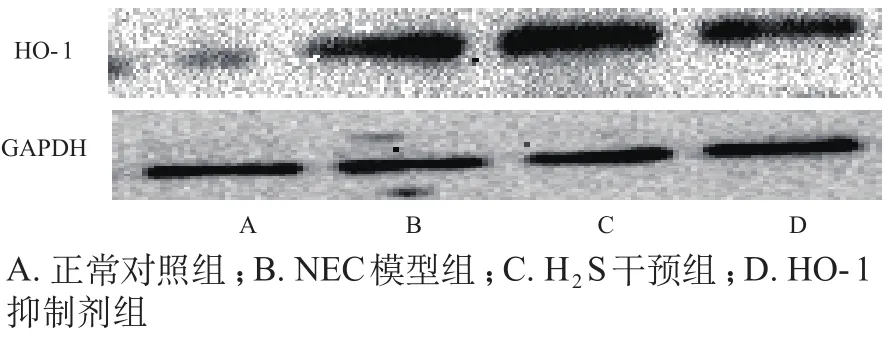
图2 各组大鼠小肠组织HO-1表达情况
2.4 肠组织T-SOD及MDA含量变化
4组新生大鼠肠管组织T-SOD及MDA含量的差异均有统计学意义(P均<0.001),NEC组较正常对照组相比,肠组织T-SOD活力明显降低,MDA含量明显增加,差异有统计学意义(P<0.05);用H2S供体GYY4137干预后,与NEC组相比肠组织T-SOD活力有所恢复,MDA含量明显下降,差异均有统计学意义(P<0.05);在腹腔注射HO-1的抑制剂Znpp后,与H2S干预组相比,SOD活力明显降低,MDA含量升高,差异有统计学意义(P<0.05),而与NEC组的差异无统计学意义(P>0.05)。见表2。

表1 各组HE染色光镜下表现及病理评分 [M(P25~P75)]
表2 各组小肠组织内T-SOD、MDA、TNF-α水平 (±s)
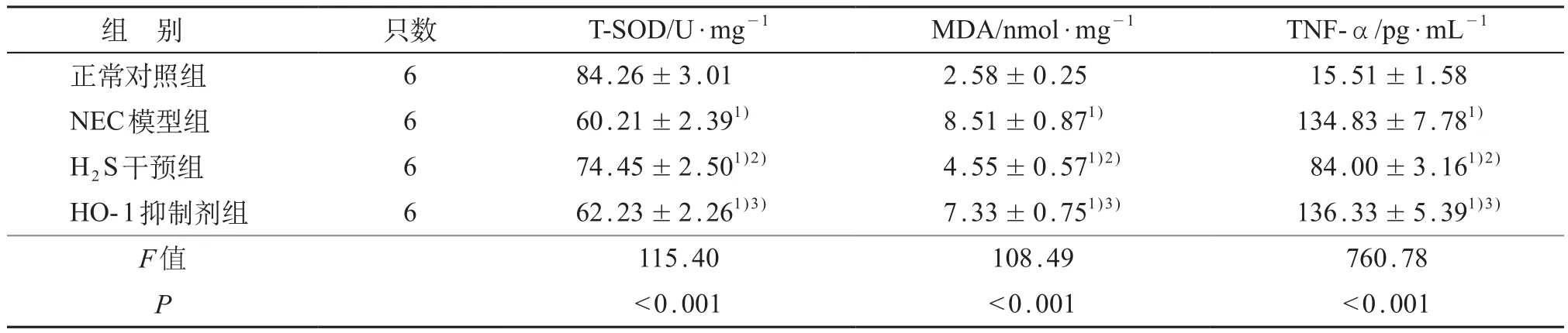
表2 各组小肠组织内T-SOD、MDA、TNF-α水平 (±s)
注:1)与正常对照组相比,P<0.05;2)与NEC模型组相比,P<0.05;3)与H2S干预组相比,P<0.05
组 别 只数 T-SOD/U·mg-1 MDA/nmol·mg-1 TNF-α/pg·mL-1正常对照组 6 84.26±3.01 2.58±0.25 15.51±1.58 NEC模型组 6 60.21±2.391) 8.51±0.871) 134.83±7.781)H2S干预组 6 74.45±2.501)2) 4.55±0.571)2) 84.00±3.161)2)HO-1抑制剂组 6 62.23±2.261)3) 7.33±0.751)3) 136.33±5.391)3)F值 115.40 108.49 760.78 P<0.001 <0.001 <0.001
2.5 肠组织TNF-α含量变化
4组新生大鼠肠管组织炎症因子TNF-α含量的差异有统计学意义(P<0.001),NEC组TNF-α含量较正常对照组明显升高,差异有统计学意义(P<0.05);腹腔注射GYY4137后,与NEC组相比TNF-α含量明显降低,差异有统计学意义(P<0.05);而在腹腔注射HO-1抑制剂Znpp后,与H2S干预组相比,TNF-α的含量明显升高,差异有统计学意义(P<0.05),而与NEC组的差异无统计学意义(P>0.05)。见表2。
3 讨论
NEC是在多种因素作用下发病,目前认为与早产儿胃肠道功能不成熟、喂养方法不当、早产、新生儿期窒息、低氧、感染等因素相关[8]。其好发部位为回盲部肠管,主要病理改变为肠管扩张充气,黏膜坏死,肠壁变薄甚至穿孔,严重者肠壁全层坏死。该病好发于早产儿,特别是极低出生体质量儿,早期缺乏典型的临床症状及体征,诊断困难,同时缺乏有效的治疗方法,国内报道其病死率高达10%~50%。[9]
H2S是继一氧化氮(NO)和一氧化碳(CO)之后人类发现的第三类气体信号分子,在机体生理及病理情况下都发挥着重要的作用[10]。有研究表明H2S可通过抗炎、抗氧化、抗凋亡作用保护缺血再灌注导致的胃黏膜细胞损害[11]。本实验虽然采用了不同的疾病模型,但得出了相同的结果:H2S干预后,NEC大鼠肠黏膜损伤明显减轻,肠绒毛部分恢复正常形态,肠管扩张充气有所改善,腹腔积液减少。这表明,H2S可以减轻NEC大鼠的肠黏膜损伤。
SOD是体内清除氧自由基的关键酶,能够抑制脂质过氧化,稳定细胞膜结构[12]。NEC发生后,大鼠小肠SOD活性明显降低,对氧自由基清除能力下降,并导致细胞膜损伤和机体炎症反应。MDA是氧自由基引起细胞膜脂质过氧化反应过程的产物,NEC发生后,细胞膜脂质过氧化加剧,MDA产生明显增加,细胞膜通透性增加,胞内Ca2+浓度过大导致细胞死亡,同时使膜蛋白变性,引起炎性渗出。由此可见对SOD及MDA含量的检测可直接或间接反映机体氧自由基的过程,评价组织受损程度。
HO-1又被称为热休克蛋白,当机体处于应激状态时,HO-1可作为保护性蛋白被诱导。生理情况下,肠道中HO-1基本不表达,但在缺血、缺氧、再灌注损伤的情况下,HO-1的表达增加[13]。在本研究中,NEC发生后,由于肠组织缺血缺氧及感染,HO-1的表达较正常对照组明显增加。相关研究发现,H2S在心肌炎及慢性心力衰竭中发挥保护作用时,HO-1的表达上调[14,15],另有研究发现在人类肾脏损伤细胞里,H2S可以诱导HO-1表达上调[16]。而HO-1基因缺陷新生小鼠较HO-1基因正常小鼠肠坏死明显加重,炎症反应更为剧烈[17]。这些研究表明,H2S可能通过刺激HO-1的生成来发挥上述作用。本实验的结果也证实了这一点,在加入HO-1的抑制剂Znpp后,H2S对NEC肠黏膜的保护作用消失,病理评分增加,SOD含量降低,MDA及TNF-α含量增加。
由此我们推测,H2S新型供体GYY4137对NEC大鼠肠黏膜的保护作用可能是由于诱导了HO-1这一关键蛋白的表达,由HO-1发挥抗氧化、抗炎作用。HO-1可将血红蛋白分解代谢成为胆绿素、胆红素、铁离子以及一氧化碳,这些分子通过不同的途径减轻细胞膜脂质过氧化反应,降低机体炎症反应及细胞凋亡,最终保护了NEC大鼠的小肠黏膜。本实验对H2S保护NEC大鼠肠黏膜进行了初步研究,推测H2S可能是HO-1的诱导剂,但是对GYY4137如何刺激HO-1产生这一关键机制未能阐明,因此还需设计相关研究论证这一点。H2S有多种类型供体,性质各异,是否其他类型供体也具有同等的保护作用也需要验证。本研究为NEC的治疗开阔了新思路,H2S有可能成为NEC治疗的潜在药物。
[1] Choi YY.Necrotizing enterocolitis in newborns:update in pathophysiology and newly emerging therapeutic strategies [J].Korean J Pediatr, 2014, 57(12):505-513.
[2] Perrone S, Tataranno ML, Santacroce A, et al.The role of oxidative stress on necrotizing enterocolitis in very low birth weight infants [J].Curr Pediatr Rev, 2014, 10(3):202-207.
[3] Beltowski J.Hydrogen sul fi de in pharmacology and medicine - an update [J].Pharmacol Rep, 2015, 67(3):647-658.
[4] 程英, 王邦茂.硫化氢与胃肠道疾病关系的研究进展[J].国际消化病杂志, 2008,28(1):32-33.
[5] 张丙宏, 席世兵, 钟森, 等.硫化氢对新生鼠坏死性小肠结肠炎的抗炎保护作用[J].中国新生儿科杂志, 2016, 31(3):217-221.
[6] Sodhi C, Richardson W, Gribar S, et al.The development of animal models for the study of necrotizing enterocolitis [J].Dis Model Mech, 2008, 1(2-3):94-98.
[7] Dvorak B, Khailova L, Clark JA, et al.Comparison of epidermal growth factor and heparin-binding epidermal growth factor-like growth factor for prevention of experimental necrotizing enterocolitis [J].J Pediatr Gastroenterol Nutr, 2008, 47(1):11-18.
[8] Lim JC, Golden JM, Ford HR.Pathogenesis of neonatal necrotizing enterocolitis [J].Pediatr Surg Int, 2015, 31(6):509-518.
[9] 易小莲,张丙宏,严彩霞,等.新生儿坏死性小肠结肠炎发病机制研究进展 [J].中国新生儿科杂志, 2011, 26(2):130-132.
[10] Kolesnikov SI, Vlasov BY, Kolesnikova LI.Hydrogen sul fi de as a third essential gas molecule in living tissues [J].Vestn Ross Akad Med Nauk, 2015(2):237-241.
[11] Guo C, Liang F, Shah MW, et al.Hydrogen sul fi de protected gastric epithelial cell from ischemia/reperfusion injury by Keap1 s-sulfhydration, MAPK dependent anti-apoptosis and NF-kappaB dependent anti-in fl ammation pathway [J].Eur J Pharmacol, 2014, 725:70-78.
[12] Broxton CN, Culotta VC.SOD Enzymes and microbial pathogens:surviving the oxidative storm of infection [J].PLoS Pathog, 2016, 12(1):e1005295.
[13] Liao YF, Zhu W, Li DP, et al.Heme oxygenase-1 and gut ischemia/reperfusion injury:A short review [J].World J Gastroenterol, 2013, 19(23):3555-3561.
[14] Hua W, Chen Q, Gong F, et al.Cardioprotection of H2S by downregulating iNOS and upregulating HO-1 expression in mice with CVB3-induced myocarditis [J].Life Sci, 2013, 93(24):949-954.
[15] Zhang CY, Li XH, Zhang T, et al.Hydrogen sulfide upregulates heme oxygenase-1 expression in rats with volume overload-induced heart failure [J].Biomed Rep, 2013, 1(3):454-458.
[16] D'Araio E, Shaw N, Millward A, et al.Hydrogen sulfide induces heme oxygenase-1 in human kidney cells [J].Acta Diabetol, 2014, 51(1):155-157.
[17] Schulz S, Wong RJ, Jang KY, et al.Heme oxygenase-1 deficiency promotes the development of necrotizing enterocolitis-like intestinal injury in a newborn mouse model [J].Am J Physiol Gastrointest Liver Physiol, 2013, 304(11):G991-G1001.
Hydrogen sul fi de protects intestinal mucosa in a neonatal rat model of necrotizing enterocolitis by upregulating the expression of HO-1
ZENG Zhaojun1, ZHONG Sen1, WANG Jianing2, TANG Junming2, ZHANG Lei2, WANG Jintang1, ZHAO Yang1(1.Department of Pediatrics , 2.Clinical Research Institute,Renmin Hospital of Shiyan,Hubei University of Medicine,Shiyan 442000,Hubei, China)
ObjectiveTo explore the protective effects of GYY4137, a new hydrogen sulfide donor, on intestinal mucosa in a neonatal rat model of necrotizing enterocolitis (NEC), and its potential mechanism.MethodsSixty SD rats were randomly assigned into 4 groups:group A (control group), group B (NEC group), group C (NEC with GYY4137 treatment, H2S donor group), and group D (NEC with GYY4137 and Znpptreatment, HO-1 inhibitor group).The SD rat models of NEC were established using simulated milk feeding-hypoxia-cold stress-Lipopolysaccharides.The injury degree of intestinal mucosa was evaluated using HE-staining, and its mechanisms were investigated using biochemical indicators and Western blotting.ResultsCompared with control group, the pathology score and the total superoxide dismutase (T-SOD) in the NEC group was significantly higher, the concentrations of methane dicarboxylic aldehyde (MDA) and necrosis factor α (TNF-α) were lower(P<0.05).Compared with those in NEC group, the pathology score and the concentration of MDA and TNF-α in the H2S donor group were signi fi cantly lower, the T-SOD, and the HO-1 expression was higher.The pathology score and the level of MDA and TNF-α were signi fi cantly increased after treated with HO-1 inhibitor Znpp, and T-SOD was signi fi cantly decreased..ConclusionsThe GYY4137, as a new H2S donor, could attenuate the injury of intestinal mucosa in a neonatal rat model of NEC by upregulating the expression of HO-1.
necrotizing enterocolitis; hydrogen sul fi de; hemeoxygenase-1; rat
10.3969/j.issn.1000-3606.2017.02.015
2016-08-17)
(本文编辑:邹 强)
钟森 电子信箱:zhongsenys@163.com

