miR-let-7d通过调控核受体PPARγ促进肺癌细胞的增殖和侵袭*
钟加滕, 郭志刚, 苏 蔚
(新乡医学院 1基础医学院病理学教研室, 2基础医学院形态学实验室, 3第一附属医院病理科,河南 新乡 453003)
miR-let-7d通过调控核受体PPARγ促进肺癌细胞的增殖和侵袭*
钟加滕1, 郭志刚2, 苏 蔚3△
(新乡医学院1基础医学院病理学教研室,2基础医学院形态学实验室,3第一附属医院病理科,河南 新乡 453003)
目的: 探讨miR-let-7d对肺癌细胞核受体过氧化物酶体增殖物激活受体γ(PPARγ)的调控及对肺癌细胞增殖和侵袭的影响。方法: 用生物信息学分析与PPARγ相关的microRNA,通过质粒报告基因验证miR-let-7d的作用靶点;利用Western blot法筛选出PPARγ表达水平低的肺癌细胞株;通过双萤光素酶标记和Western blot法验证miR-let-7d对肺癌细胞中PPARγ表达的调控作用;通过集落形成实验检测miR-let-7d对肺癌细胞增殖能力的调控作用;通过Transwell侵袭实验检测miR-let-7d对肺癌细胞侵袭能力的作用。结果: 生物信息学的分析结果证明miR-let-7d可以调控核受体PPARγ的蛋白表达;在核受体PPARγ的3’UTR包含2个功能性的miR-let-7d结合位点;PPARγ是miR-let-7d的直接靶点,miR-let-7d可在蛋白和mRNA水平直接调控PPARγ的表达;miR-let-7d inhibitor通过升高PPARγ的表达促进肺癌细胞的增殖和侵袭能力。结论: miR-let-7d能够通过靶向增加具有抑癌作用的核受体PPARγ的表达水平,抑制肺癌细胞的增殖和侵袭能力。
肺癌; 微小RNA-let-7d; 过氧化物酶体增殖物激活受体γ
肺癌是呼吸系统最常见也是危害性最大的恶性肿瘤,发病率和病死率近年来不断上升,具有趋向年轻化的走势。尽管有联合化疗、手术等治疗方案,肺癌患者的5年生存率仍然很低[1]。肺癌细胞的病理组织形态及生物学特性具有高度多变的异质性,也为肺癌的诊治增加了难度[2-3]。因此,研究参与组成肺癌分子的经典信号通路,探讨其作用机制,寻找疾病预后指针的分子标志物,在深入研究其和肿瘤发生发展关系的基础上,研发相应的个性化治疗方案,是肺癌研究领域的重要内容。
过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPARs)是II型核受体超家族成员之一。PPARs包括PPARα、PPARβ和PPARγ 3个亚型,PPARs需要依赖配体激活的方式去调节转录,必须结合相应的配体才能发挥作用,通过与靶基因元件相识别,从而调控靶基因的表达水平,参与细胞的生物学功能调节[4]。近年研究发现,PPARγ存在于很多类型的肿瘤细胞中,PPARγ的表达与多种肿瘤的发生发展相关。很多前沿实验研究结果表明,某些PPARγ的配体(如格列酮类药物、前列腺素代谢物)对肺癌、膀胱癌、直肠癌、胰腺癌、胃癌等多种组织器官来源的恶性肿瘤发挥显著的抗癌作用[5-8]。因此PPARγ被认为是肿瘤靶向治疗的新方向,可以通过研究PPARγ的配体研发新的药物。
miR-let-7d是最先被研究的微小RNA(microRNA,miRNA,miR)之一,长度大约为21 nt,5P端序列为3’-UGAGGUAGUAGGUUGUGUGGUU-5’,3P端序列为3’-CCACACAACCUACUACCUCAUU-5’。miR-let-7d在卵巢癌、胰腺癌、乳腺癌等多种类型的肿瘤细胞中表达下调[9-12]。miR-let-7d可与原癌基因如RAS、MYC等结合,抑制肿瘤的进展,所以miR-let-7d扮演一个抑癌基因的角色[13]。
本研究通过生物信息学分析miR-let-7d和PPARγ的关系,认为miR-let-7d可以调控PPARγ的表达水平,通过萤光素酶标记验证PPARγ是miR-let-7d的直接靶点,然后利用miR-let-7d mimic过表达miR-let-7d的表达,观察PPARγ的表达水平,以及肺癌细胞增殖和侵袭能力的变化,探讨miR-let-7d肺癌的增殖和侵袭能力的影响。
材 料 和 方 法
1 细胞株与主要试剂
人肺癌细胞株A549、Bcl-2、M14、SPCA1和NCL-H446肺癌细胞株购自北京协和细胞研究所。胎牛血清和RPMI-1640培养基均购自Gibco;抗PPARγ兔单克隆抗体购自Abcam;质粒购自上海吉玛基因;Transwell小室购自Millipore;Matrigel购自BD。
2 实验方法
2.1 RT-PCR实验 首先合成PCR引物,将反应混合液加热至94~98 ℃保持20~30 s,反应温度降至50~65 ℃时,引物与互补的序列形成氢键。退火温度72 ℃,维持20~40 s,继续降低至68 ℃,PCR进行30~35个循环,68~74 ℃延伸5~10 min,使DNA全部反应完毕。通过PCR结果对转染效率进行验证。实验重复3次。
2.2 Western blot法检测PPARγ蛋白的表达 细胞转染72 h后,提取实验组和对照组细胞蛋白,BCA法测定蛋白浓度,加入loading buffer后煮沸蛋白。采用10% SDS-PAGE分离蛋白(每孔加入30 μg蛋白样品)。使用湿转法电转至PVDF膜,5%脱脂奶粉封闭2 h,1∶1 000 TBST稀释 I 抗(PPARγ),4 ℃过夜;加入1∶5 000稀释的羊抗兔 II 抗,室温孵育2 h;ECL发光。实验重复3次。
2.3 Transwell侵袭实验检测PPARγ表达对肺癌细胞侵袭能力的影响 所有试剂及器材均置于冰上预冷,将小室内膜均匀涂抹Matrigel 50 μL(0.2 g/L)的Transwell小室置于24孔板内,37 ℃孵育15 min,使胶凝固;消化、离心、计数细胞后,按照2.5×104/L用无血清培养基稀释细胞,制成细胞悬液;按照每孔200 μL,将细胞悬液加入Transwell上室,同时在Transwell下室加入含10%胎牛血清的培养基500 μL,放入37 ℃孵箱培养;甲醛固定,结晶紫染色15 min,然后用棉签轻轻擦拭内膜上的细胞。显微镜下计数4个高倍视野(×40)下穿过滤膜的细胞数。实验重复3次。
2.4 集落形成实验检测PPARγ表达对肺癌细胞增殖能力的影响 根据肿瘤细胞可以在无血清培养基中正常生长的特性,使用常规培养的肺癌细胞经胰酶消化后,1 000 r/min离心3 min,弃去上清液。加入5 mL无菌PBS溶液,轻轻吹散洗涤细胞沉淀并再次离心。反复洗涤3次后加入培养基,制备成单细胞悬液。测定肿瘤细胞浓度并调整为1×106/L,将单细胞悬液均匀接种在无菌6孔板内,进行平板集落培养。每3 d更换培养基1次,14 d后观察细胞集落形成情况。
3 统计学处理
采用SPSS 19.0软件,计量数据以均数±标准差(mean±SD)表示,2组间均数比较采用t检验,多组间均数比较采用单因素方差分析,以P<0.05表示差异有统计学意义。
结 果
1 生物信息学分析针对PPARγ的microRNA情况
为了探究是否存在能调节 PPARγ表达的 microRNA,首先从 GenBank中调取了 PPARγ的编码基因PSRRA(NM_004761)的 mRNA 序列。针对该基因 3’端非翻译区(3’-UTR),用3种最常用的 microRNA 位点预测软件(TargetScan[14]、PicTar[15]和 miRanda[16])对其进行了分析预测。分析结果发现以下的4条 mircoRNA:hsa-miR-125b、hsa-miR-37、hsa-miR-135a 和 hsa-miR-let-7d 在3种软件的评分系统中均获得了较高分值,极具与PPARγ 3’-UTR 发生功能性结合的潜力,因而用于后续研究。
运用 Western blot 技术检测4条microRNA(hsa-miR-125b、hsa-miR-37、hsa-miR-135a和hsa-miR-let-7d)对PPARγ表达水平的影响。将以上 microRNA mimic转染肺癌细胞株A549,结果显示只有 hsa-miR-let-7d能够显著抑制 PPARγ蛋白的表达,见图1。
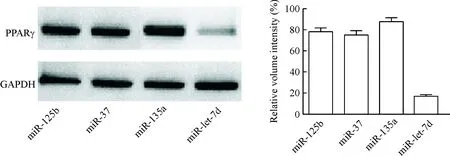
Figure 1.The effects of microRNA mimic transfection on the protein expression of PPARγ in the A549 cells. Mean±SD.n=10.
图1 不同micro mRNA mimic 转染对A549细胞PPARγ蛋白表达的影响
2 核受体PPARγ的3’-UTR包含2个功能性miR-let-7d结合位点
生物信息学的分析结果显示,在PPARγ的3’-UTR 有2个潜在的miR-let-7d结合位点,暂将其命名为位点A和位点B。使用PPARγ质粒报告基因活性分析进一步鉴定这2个结合位点的功能,显示miR-let-7d能显著降低含野生型全长PPARγ 3’-UTR 报告基因的转录活性,而其中任意一个识别位点的缺失都在一定程度上削弱miR-let-7d对报告基因活性的抑制作用,结果如图2所示。当位点B缺失时,miR-let-7d对报告基因的抑制率从57%降低到35%左右;当位点A缺失时,抑制率从57%下降到18%;如果2个位点都缺失,miR-let-7d不再对报告基因的活性产生任何影响。这提示3’-UTR 同时拥有2个功能性的 miR-let-7d识别位点,虽然两者与miR-let-7d的亲和力具有差别(位点A在 miR-let-7d介导的报告基因活性抑制中起着主要作用),但两者能以效应叠加的方式共同介导 miR-let-7d 对含PPARγ 3’-UTR 的报告基因活性的抑制。

Figure 2.Reporter activity assays to identify the exact miR-let-7d binding sites in PPARγ 3′-UTR. Mean±SD.n=10.*P<0.05vsnegative control.
图2 报告基因活性分析鉴定PPARγ 3’-UTR中miR-let-7d的精确结合位点
3 不同肺癌细胞株PPARγ和miR-let-7d的表达情况
为了探讨肺癌中miR-let-7d 和PPARγ表达水平的联系,检测不同肺癌细胞株(Bcl-2、A549、M14、SPC-A1和NCL-H446)PPARγ表达水平的差异。如图3所示,所有肺癌细胞株都有PPARγ表达缺失的情况。其中A549细胞株PPARγ的表达缺失水平最严重。miR-let-7d和PPARγ在表达水平上存在负相关趋势,提示miR-let-7d在肺癌细胞中的表达下调可能是导致PPARγ表达增高的主要原因。
4 miR-let-7d对肺癌细胞PPARγ表达的调控作用
如图4A、B所示,向PPARγ表达水平最低的肺癌细胞株A549转染miR-let-7d mimic能同时在mRNA和蛋白水平下调PPARγ的表达,而转染miR-let-7d inhibitor可以在mRNA和蛋白水平上调PPARγ的表达,提示miR-let-7d不仅能够促进PPARγ mRNA 的降解,还能阻碍PPARγ蛋白的翻译。双萤光素酶报告系统检测发现PPARγ是miR-let-7d的直接靶点,见图4C。考虑到肺癌细胞也同时表达PPARγ家族的另一成员 PPARα,两者无论在结构还是在功能上都有一定的相似性[17],且生物信息学预测在 PPARα的3’-UTR 也含有 miR-let-7d的结合位点,因此本研究也检测了 miR-let-7d对 PPARα表达的影响。结果表明,miR-let-7d对PPARα的表达并无影响,见图 4D。
5 敲减miR-let-7d的表达可以调控肺癌细胞的增殖
如图5所示,转染miR-let-7d inhibitor后,细胞集落形成的数目明显减少,集落直径距离降低,即细胞增殖能力下降。此结果提示miR-let-7d可以通过调控PPARγ的表达水平影响肺癌细胞的增殖能力。

Figure 3.The expression of PPARγ in different lung cancer cell lines. Mean±SD.n=10.
图3 不同肺癌细胞株中PPARγ的表达情况

Figure 4.The regulatory effects of miR-let-7d on PPARγ expression in the lung cancer cells. A: miR-let-7d mimic down-regulated the mRNA and protein expression of PPARγ; B: miR-let-7d inhibitor up-regulated the mRNA and protein expression of PPARγ; C: dual luciferase-labeled PPARγ was a direct target of miR-let-7d; D: miR-let-7d did not regulate the expression level of PPARα. Mean±SD.n=10.*P<0.05vsNC.
图4 miR-let-7d对肺癌细胞中PPARγ表达的调控作用

Figure 5.Knockdown of miR-let-7d expression inhibited lung cancer cell proliferation (×40). Mean±SD.n=10.*P<0.05vsNC.
图5 敲减miR-let-7d的表达可以抑制肺癌细胞的增殖
6 敲减miR-let-7d的表达可以调控肺癌细胞的侵袭
Transwell实验可见转染miR-let-7d inhibitor后,穿过小室的细胞数量明显减少,提示miR-let-7d可以通过调控PPARγ的表达水平影响肺癌细胞的侵袭能力,见图6。

Figure 6.Knockdown of miR-let-7d expression inhibited the invasion ability of lung cancer cells (×40). Mean±SD.n=10.*P<0.05vsNC.
图6 敲减miR-let-7d的表达可以抑制肺癌细胞的侵袭能力
讨 论
随着分子靶向治疗的进展,临床研究和分子生物学研究都提示PPARγ在肿瘤的发生发展中扮演着重要的角色。低表达PPARγ提示病程较晚,治疗效果不佳。而促进PPARγ的表达则能明显抑制恶性肿瘤的增殖和侵袭。因此探讨PPARγ在肺癌中表达调控和作用机制,可以有效帮助我们了解PPARγ与肺癌进展之间的联系,并利用调控PPARγ的表达水平来预测肺癌的进展速度。
MicroRNA调节是基因表达调控中最为重要的一种调节方式。目前尚未发现有关PPARγ与microRNA 相关性的调查报告,我们推测PARRγ的表达同时会受到 microRNA 的调节。通过生物信息学预测,我们发现 miR-let-7d可以通过结合2个位于 PPARγ 3’-UTR上高度保守的序列,调控PPARγ的 mRNA和蛋白水平,而且这种调节作用只针对于PPARγ,对该家族其它成员没有调控作用。
miR-let是最早发现的microRNA家族之一,miR-let-7d是其家族中的一员,分化成熟后的组织器官中表达相对较高[18]。在许多类型的恶性肿瘤中呈现低表达的状况,很多肿瘤研究都认为miR-let-7d扮演着抑癌基因的作用。相对于正常组织,在多种肿瘤细胞系和临床组织样本中均检测到其表达降低[9-12]。而对其功能的研究提示,miR-let-7d在很多肿瘤中发挥着抑癌基因的作用。然而,在肺癌细胞中miR-let-7d的表达水平和基因调控效应还是不清楚的。我们的调查发现,在不同类型的的肺癌细胞株中miR-let-7d都普遍存在表达下调的情况。更为重要的是,其表达水平与其调控的新型肺癌生物标志物PPARγ的表达水平呈负相关的关系。这提示PPARγ在肺癌中的过表达很有可能与miR-let-7d 抑癌基因的表达下降有一定关系。当然,我们所使用的肺癌细胞株的数量和种类是不齐全的,不能代表所有类型的肺癌病例。因此,我们后续研究工作是通过明确的分子分型的病理组织标本来研究miR-let-7d和PPARγ的具体关系和机制。
PPARγ是核激素受体超家族成员之一,PPARs与维甲酸类受体形成蛋白复合物与靶点结合,从而抑制目标基因的转录,当PPARs与配体结合被激活后,继续激活辅酶蛋白,然后启动子上游额过氧化物酶体增殖物反应元件(peroxisome proliferator response element,PPRE)相结合,调控靶基因的表达水平,并介导不同类型的生物学作用[19]。PPARγ在多种类型的肿瘤细胞中广泛表达。Dong 等[20]研究表明,PPARγ 在胰腺癌PANC1细胞中呈现高表达水平,格列酮类药物可以在体内有效减缓胰腺癌的发展。另外,有研究表明PPARγ激动剂HODE可以抑制结肠癌细胞增殖并诱导其凋亡[21]。此外,上调PPARγ表达可通过抑制Smad通路介导的上皮-间充质转化抑制肺癌细胞的转移[22]。PPARγ在肺癌细胞的侵袭中发挥着重要的促进作用,而其发挥这一效应的具体机制可能是,PPARγ能与JAK-STAT3相互作用组成复合体,诱导STAT3信号通路成员STAT3的磷酸化。经PPARγ诱导表达的STAT3可以通过自分泌的方式,促进细胞的迁移和侵袭[23]。众多研究表明PPARγ在体内扮演一个抑癌作用的因子,且对多种类型的肿瘤普遍适用,但是其具体的作用机制尚未有报道详细阐明,需要进一步的探讨。
综上所述,本研究证实,miR-let-7d这个具有抑癌活性的microRNA能够通过靶向增加在肺癌演进中扮演重要抑癌角色的核受体PPARγ的表达,从而抑制肺癌细胞的增殖和侵袭能力。这一研究成果一方面丰富了关于PPARγ表达调控机制的认识;另一方面也揭示了miR-let-7d在以PPARγ为靶点的抗击肺癌治疗中具有一定的潜在应用价值。
[1] Newman L, Kamb M, Hawkes S, et al. Global estimates of syphilis in pregnancy and associated adverse outcomes: analysis of multinational antenatal surveillance data[J]. PLoS Med, 2013, 10(2):e1001396.
[2] Lortet-Tieulent J, Soerjomataram I, Ferlay J, et al. International trends in lung cancer incidence by histological subtype: adenocarcinoma stabilizing in men but still increasing in women[J]. Lung Cancer, 2014, 84(1):13-22.
[3] Pless M, Stupp R, Ris HB, et al. Induction chemora-diation in stage IIIA/N2 non-small-cell lung cancer: a phase 3 randomised trial[J]. Lancet, 2015, 386(9998):1049-1056.
[4] Garin-Shkolnik T, Rudich A, Hotamisligil GS, et al. FABP4 attenuates PPARγ and adipogenesis and is inversely correlated with PPARγ in adipose tissues[J]. Diabetes, 2014, 63(3):900-911.
[5] Ramer R, Heinemann K, Merkord J, et al. COX-2 and PPAR-γ confer cannabidiol-induced apoptosis of human lung cancer cells[J]. Mol Cancer Ther, 2013, 12(1):69-82.
[6] 耿登峰, 伍 卫, 金冬梅, 等. PPARγ 激动剂罗格列酮对心肌缺血再灌注损伤的影响[J]. 中国病理生理杂志, 2005, 21(5): 872-875.
[7] 王吉娇. 吡格列酮对膀胱正常移行上皮细胞及膀胱癌细胞的影响研究[D]. 大连医科大学, 2014.
[8] 胡 琴, 李隆贵. 心肌脂肪酸氧化酶的基因调控机制及 PPARα 的作用[J]. 中国病理生理杂志, 2002, 18(12): 1552-1555.
[9] Leinders M, Doppler K, Klein T, et al. Increased cuta-neous miR-let-7d expression correlates with small nerve fiber pathology in patients with fibromyalgia syndrome[J]. Pain, 2016, 157(11): 2493-2503.
[10]Nuovo GJ, Garofalo M, Valeri N, et al. Reovirus-associated reduction of microRNA-let-7d is related to the increased apoptotic death of cancer cells in clinical samples[J]. Modern Pathol, 2012, 25(10):1333-1344.
[11]Patel D, Boufraqech M, Jain M, et al. MiR-34a and miR-483-5p are candidate serum biomarkers for adrenocortical tumors[J]. Surgery, 2013, 154(6): 1224-1228.
[12]Søndergaard HB, Hesse D, Krakauer M, et al. Differen-tial microRNA expression in blood in multiple sclerosis[J]. Multiple Sclerosis J, 2013, 19(14): 1849-1857.
[13]Chaudhry MA, Omaruddin RA. Differential regulation of microRNA expression in irradiated and bystander cells[J]. Mol Biol (Mosk), 2012, 46(4):569-578.
[14]He Y, Huang C, Lin X, et al. MicroRNA-29 family, a crucial therapeutic target for fibrosis diseases[J]. Biochimie, 2013, 95(7):1355-1359.
[15]Fabbri M, Garzon R, Cimmino A, et al. MicroRNA-29 family reverts aberrant methylation in lung cancer by targeting DNA methyltransferases 3A and 3B[J]. Proc Natl Acad Sci U S A, 2007, 104(40):15805-15810.
[16]Lawrence MS, Stojanov P, Polak P, et al. Mutational heterogeneity in cancer and the search for new cancer-associated genes[J]. Nature, 2013, 499(7457):214-218.
[17]Badman MK, Pissios P, Kennedy AR, et al. Hepatic fibroblast growth factor 21 is regulated by PPARα and is a key mediator of hepatic lipid metabolism in ketotic states[J]. Cell metabolism, 2007, 5(6): 426-437.
[18]Bai WL, Dang YL, Yin RH, et al. Combination of let-7d-5p, miR-26a-5p, and miR-15a-5p is suitable normalizer for studying microRNA expression in skin tissue of Liaoning cashmere goat during hair follicle cycle[J]. Czech J Animal Sci, 2016, 61(3):99-107.
[19]张婧媛, 张艳桥, 张一娜, 等. PPAR-γ 激动剂减轻缺氧性大鼠神经细胞损伤的作用机制[J]. 中国病理生理杂志, 2009, 25(1):89-92.
[20]Dong YW, Wang XP, Wu K. Suppression of pancreatic carcinoma growth by activating peroxisome proliferator-activated receptor gamma involves angiogenesis inhibition[J]. World J Gastroenterol, 2009, 15(4):441-448.
[21]Cimen I, Astarci E, Banerjee S. 15-lipoxygenase-1 exerts its tumor suppressive role by inhibiting nuclear factor-kappa B via activation of PPAR gamma[J]. J Cell Biochem, 2011, 112(9):2490-2501.
[22]Reka AK, Kurapati H, Narala VR, et al. Peroxisome proliferator-activated receptor-γ activation inhibits tumor metastasis by antagonizing Smad3-mediated epithelial-mesenchymal transition[J]. Mol Cancer Ther, 2010, 9(12):3221-3232.
[23]Serrano-Marco L, Barroso E, El Kochairi I, et al. The peroxisome proliferator-activated receptor (PPAR) β/δ agonist GW501516 inhibits IL-6-induced signal transducer and activator of transcription 3 (STAT3) activation and insulin resistance in human liver cells[J]. Diabetologia, 2012, 55(3):743-751.
(责任编辑: 林白霜, 罗 森)
miR-let-7d regulates lung cancer cell proliferation and invasion abilities through nuclear receptor PPARγ
ZHONG Jia-teng1, GUO Zhi-gang2, SU Wei3
(1DepartmentofPathology,SchoolofBasicMedicalSciences,2MorphologicalLaboratory,SchoolofBasicMedicalSciences,3DepartmentofPathology,theFirstAffiliatedHospital,XinxiangMedicalUniversity,Xinxiang453003,China.E-mail:hnswei@163.com)
AIM: To investigate the phenomenon that miR-let-7d regulates the proliferation and invasion abilities of the lung cancer cells through nuclear receptor peroxisome proliferator-activated receptors γ (PPARγ). METHODS: The relation between PPARγ and microRNA was analyzed by bioinformatics. The plasmid reporter assay was used to verify that PPARγ was the target of miR-let-7d. The lung cancer cell line with low expression of PPARγ was selected from different lung cancer cell lines by Western blot. The regulatory role of miR-let-7d in the lung cancer cells was determined by dual luciferase labeling and Western blot. The effect of miR-let-7d on the proliferation ability of lung cancer cells was detected by colony formation assay, the effect of miR-let-7d on the invasive ability of lung cancer cells was detected by Transwell invasion assay. RESULTS: The results of bioinformatic analysis showed that miR-let-7d regulated the expression of PPARγ, and the 3’UTR of PPARγ contained 2 functional miR-let-7d binding sites, indicating that PPARγ is a direct target of miR-let-7d. miR-let-7d was able to directly regulate the expression of PPARγ at mRNA and protein levels. Transfection of miR-let-7d inhibitor promoted the proliferation and invasion abilities of lung cancer cells by increasing the expression of PPARγ. CONCLUSION: miR-let-7d increases the expression of tumor suppressor PPARγ to inhibit the proliferation and invasive abilities of lung cancer cells.
Lung cancer; MicroRNA-let-7d; Peroxisome proliferator-activated receptors γ
1000- 4718(2017)04- 0699- 06
2016- 11- 08
2017- 01- 12
新乡医学院博士科研启动基金资助项目(No. 505079);新乡医学院第一附属医院博士科研启动基金资助项目(No. xyyfy2015BS-006)
R730.23
A
10.3969/j.issn.1000- 4718.2017.04.020
△通讯作者 Tel: 0373-3029123; E-mail: hnswei@163.com

