河蚬酶解物对乙醇诱导肝细胞LO2损伤的保护作用*
任娇艳 尚帅明 梁明 张婷 周勇 李海龙 袁尔东†
(1.华南理工大学 食品科学与工程学院, 广东 广州 510640; 2.无限极(中国)有限公司, 广东 广州 510665)
酒精性肝病(ALD)是全世界范围内发病率和死亡率较高的一大主要疾病.其发病机制比较复杂,可能与乙醇及其代谢产物乙醛、氧化应激、内毒素、脂质过氧化、细胞凋亡等多种因素有关[1].肝脏是乙醇在人体内的最重要的代谢器官,研究表明乙醇脱氢酶(ADH)、肝微粒体乙醇氧化系统(MEOS)以及过氧化氢酶(CAT)是参与乙醇代谢的3条途径[2].其中MEOS中核心的酶是细胞色素P4502E1(CYP2E1),该酶会被乙醇诱导而激活,参与大部分乙醇代谢,并产生过量的活性氧(ROS).细胞内累积的ROS会攻击细胞膜和线粒体,造成细胞结构和功能上的损伤,使得细胞内的氧化还原失衡,从而导致肝细胞损伤或凋亡,进一步造成酒精性肝损伤[3].因此,这种具有抗氧化能力的化合物潜在具备对酒精性肝损伤保护的功能.
河蚬(Corbiculafluminea)是双壳类软体动物,其营养丰富,含有丰富的蛋白质、糖原、必需氨基酸等物质,同时具备食用价值、保健作用以及药用价值,因其具有利尿、治疗肝病等功效而广受欢迎[4].研究发现[5],河蚬活性成分多糖CFPS-2具有很强的抗氧化活性且呈现出剂量效应,对人的胃癌细胞和卵巢癌细胞的生长也具有显著的抑制作用.河蚬的脂质成分可使高胆固醇食物诱发的高胆固醇血症小鼠血清中胆固醇浓度显著降低,促进胆固醇代谢为胆汁酸[6].
文中主要研究河蚬不同酶解物的抗氧化活性,建立乙醇诱导肝细胞(LO2)损伤模型,并利用此模型评价河蚬不同酶解物对乙醇致LO2细胞损伤的保护作用,筛选所得的河蚬酶解物可作为护肝健康食品中的活性功能因子.
1 实验
1.1 材料与试剂
河蚬干粉购自台湾;人正常肝细胞由中山大学医学院提供.
碱性蛋白酶(Alcalase,200 U/mg)、中性蛋白酶(Neutrase,200 U/mg)、木瓜蛋白酶(Papain,600 U/mg)、胰酶(Pancreatin,600 U/mg)、复合风味蛋白酶(Flavourzyme,30 U/mg),均由广州华琪生物科技有限公司提供.
DMEM培养基、磷酸缓冲溶液,美国Cibco公司生产;胎牛血清,杭州四季青有限公司生产;四氮唑蓝(MTT)、Trolox、荧光素钠(FL),美国Sigma公司生产;谷草转氨酶(AST)测试盒、谷丙转氨酶(ALT)测试盒,南京建成生物工程研究所生产.
1.2 仪器与设备
Synerg Neo2全功能微孔板检测仪,美国BioTek公司生产;CO2培养箱,美国Thermo Scientific公司生产;倒置显微镜,德国Leica公司生产.
1.3 方法
1.3.1 河蚬不同蛋白酶酶解物的制备
蛋白质含量测定参考GB 5009.4—2010《食品中蛋白质的测定》,采用凯氏定氮自动分析仪测定;
蛋白酶酶解物制备过程如下:河蚬原料→按比例加水匀浆→酶解(酶解过程中两次调pH)→灭酶(沸水浴,10 min)→冷却→离心(8 000 r/min,20 min)→上清液过滤→酶解液浓缩→冻干→酶解物.
采用邻苯二甲醛(OPA)法测定各河蚬酶解物的水解度.400 μL 待测液加入3 mL OPA试剂中,室温下准确反应2 min,以去离子水调零后,于340 nm波长测定吸光值,以去离子水代替样品液作为对照,标准溶液为丝氨酸溶液(0.05 g/L).水解度(DH,%)计算式为
DH=h/htot×100%.
式中,h为蛋白水解后肽键的平均数,htot为每个蛋白分子的肽键总数.5种蛋白酶的酶解条件参数如表1所示.
1.3.2 酶解物抗氧化能力测定
(1)酶解物DPPH自由基清除率的测定
参考Luo等[7]的方法,并作适当修改.2 mL样品待测液和2 mL 95%乙醇混合后在测定波长的吸
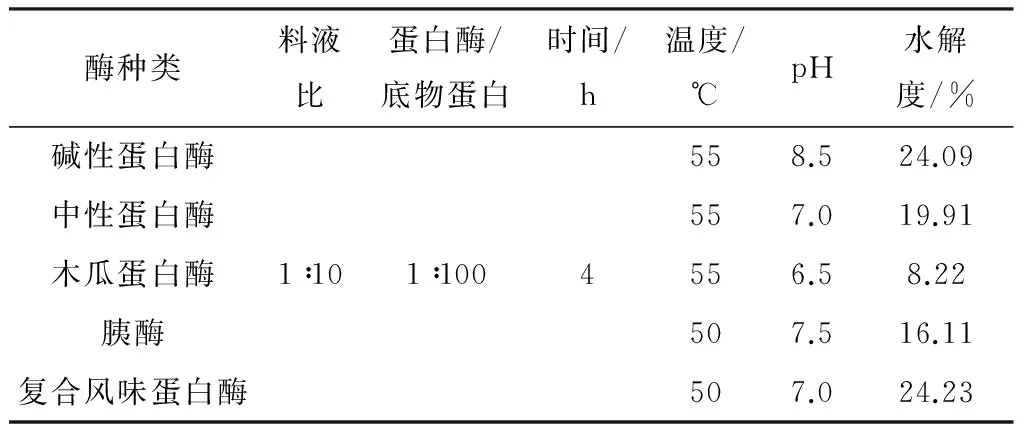
表1 5种蛋白酶的酶解条件参数Table 1 Hydrolysis conditions of 5 kinds of proteases
光值为Aj;在2 mL DPPH溶液(0.2 mmol/L)中加入2 mL 样品,在测定波长下的吸光值为Ai;对照样为2 mL DPPH溶液加2 mL 95%乙醇,在测定波长下的吸光值为Ac.将待测溶液避光放置30 min,在517 nm处测其对应吸光值,样品对DPPH的清除率R为
分别测定50、75、100、125、150 mg/L质量浓度下样品的DPPH自由基清除率,绘制曲线并利用方程计算不同样品DPPH自由基清除率为50%时所对应的样品的浓度,即为IC50值.
(2)酶解物氧化自由基吸收能力ORAC值测定
ORAC方法参照Huang等[8]的方法并略有改动.反应于75 mmol/L磷酸钾缓冲液(pH=7.4)环境中进行,具体操作如下:在96孔板各微孔中分别加入20 μL待测样品和Trolox标准液(6.25、12.5、25、50 μmol/L),每个孔加入200 μL的荧光素纳溶液(0.096 μmol/L),于37 ℃孵育20 min,迅速在各孔中加入20 μL AAPH溶液(119.4 μmol/L),在激发波长485 nm、发射波长538 nm下连续测定荧光强度,间隔2 min,测定90次.绘制Trolox标准曲线,并以Trolox当量来表示样品的ORAC值.
1.3.3 细胞培养
LO2细胞用含10%胎牛血清和1%双抗(青霉素、链霉素)的DMEM培养基培养,于37 ℃、5% CO2恒温培养箱培养,取对数生长期细胞进行实验.
1.3.4 乙醇诱导LO2细胞损伤模型的建立
(1)MTT法测定细胞存活率
取处于对数生长期的LO2细胞接种于96孔细胞板中,每孔5 000个细胞,置于CO2培养箱中培养24 h后,实验组加入乙醇浓度分别为0.4、0.6、0.8、1.0 mol/L的培养液,空白对照组加等量的培养液,每组设3个平行,放回培养箱继续培养24 h.每孔加20 μL MTT 溶液(5 g/L),于培养箱孵育4 h,弃上清,每孔加入150 μL 二甲基亚砜(DMSO),在490 nm波长下测各孔的吸光值D(490).计算不同浓度乙醇处理后各组细胞的存活率:

(2)ALT和AST酶活性检测
将处于对数生长期的LO2细胞按1×105个/孔的密度接种于24孔细胞板,置于CO2培养箱中培养24 h后,弃上清,实验组加入1 mL乙醇浓度分别为0.4、0.6、0.8、1.0 mol/L的培养液,空白对照组加等量的培养液,培养24 h.取培养液以10 000 r/min的速度离心10 min,取上清,按照ALT和AST检测试剂盒上方法测定各自的酶活性,单位用U/L表示.
1.3.5 酶解物的护肝活性
(1)MTT法评价酶解物的护肝活性
方法步骤同1.3.4节所述,实验组更换为不同酶解物,浓度梯度设为100、200、300、400、500 mg/L,分别计算各种酶解物在各个浓度下的细胞存活率.
酶解物的护肝活性评价:LO2细胞铺板步骤同上,铺板24 h后,实验组400 mg/L不同酶酶解物预孵育24 h,模型组加入等量的培养液孵育24 h,弃上清,实验组加入含有400 mg/L相对应的酶解物和0.8 mol/L 乙醇的培养液,模型组加入0.8 mol/L乙醇的培养液,继续培养24 h,空白对照组始终用培养液培养,分别计算各组的细胞存活率.
(2)ALT和AST酶活性检测
将LO2细胞按1×105个/孔的密度接种于24孔细胞板,接下来的步骤同本节(1)和1.3.4节中(2).
1.3.6 分子量分布测定
分子量分布测定采用GB/T22729—2008《海洋低聚肽》中的凝胶过滤色谱法.采用的分离柱为TSK Gel G2000 SWXL,流动相为45%(体积分数)的乙腈水溶液(含0.1%三氟乙酸),流速为0.5 mL/min,检测波长为214 nm.
1.3.7 氨基酸组成分析
采用A300自动氨基酸分析仪测定样品氨基酸组成.样品经6 mol/L 盐酸在110 ℃下水解后用HPLC进行分析.测定条件为:membraPureT259钠离子交换柱,反应器温度为115 ℃,流动相速度为160 μL/min,茚三酮溶液流速为80 μL/min,进样体积为20 μL,在570和440 nm处进行检测.
1.3.8 数据统计分析
2 结果与分析
2.1 河蚬不同酶解物的水解度
经计算得,河蚬干粉的蛋白质含量高达56.59%±0.50%.如表1所示,复合风味蛋白酶和碱性蛋白酶酶解河蚬所得酶解物的水解度最高,可分别达到24.23%和24.09%,而木瓜蛋白酶酶解河蚬所得酶解物的水解度最低,表明木瓜蛋白酶不适合酶解河蚬蛋白质.
2.2 河蚬不同酶解物的抗氧化能力
2.2.1 河蚬不同酶解物清除DPPH自由基的活性
DPPH·是一种稳定的氮自由基,由于本研究中采用无水乙醇作为溶剂,抗氧化剂与溶剂之间会产生氢键作用力,不利于氢原子的释放,因此实验中DPPH自由基清除反应是基于ET反应机制[9].经计算得碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、胰酶、复合风味蛋白酶酶解产物DPPH自由基的IC50分别是104.69±2.05、108.02±0.38、85.31±0.19、112.56±0.11、102.18±3.44 mg/L.同时由图1可以看出木瓜蛋白酶的酶解物的DPPH自由基清除能力显著性的强于其他酶解物(P<0.05).
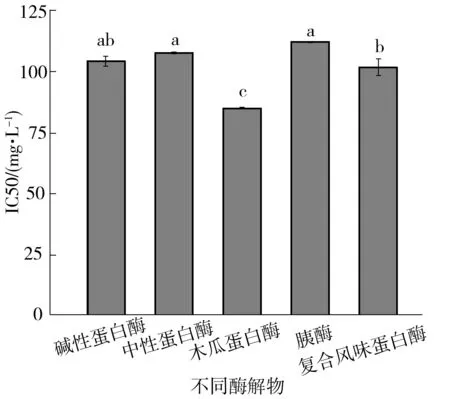
a、b、c表示存在显著性差异(P<0.05)
2.2.2 河蚬不同酶解物的ORAC值
ORAC方法原理是基于偶氮化合物AAPH在O2的作用下产生ROO·,而ROO·与荧光素钠作用生成没有荧光的物质,使总荧光强度减弱,通过延缓荧光强度衰减的能力评价抗氧化活性[10].国际上以Trolox为当量表示抗氧化剂的ORAC值,通过设置不同浓度的Trolox延缓荧光强度衰减,其标准曲线方程为:y=0.355 8x+1.803 1,r2=0.992 3.如图2所示,胰蛋白酶和复合风味蛋白酶酶解物的ORAC值显著高于其他三者(P<0.05),表明胰蛋白酶和复合风味蛋白酶酶解物清除过氧自由基的能力强于其他酶解物,且计算得胰蛋白酶和复合风味蛋白酶酶解物的ORAC值分别为(2.54±0.18)和(2.59±0.06) mmol Trolox/g.
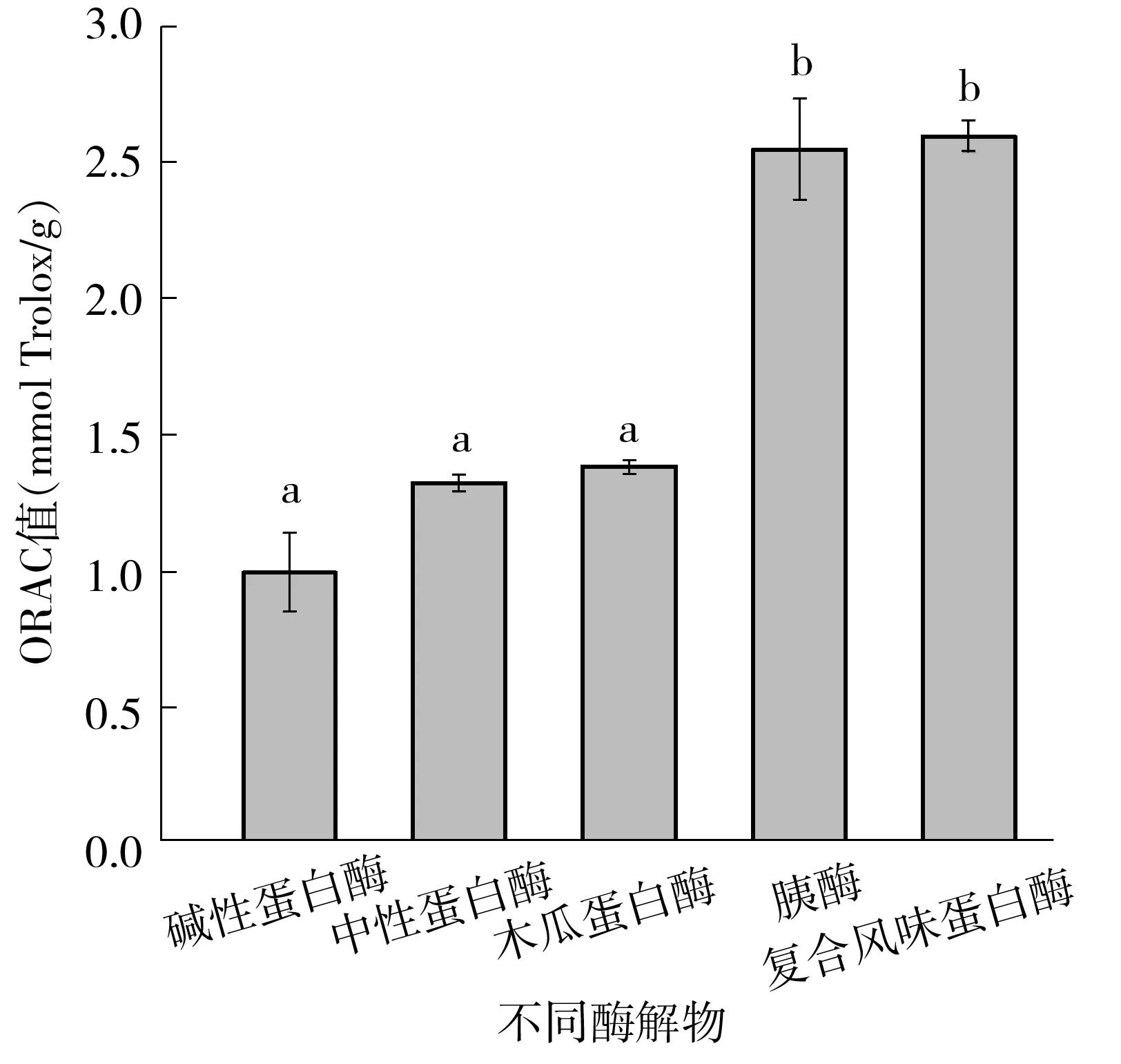
a、b、c表示存在显著性差异(P<0.05)
2.3 乙醇诱导LO2细胞损伤模型的建立
2.3.1 乙醇对LO2细胞的毒性作用
采用MTT法检测乙醇对LO2细胞的毒性作用,如图3所示,0.4 mol/L乙醇作用24 h后,细胞存活率已经出现显著性的降低,达到86%(P<0.05),而当乙醇浓度大于0.6 mol/L时,LO2细胞的存活率低于79%(P<0.01),且呈现出剂量效应.当乙醇浓度达到0.8 mol/L时,细胞存活率接近50%.
2.3.2 乙醇对LO2细胞中ALT和AST的影响
乙醇对肝毒性的体外实验可直接通过测量肝细胞转氨酶释放到培养基中的水平来完成[11].实验中用乙醇孵育LO2细胞,发现从细胞质释放到培养基中的ALT和AST量会随着乙醇浓度的增加而增加,这与其他人的研究结果相吻合[12].如表2所示,当乙醇的浓度增加到0.8 mol/L及以上时,培养液中的ALT和AST的活性显著高于空白组(P<0.01).由此可知,本实验的乙醇诱导LO2细胞损伤模型建立成功,并选择0.8 mol/L为模型中乙醇的浓度.
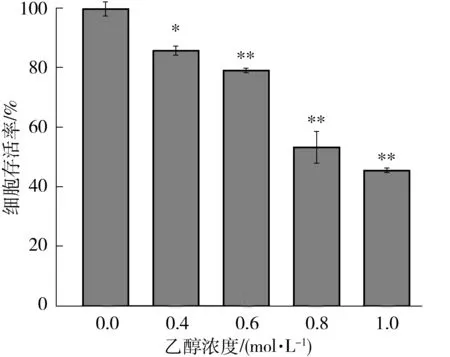
相对于空白对照组,*—P<0.05,**—P<0.01
Fig.3 Viability of LO2 cells treated with different EtOH concentrations
表2 乙醇对LO2细胞中ALT和AST的影响1)
Table 2 Effects of EtOH on ALT and AST contents in LO2 cells

乙醇浓度/(mol·L-1)ALT酶活/(U·L-1)AST酶活/(U·L-1)0.013.21±1.0711.84±2.460.415.77±1.4719.63±0.400.623.86±2.37*19.95±2.040.844.25±0.69**39.40±0.69**1.045.91±3.05**51.16±1.28**
1)相对于空白对照组,*—P<0.05,**—P<0.01.
2.4 河蚬酶解物对LO2细胞的增殖影响
采用MTT法研究河蚬酶解物对LO2细胞生长增殖的影响,结果如表3所示,其中碱性蛋白酶、中性蛋白酶、木瓜蛋白酶和胰酶的河蚬酶解物在各个浓度下的细胞存活率与空白组相比没有显著性差异,说明对LO2细胞的增殖没有影响.而复合风味蛋白酶的河蚬酶解物在质量浓度为100和200 mg/L时,细胞存活率显著性高于空白对照组(P<0.05),这是因为该酶解物中的一些多肽作为营养物质被细胞吸收,从而促进了LO2细胞的增殖.体外多肽促进细胞增殖已有文献报道[13].
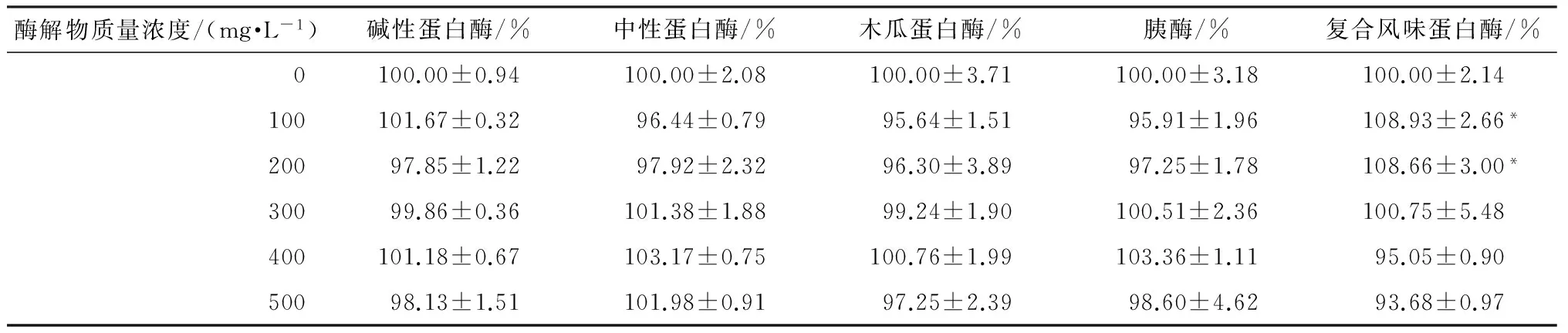
表3 不同质量浓度(100~500 mg/L)酶解物对LO2细胞增殖的影响1)Table 3 Effect of the different mass concentrations(100~500 mg/L) of hydrolysates on proliferation of LO2 cells
1)相对于空白对照组,*—P<0.05.
2.5 河蚬酶解物对乙醇致LO2细胞毒性的影响
研究河蚬酶解物的护肝活性,MTT实验的结果如图4所示,乙醇组细胞的存活率显著低于空白组(P<0.05),而河蚬酶解物组的细胞存活率比乙醇组显著增加(P<0.05),说明河蚬酶解物抑制了乙醇对LO2细胞的毒性作用,而其中胰酶和复合风味蛋白酶的酶解物组的细胞存活率也显著高于其他酶解物组(P<0.05),证明两者缓解乙醇致LO2细胞损伤的能力强,护肝活性好,而这结果与各酶解物的ORAC活性强弱一致.乙醇在体内代谢过程中会产生大量的包括O2·-在内的ROS,其中CYP2E1催化乙醇代谢为乙醛和乙醛的进一步代谢过程是产生O2·-的主要来源,这些自由基可造成DNA损伤、蛋白质变性、增加细胞膜的脂质过氧化和破坏细胞内氧化平衡等危害,引起氧化应激,最终导致细胞凋亡,酶解物通过清除的自由基,平衡细胞内的氧化与抗氧化体系,进而保护细胞免受损伤.而ORAC实验的实质也是清除过氧自由基,故在理论上解释了两者的实验结果一致性.

相对于空白对照组,*—P<0.05;相对于乙醇组,#&—P<0.05
Fig.4 Effect of different hydrolysates on ethanol-induced LO2 cytotoxicity
2.6 河蚬胰酶和复合风味蛋白酶酶解物对乙醇诱导LO2细胞ALT和AST的影响
ALT和AST作为评价对酒精性肝损伤保护作用的一项指标已经有研究报道[14].实验中选用两个对乙醇致LO2细胞损伤保护作用好的酶解物,即胰酶和复合风味蛋白酶酶解物,实验结果如图5所示,由于乙醇对LO2细胞的损伤作用,与空白组相比,乙醇组的LO2细胞向培养液中释放ALT和AST的显著性增加,而经过酶解物预孵育后,样品组培养液中的ALT和AST活性显著低于乙醇组,说明两者均可抑制乙醇导致LO2细胞中ALT和AST的释放,减缓乙醇对LO2细胞的损伤,进一步证明河蚬经胰酶和复合风味蛋白酶酶解所得的酶解物具有很好的护肝作用.
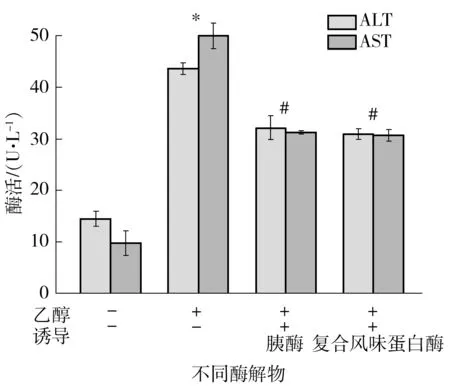
相对于空白对照组,*—P<0.05;相对于乙醇组,#—P<0.05
Fig.5 Effect of hydrolysates on the ALT and AST activity in EtOH-induced LO2 cells
2.7 河蚬胰酶和复合风味蛋白酶酶解物的分子量分布
由表4可得河蚬胰酶和复合风味蛋白酶酶解物分子量小于1 000 u的占大部分,其中复合风味蛋白酶的占比高达86.93%,这是由于复合风味蛋白酶是外切酶,从肽链末端酶切,并且此结果与复合风味蛋白酶酶解物的较高水解度相符.
表4 河蚬胰酶和复合风味蛋白酶酶解物的分子量分布
Table 4 Relative molecular weight distribution of Pancreatin and Flavourzyme hydrolysates ofCorbiculafluminea

分子量/u不同酶解物的占比/%胰酶复合风味蛋白酶>300036.513.553000~100010.129.51<100053.3786.93
2.8 河蚬胰酶和复合风味蛋白酶酶解物的氨基酸组成
上述实验表明,河蚬由胰酶和复合风味蛋白酶酶解所得酶解物中的活性肽的抗氧化活性和保护酒精性肝损伤活性优于其他,故对两者进行氨基酸分析.研究表明[15]氨基酸的组成和序列极大地影响着活性肽的活性,且多种氨基酸及其衍生物具有抗氧化能力,组氨酸、半胱氨酸、酪氨酸等可以螯合金属离子,本身就具有抗氧化活性;丙氨酸、缬氨酸、亮氨酸等疏水性氨基酸的分子结构与表面活性剂类似,具有抑制脂质过氧化的能力;酸性氨基酸即天冬氨酸和谷氨酸,其侧链羧基具有螯合金属离子的能力.由表5可知,河蚬由胰酶和复合风味蛋白酶酶解所得酶解物活性肽中,具有抗氧化能力的氨基酸含量分别是50.253%、49.008%,各占到总氨基酸含量的75.69%、75.06%,由此也证明河蚬经胰酶和复合风味蛋白酶酶解所得酶解物中的活性肽具备良好的抗氧化活性.
表5 河蚬胰酶和复合风味蛋白酶酶解物的氨基酸组成
Table 5 Amino acid composition of pancreatin and flavourzyme hydrolysates ofCorbiculafluminea

氨基酸名称氨基酸含量1)/%胰酶复合风味蛋白酶天冬氨酸8.1947.852苏氨酸3.5253.422丝氨酸3.6033.511谷氨酸11.01011.032甘氨酸3.4183.452丙氨酸3.8713.927半胱氨酸1.0531.092缬氨酸3.5913.534蛋氨酸1.1581.295异亮氨酸2.8262.768亮氨酸4.8674.442酪氨酸3.6093.484苯丙氨酸3.3913.073组氨酸2.1782.043赖氨酸4.1364.171精氨酸3.7183.883脯氨酸2.2452.311酸性氨基酸19.20518.883抗氧化氨基酸10.2319.692疏水性氨基酸20.81720.433对抗氧化有贡献的氨基酸50.25349.008
1)质量分数.
3 结论
文中通过实验研究了河蚬酶解物对乙醇致LO2细胞损伤的保护作用,结果发现河蚬不同酶解物均具备一定的DPPH自由基清除能力,且木瓜蛋白酶酶解河蚬所得酶解物的清除能力最强,而胰酶和复合风味蛋白酶酶解物的ORAC值显著高于其他酶解产物.乙醇诱导LO2细胞损伤,导致其细胞存活率显著降低,并使得ALT和AST释放到细胞外.MTT实验表明,在300和400 mg/L的质量浓度下酶解物对细胞的增值无显著性差异.酶解物预孵育可降低乙醇对LO2细胞的毒性,提高细胞存活率,其中胰酶和复合风味蛋白酶酶解河蚬所得酶解物的效果最好,同时二者均可抑制乙醇导致的LO2细胞中ALT和AST的释放,证明二者可保护受到乙醇损伤的LO2细胞.氨基酸组成分析显示河蚬经胰酶和复合风味蛋白酶酶解所得活性肽中,对抗氧化有贡献的氨基酸分别占总氨基酸量的75.69%、75.06%.文中结论为开发河蚬护肝产品提供了理论支撑.
参考文献:
[1] BYUN J S,SUH Y G,YI H S,et al.Activation of toll-like receptor 3 attenuates alcoholic liver injury by stimulating Kupffer cells and stellate cells to produce interleukin-10 in mice [J].Journal of Hepatology,2013,58(2):342- 349.
[2] SILVA P,FERNANDES E,CARVALHO F.Dual effect of red wine on liver redox status:a concise and mechanistic review [J].Archives of Toxicology,2015,89(10):1681- 1693.
[3] DONOHUE Jr T M,THOMES P G.Ethanol-induced oxidant stress modulates hepatic autophagy and proteasome activity [J].Redox Biology,2014,3:29- 39.
[4] 杨玉娈,袁美兰,陈丽丽,等.河蚬中水溶性蛋白的提取及其抗氧化性质 [J].食品科学,2015(6):96- 102.
YANG Yu-nan,YUAN Mei-lan,CHEN Li-li,et al.Water-soluble proteins from Corbicula fluminea:optimization of ultrasound-assisted extraction process by response surface analysis and antioxidant potential [J].Chinese Food Science,2015(6):96- 102.
[5] LIAO N,CHEN S,YE X,et al.Antioxidant and anti-tumor activity of a polysaccharide from freshwater clam,CorbiculaFluminea[J].Food & Function,2013,4(4):539- 548.
[6] CHIJIMATSU T,UMEKI M,KATAOKA Y,et al.Lipid components prepared from aCorbiculaflumineaextract ameliorate hypercholesterolaemia in rats fed high-cholesterol diet [J].Food Chemistry,2013,136(2):328- 334.
[7] LUO W,ZHAO M,YANG B,et al.Identification of bioactive compounds inPhyllenthusemblicaL.fruit and their free radical scavenging activities [J].Food Chemistry,2009,114(2):499- 504.
[8] HUANG D,OU B,HAMPSCH-WOODILL M,et al.High-throughput assay of oxygen radical absorbance capacity(ORAC) using a multichannel liquid handling system coupled with a microplate fluorescence reader in 96-well format [J].Journal of Agricultural and Food Chemistry,2002,50(16):4437- 4444.
[9] NIKI E.Assessment of antioxidant capacity in vitro and in vivo [J].Free Radical Biology and Medicine,2010,49(4):503- 515.
[10] PEZ-ALARC L N C,DENICOLA A.Evaluating the antioxidant capacity of natural products:A review on chemical and cellular-based assays [J].Analytica Chimica Acta,2013,763:1- 10.
[11] DAMBACH D M,ANDREWS B A,MOULIN F.New technologies and screening strategies for hepatotoxicity:use of in vitro models [J].Toxicologic Pathology,2005,33(1):17- 26.
[12] SHE X,WANG F,MA J,et al.In vitro antioxidant and protective effects of corn peptides on ethanol-induced damage in HepG2 cells [J].Food and Agricultural Immunology,2016,27(1):99- 110.
[13] REDDI S,SHANMUGAM V P,KAPILA S,et al.Identification of buffalo casein-derived bioactive peptides with osteoblast proliferation activity [J].European Food Research and Technology,2016,242(12):2139- 2146.
[14] DING R B,TIAN K,CAO Y W,et al.Protective effect of panax notoginseng saponins on acute ethanol-induced liver injury is associated with ameliorating hepatic lipid accumulation and reducing ethanol-mediated oxidative stress [J].Journal of Agricultural and Food Chemistry,2015,63(9):2413- 2422.
[15] JE J Y,QIAN Z J,KIM S K.Antioxidant peptide isolated from muscle protein of bullfrog,Rana catesbeiana Shaw [J].Journal of Medicinal Food,2007,10(3):401- 407.

