基于蛋白激酶B/雷帕霉素靶蛋白通路观察化浊解毒方对胃癌前病变大鼠肿瘤血管新生机制的影响※
袁美杰 邵晨曦 杜玉青 张亚男 高绍芳
(河北中医学院中西医结合学院2013级中西医临床医学2班,河北 石家庄 050200)
实 验 研 究
基于蛋白激酶B/雷帕霉素靶蛋白通路观察化浊解毒方对胃癌前病变大鼠肿瘤血管新生机制的影响※
袁美杰 邵晨曦 杜玉青 张亚男 高绍芳△
(河北中医学院中西医结合学院2013级中西医临床医学2班,河北 石家庄 050200)
目的 基于胃黏膜组织蛋白激酶B/雷帕霉素靶蛋白(AKT/mTOR)通路观察化浊解毒方对胃癌前病变(PLGC)大鼠肿瘤血管新生机制的影响。方法 将48只雄性SD大鼠按随机分组法分为正常组、模型组、维甲酸组、化浊解毒组,每组12只。采用胃癌前病变模型的建立法复制PLGC模型成功后,模型组、正常组给予0.9%氯化钠注射液10 mL/kg,维甲酸组予维甲酸药液40 mg/kg、化浊解毒组予化浊解毒方水煎液10 g/kg,均每日1次灌服,连续16周。采用免疫组织化学法,检测化浊解毒方对PLGC大鼠胃黏膜组织AKT、mTOR的影响。结果 给药16周后,模型组AKT、mTOR表达高于正常组,比较差异有统计学意义(P<0.05);与模型组比较,化浊解毒组、维甲酸组AKT、mTOR的表达均有不同程度下降,比较差异有统计学意义(P<0.05);化浊解毒组与维甲酸组比较,AKT、mTOR表达明显降低,比较差异有统计学意义(P<0.05)。结论 化浊解毒方可能是通过降低AKT、mTOR的表达,从而调控AKT/mTOR通路,达到抗肿瘤血管新生以逆转PLGC的治疗效果。
癌前状态;胃肿瘤;新生血管化;病理性;蛋白质丝氨酸苏氨酸激酶;解毒;中医药疗法
胃癌前病变(precancerous lesions of gastric cancer,PLGC)是指萎缩性胃炎并伴有肠上皮化生和(或)不典型增生[1]。在慢性浅表性胃炎→慢性萎缩性胃炎→肠上皮化生→不典型增生→胃癌的转化过程中,由正常胃黏膜向胃癌进展的一个重要环节就是PLGC。所以,逆转和阻断PLGC的进展,对减少胃癌的发生有重要意义。目前,西医仍然没有公认的、疗效确切的针对PLGC的治疗方法,而近年来中医药对PLGC的防治取得了显著成效。李佃贵教授“化浊解毒法”能刺激胃黏膜分泌功能[2],改善胃液成分[3],治疗PLGC取得了满意的临床疗效。
新生血管形成是肿瘤发生、发展和转移的重要环节[4],蛋白激酶B(protein kinase B,AKT)、雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)在肿瘤中过度表达,与肿瘤血管新生密切相关。AKT/mTOR信号转导通路的活化可通过多条途径上调低氧诱导因子1α (HIF-1α)的表达,启动血管内皮生长因子(VEGF)基因的转录,促进VEGF表达,迁移内皮细胞后,形成新生血管,从而增加肿瘤细胞的血供[5],引发肿瘤。以往研究显示,化浊解毒方可通过抑制癌基因的激活和抑制基因的失活,降低HIF-1α和VEGF的表达而抑制新生血管生成[6]。为进一步探讨化浊解毒方对PLGC肿瘤血管新生的作用机制,本研究采用免疫组织化学法,观察化浊解毒方对PLGC大鼠AKT、mTOR的影响,结果如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 48只雄性SD健康大鼠,体质量(130±10)g,购自河北医科大学动物实验中心,动物许可证号:SCXK(冀)2013-1-003,合格证号:1508014。以常规饲料喂养。
1.1.2 实验药物 化浊解毒方药物组成:藿香15 g,白花蛇舌草15 g,黄连15 g,半枝莲15 g,半边莲15 g,佩兰15 g,茵陈15 g,苦参15 g,全蝎9 g,瓜蒌15 g,清半夏10 g。以上药材均购自河北省中医院中药房,由河北中医学院制剂室制成含量2.35 g生药/mL的药液,质量控制通过制剂室严格把关;维A酸片(山东良福制药有限公司,国药准字H20083494,批号:150302,规格:10 mg/片)。
1.1.3 实验试剂 AKT抗体,Santa Cruz(圣克鲁斯),sc-8312;mTOR抗体,Santa Cruz,sc-8319;免疫组化试剂盒,VECTOR LABORATORIES,INC(矢量实验室公司,PK-4001);3,3'-二氨基联苯胺盐酸盐,北京中杉金桥生物技术有限公司(ZLI-9108)。
1.1.4 实验仪器 MG5513S微波炉(LG集团);YHW-1101S电热鼓风干燥箱(天津市泰斯特仪器有限公司);WD-9405A脱色摇床(北京市六一仪器厂);DP73数码显微镜,Olympus(奥林巴斯);HMIAS-2000显微图像分析系统(武汉同济医科大学)。
1.2 实验方法
1.2.1 动物分组 48只雄性SD大鼠常规饲养1周后,按随机分组法分为模型组、正常组、维甲酸组、化浊解毒组,每组各12只。
1.2.2 造模方法 除正常组以外,其他3组均参照李春英等[7]方法建立PLGC大鼠模型,将马兜铃酸Ⅰ(AAⅠ)以5 mg/kg剂量隔日8:00灌胃,同时进食2 d、禁食1 d,并于每日夹鼠尾1 h,对其进行情志刺激,持续10周后,每组随机抽取2只大鼠,确认实验动物成功造模后进行给药。
1.2.3 给药方法 模型组及正常组大鼠给予0.9%氯化钠注射液10 mL/kg灌服,每日1次,连续16周;维甲酸组予维甲酸药液40 mg/kg、化浊解毒组予化浊解毒方水煎液10 g/kg灌服(相当于成人每日用量,每次2 mL),每日1次,连续16周。
1.3 观察指标及方法
1.3.1 大鼠一般情况 密切监测实验期间各组大鼠的摄食量、体质量、活动情况、情绪状态、毛发的光泽和蓬松程度及大便等一般情况。
1.3.2 胃黏膜组织病理学观察 给药16周后处死各组大鼠,剖腹取胃,沿胃大弯剪开,肉眼观察;使用200 ℃干烤的器械于手术台上于胃窦部切取1.5 cm×1.0 cm胃黏膜组织,10%甲醛固定48 h,脱水、包埋、切片,常规苏木精-伊红(HE)染色,光镜(100倍)下观察胃黏膜组织病理变化。
1.3.3 免疫组织化学法检测AKT、mTOR 石蜡切片常规脱蜡至水,采用柠檬酸缓冲液热抗原修复20 min,磷酸缓冲盐溶液(PBS)洗3 min×3次;80%甲醇3%双氧水浸泡20 min以阻断内源性过氧化物酶,PBS洗3 min×3次;5%牛血清白蛋白封闭20 min;弃封闭液,不用洗,加各自稀释一抗(AKT 1∶100,mTOR 1∶75),4 ℃过夜,PBS洗3 min×3次;加对应的生物素标记二抗(1∶200稀释),37 ℃ 30 min,PBS洗3 min×3次;加亲和素―生物素―过氧化物酶复合物(ABC)反应试剂,37 ℃ 30 min,PBS洗3 min×3次;二氨基联苯胺(DAB)法显色,苏木精复染,盐酸酒精分化,脱水,透明,封片。每个指标每组内每张切片随机挑选至少3个200倍视野进行拍照。应用HMIAS-2000显微图像分析系统,选取相同的棕黄色作为判断所有照片阳性的统一标准,对每张照片进行分析得出每张照片阳性的平均光度值。
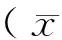
2 结 果
2.1 大鼠一般情况 实验过程中,正常组大鼠始终形体较肥胖,食量较多,活动灵敏,被毛光泽,大便正常;模型组大鼠形体消瘦,活动减少,被毛无光泽,食量下降,大便稀溏;维甲酸组大鼠食欲较模型组好,体质量稍增加,但毛发缺少光泽,大便偏稀;化浊解毒组大鼠活动增加,食量增大,体质量上升快,大便正常,较模型组、维甲酸组一般情况大大好转。
2.2 4组大鼠胃黏膜组织病理观察结果 正常组大鼠胃黏膜厚度正常,上皮细胞排列整齐,腺体大小形态规则,胞浆透明,黏膜肌层未见增生。模型组大鼠胃黏膜腺体大小不等,黏膜变薄,间质内有炎性细胞浸润,淋巴滤泡形成,可见杯状细胞以及上皮不同程度的异型增生。维甲酸组大鼠胃黏膜上皮排列不规整,黏膜层仍有较多炎性细胞浸润,固有腺体保持完整,肠上皮化生和异型增生发生较模型组轻。化浊解毒组大鼠胃黏膜上皮排列整齐,腺体大小、形态一致,无明显变性、坏死,仍有少量炎性细胞浸润,表现为轻度浅表性胃炎或接近正常胃黏膜。见图1。

A为正常组,B为模型组,C为维甲酸组,D为化浊解毒组图1 4组大鼠胃黏膜组织病理观察结果(HE,×100)
2.3 4组大鼠胃黏膜AKT、mTOR平均光度值比较 见表1。
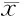
表1 4组大鼠胃黏膜AKT、mTOR 平均光度值比较 ±s
与正常组比较,*P<0.05;与模型组比较,△P<0.05,与维甲酸组比较,#P<0.05
由表1可见,模型组AKT、mTOR平均光度值均较正常组增高,比较差异有统计学意义(P<0.05);与模型组比较,化浊解毒组、维甲酸组AKT、mTOR的平均光度值均有不同程度降低,比较差异有统计学意义(P<0.05);与维甲酸组比较,化浊解毒组AKT、mTOR的平均光度值均明显降低,比较差异有统计学意义(P<0.05)。
3 讨 论
PLGC是胃癌发生发展的重要阶段。肿瘤血管新生是肿瘤生成的重要因素,直接调控着肿瘤的生长、侵袭和转移等病理过程。丰富的血管生成可持续不断地向肿瘤提供营养和清除代谢产物,为其生长及浸润、转移创造条件[3]。肿瘤血管生成的主要机制主要涉及内皮细胞移行通道形成及内皮细胞的迁移增殖。AKT、mTOR表达增高在喉癌[8]、乳腺癌[9]等多种肿瘤中均有报道。AKT/mTOR是肿瘤血管新生的经典信号通路,AKT、mTOR因子在整个信号调节网络中扮演着极其重要的角色[10]。该信号通路通过多种途径被激活后,可通过上调HIF-1α的表达,启动VEGF基因的转录,促进VEGF表达,使内皮细胞活化后,形成新生血管,活化内皮型一氧化氮合酶(eNOS),促进新生血管形成;可激活核转录因子B(NF-B),导致血管生成因子的表达增加;活化的AKT引起IκB磷酸化,使NF-B水平提高以上调VEGF,使内皮细胞迁移形成新生血管[11]。王霞[12]研究表明,在PLGC的进展过程中AKT、mTOR的阳性表达率呈递增现象,认为随着胃癌的恶变AKT、mTOR的表达也增强,进而认为AKT/mTOR信号通路可能与胃癌的恶化有相关性。
中医学将PLGC归于胃痞、胃痛、痞满、嘈杂等范畴。临床主要表现为上腹胀满不适、隐痛、嗳气、反酸、食欲不振等症状,舌黯红或紫黯,苔薄黄腻或黄厚腻,脉弦滑或弦滑细。关于其病因病机,邓铁涛教授认为PLGC实为本虚标实的虚损病[13]。黄珏[14]探讨了幽门螺旋杆菌感染与PLGC的关系。而李佃贵教授依据浊毒理论认为,素体亏虚,脾胃虚弱,后天之本生化不足,胃失所养,浊毒之邪瘀滞中焦为其病机关键。忧思郁怒,肝失疏泄,气机郁滞,木旺克土,脾气虚弱,湿邪黏滞,渐化成浊,浊气郁内,渐成为热,热邪壅盛,化为毒邪,浊毒之邪深伏胃脉血分,是导致PLGC的病理结果。病位在脾胃,涉及肝、胆、肾等多脏腑。化浊解毒方以化浊解毒为主,和胃健脾为辅,疏肝健脾,活血止痛,使肝气条达,脾胃健运而使浊邪得化,毒邪祛除,胃络畅通,瘀化血活,疗效明显。方中藿香、佩兰、茵陈芳香化湿,理气和胃;瓜蒌、清半夏燥湿化痰,降逆止呕;黄连、苦参苦燥泻降,清热解毒;白花蛇舌草、半枝莲、半边莲清热利湿,消痞散结;全蝎祛风止痉,解毒通络。诸药配伍,相辅相成,正本清源,标本同治,恢复脾气运化升清、胃气和降之功,使湿浊之气排出体外。现代药理研究表明,黄连可杀灭幽门螺杆菌,具有抗癌、抗溃疡等作用,同时黄连中的黄连碱有很强的胃黏膜保护作用[15];全蝎粗提物既对癌细胞有直接杀伤作用,又能增强胸腺功能,既使停止使用在一定时间内仍可减缓肿瘤的生长速度[16];白花蛇舌草总黄酮对BGC-823胃癌细胞的生长增殖有明显抑制作用[17]。
本研究结果显示,与正常组相比较,模型组AKT、mTOR的表达显著增强,推测AKT、mTOR在PLGC中呈高表达。与模型组和维甲酸组比较,化浊解毒组AKT、mTOR的表达显著下降,胃黏膜病理表现为轻度浅表性胃炎或接近正常胃黏膜。推测化浊解毒方能降低胃黏膜病变组织AKT、mTOR的表达,抑制AKT/mTOR通路的激活,减少肿瘤血管新生,进而减缓甚至阻断PLGC,减少进一步恶化的危险。化浊解毒方防治PLGC肿瘤血管新生的机制有待于进行更加深入的研究。
[1] 姜宁,黄宣,范一宏,等.中西医结合治疗胃癌前病变疗效的系统评价[J].中华中医药学刊,2015,33(1):149-154.
[2] 张金丽,王彦刚,周盼盼,等.化浊解毒和胃方对慢性萎缩性胃炎癌前病变患者胃液成分的影响[J].中医杂志,2014,55(5):400-403.
[3] 孟宪鑫.基于浊毒学说应用化浊解毒方治疗慢性萎缩性胃炎癌前期病变的临床疗效观察及机制探讨[D].石家庄:河北医科大学,2014.
[4] 吴禹锟,许美年,敖春萍,等.PI3K/Akt/mTOR信号通路与前列腺癌关系的研究进展[J].国际泌尿系统杂志,2016,36(1):22-26.
[5] 张慧.HHV-8感染与PI3K/Akt/mTOR信号转导通路研究进展[J].医学综述,2009,15(10):1441-1444.
[6] 高绍芳,王彦刚,李佃贵,等.化浊解毒和胃方对胃癌前病变大鼠血管生成机制的影响[J].中国中西医结合杂志,2013,33(11):1515-1519.
[7] 李春英,梁爱华,高双荣,等.大鼠胃癌前病变模型的建立[J].中国中药杂志,2012,37(1):89-93.
[8] 贾涛,雷文斌,苏振忠,等.AKT/mTOR信号通路在喉癌组织中的表达及意义[J].中山大学学报:医学科学版,2009,30(1):35-38,42.
[9] 廖明娟,陈红风.PI3K/Akt/mTOR信号通路抑制剂在乳腺癌中的研究进展[J].中华肿瘤防治杂志,2012,19(3):230-234.
[10] 张蕾蕾.Zeylenone通过抑制PI3K/AKT/mTOR和ERK/MAPK信号通路诱导宫颈癌细胞凋亡的分子机制研究[D].北京:北京协和医学院,2015.
[11] 张丹丹,李庆林.PI3K/Akt/mTOR信号通路与肿瘤[J].安徽医药,2012,16(3):281-283.
[12] 王霞.猫人参醇提取物对胃癌前病变大鼠干预的机制研究[D].南京:南京中医药大学,2014.
[13] 邓光中.邓铁涛教授临证中脾胃学说的运用(一)[J].新中医,2000,32(2):13-15.[14] 黄珏.幽门螺杆菌感染与胃癌前病变的关系[J].
医学综述,2012,18(11):1661-1663.
[15] 张瑞芬,苏和.黄连的药理研究进展[J].内蒙古中医药,2010,24(3):114-117.
[16] 张敏,张永清.全蝎抗肿瘤药理研究进展[J].药学研究,2003,22(1):36-39.
[17] 王秋兰,高晓民,张煦.白花蛇舌草总黄酮对BGC-823胃癌细胞增殖和凋亡的影响[J].现代中西医结合杂志,201,24(21):2289-2292.
(本文编辑:曹志娟)
Influence of Eliminate turbid fluid and remove toxic formula on tumor neovascularization in PLGC rats based on AKT /mTOR pathway
YUANMeijie,SHAOChenxi,DUYuqing,etal.
TraditionalChineseMedicineIntegratedwithWesternMedicineClass2of2013,InstituteofTraditionalChineseandWesternMedicine,HebeiUniversityofChineseMedicine,Hebei,Shijiazhuang050200
Objective observe the influence of Eliminate turbid fluid and remove toxic formula on tumor neovascularization in precancerous lesions of gastric cancer (PLGC) rats based on AKT /mTOR pathway. Methods 48 male PLGC rats were randomly divided into normal group, model group, retinoic acid remedy group and Eliminate turbid fluid and remove toxic formula group, 12 rats in each group. PLGC model was duplicated by the method of establishment of precancerous lesions of gastric cancer rats. After modeling, the model and normal groups were given 0.9% sodium chloride injection 10 mL/kg, the retinoic acid remedy group received retinoic acid 40 mg/kg, and the Eliminate turbid fluid and remove toxic formula group received Eliminate turbid fluid and remove toxic formula decoction 10 g/kg, successive perfusion 1 time per day for 16 weeks. The protein kinase B (AKT) and mammalian target of rapamycin (mTOR) of PLGC rats' gastric mucosa was observed by immunohistochemical assay. Results After 16 weeks administration, the expressions of AKT and mTOR in model group were higher than those in normal group, with statistical differences (P<0.05).As compared with model group, the expressions of AKT and mTOR in Eliminate turbid fluid and remove toxic group and retinotic acid remedy group were decreased in varying degree,with statistical differences (P<0.05). The expressions of AKT and mTOR in Eliminate turbid fluid and remove toxic formula group were obviously lower than retinoic acid remedy group, with statistical differences (P<0.05). Conclusion Eliminate turbid fluid and remove toxic formula can reverse PLGC through down-regulate expression of AKT and mTOR, regulating the AKT/mTOR pathway and resisting tumor neovascularization.
Precancerous state; Stomach neoplasm; Neovascularization; Pathologic; Protein-serine-threonine kinases; Detoxify; Traditional Chinese medicine therapy
10.3969/j.issn.1002-2619.2017.02.025
※ 项目来源:2015年河北省大学生创新创业训练计划项目(编号:201514432029)
袁美杰(1994—),女,本科在读。研究方向:中西医结合临床消化内科。
R-332;R287;R730.21;R735.205.31;R977.3
A
1002-2619(2017)02-0260-05
2016-10-09)
△ 通讯作者:河北中医学院中西医结合儿科教研室,河北 石家庄 050200

