Yap1对少突胶质细胞发育调控的研究
易 敏, 杜君卿, 黄 浩, 扈雪梅, 邱猛生,
(1. 杭州师范大学生命科学研究院,浙江 杭州 310036; 2. 路易斯维尔大学神经生物学与解剖学系,美国 路易斯维尔 40292)
Yap1对少突胶质细胞发育调控的研究
易 敏1, 杜君卿1, 黄 浩1, 扈雪梅2, 邱猛生1,2
(1. 杭州师范大学生命科学研究院,浙江 杭州 310036; 2. 路易斯维尔大学神经生物学与解剖学系,美国 路易斯维尔 40292)
少突胶质细胞在中枢神经系统中负责围绕神经元轴突形成髓鞘来加快神经冲动的传导.Yap1作为Hippo信号通路的下游关键因子之一,参与众多器官和细胞的发育过程.为探究Yap1介导的Hippo信号通路是否参与少突胶质细胞的发育,在小鼠的少突胶质细胞中条件性敲除Yap1基因,并通过原位杂交、免疫荧光等方法检测了突变小鼠少突胶质细胞的发育情况.结果发现,缺失Yap1基因的少突胶质细胞的发育不受影响,说明Yap1基因并不是少突胶质细胞发育的必需基因.
Yap1;Hippo;中枢神经系统;少突胶质细胞
0 引言
在脊椎动物中枢神经系统(Centralnervous system, CNS)中,少突胶质细胞(Oligodendrocytes, OLs)主要负责缠绕神经元轴突形成髓鞘并几十倍地加快神经冲动沿轴突的传导速度,并具有为神经元的轴突提供营养物质的作用[1-3].各种原因的少突胶质细胞的发育异常或损伤会引起严重的神经系统疾病如先天性脑白质营养不良、多发性硬化症等[4-5],甚至导致个体死亡.少突胶质细胞的发育经历几个不同的阶段,包括由神经前体细胞产生少突胶质细胞前体细胞(Oligodendrocyte progenitor cells, OPCs)、OPCs增殖并迁移、OPCs分化成成熟的少突胶质细胞并形成缠绕轴突的髓鞘.这些过程受到严格的发育调控,任何一个步骤的异常都会导致最终髓鞘形成的异常[6].
Hippo信号通路由于参与调控器官的大小而被熟知[7-8],其参与调控多种细胞生物学过程,包括细胞极性、细胞分化和死亡、肿瘤发生等[9-12].Yap1(Yes-associated protein 1)是Hippo信号通路关键细胞因子之一[11],该基因突变的小鼠在胚胎期第10天(E10)左右就死亡[13].已有的研究表明Yap1广泛参与多种器官或组织的发育,包括皮肤[14]、肾脏[15-16]、肺[17]、骨骼肌[18]、胰腺[19]、生殖腺[20]、眼[21]、神经系统[22-23]、心脏[24]、小肠[25]等,并参与调控三维体型的形成[26].少突胶质细胞的发育包括产生、增殖、迁移、分化、髓鞘化等一系列被严格调控的过程,Yap1是否在这一过程中起作用还不清楚.本研究在少突胶质细胞中条件性敲除Yap1基因,发现Yap1基因的缺失并不对少突胶质细胞的发育造成明显的影响.
1 材料和方法
1.1 动物
本研究中小鼠的饲养和使用参照《杭州师范大学实验动物管理办法》,受杭州师范大学动物管理委员会的监督.Olig1-Cre小鼠由Lu等[27]赠送.Yap1-flox条件性基因敲除小鼠由LI Qiutang(Departments of Ophthalmology and Visual Sciences, School of Medicine, University of Louisville, USA)赠送.在少突胶质细胞中敲除Yap1基因的突变小鼠(基因型为Olig1+/Cre,Yap1flox/flox)由基因型为Olig1+/Cre,Yap1+/flox和Yap1flox/flox的小鼠交配获得.
1.2 原位杂交
不同时期的小鼠经4%PFA灌注固定,在4 ℃的4%PFA中固定过夜,再用20%蔗糖4 ℃处理过夜,包埋到OCT包埋剂中.组织切成14 μm厚度,经4%PFA处理20 min,2 μg/mL蛋白酶K处理10 min,0.25%乙酸酐处理10 min,杂交液室温封闭1 h,加入终质量浓度为0.5 ng/μL的地高辛标记的RNA探针,65 ℃孵育过夜;次日在65 ℃的0.2×SSC浸洗3次,每次20 min,在室温的0.2×SSC中冷却后用0.1 mol/L pH7.4 Tris-HCl缓冲液浸洗10 min,加入偶联碱性磷酸酶的抗地高辛的抗体,4 ℃孵育过夜;之后组织切片用0.1 mol/L pH7.4 Tris-HCl缓冲液浸洗3次,每次20 min,转入0.1 mol/L pH9.5 Tris-HCl缓冲液浸洗10 min,加入底物NBT/BCIP显色,终止反应后甲醇处理,封片拍照.
1.3 免疫荧光
组织处理同原位杂交.14 μm冰冻切片经PBS浸洗之后用5%山羊血清室温封闭30 min,加入一抗(配在5%山羊血清中,含0.1%Triton),4 ℃孵育过夜.次日PBS洗去未结合的一抗后,加入荧光基团修饰的二抗,室温孵育1 h,洗去多余抗体后封片拍照.所用抗体anti-OLIG2和anti-IBA1均购自Millpore,货号分别为AB9610和MABN92.
2 结果与分析
2.1Yap1缺失小鼠OLs的早期发育情况
为了研究Yap1对少突胶质细胞发育的影响,采用Olig1-Cre工具鼠来特异性地敲除少突胶质细胞中的Yap1基因.由于Olig1基因在少突胶质细胞产生前的神经前体细胞就表达,借助于Olig1-Cre工具鼠可以在少突胶质细胞的前体细胞OPCs产生前就将Yap1基因敲除.因此,这一条件性敲除小鼠可以检测Yap1基因是否影响少突胶质细胞的早期发育.本研究发现尽管在少突胶质细胞中敲除了Yap1基因,但是该突变小鼠能够正常存活,暗示Yap1基因突变小鼠的少突胶质细胞的发育可能没有受到太大影响.
课题组在小鼠刚出生(postnatal day 0, P0)时检测少突胶质细胞的数量,发现其并没有明显的变化.如图1,和对照组小鼠(基因型为Olig1+/Cre;Yap1+/flox)相比,在P0时期的突变体小鼠(基因型为Olig1+/Cre;Yap1flox/flox)中,少突胶质细胞的总数(OLIG2+、Sox10+)没有明显变化,而表达的Pdgfra的OPCs的数量也没有明显变化(OLIG2:对照组673±33,突变体561±47;Sox10:对照组538±13,突变体517±22;Pdgfra:对照组369±31,突变体344±21;n=3,p>0.05).由于少突胶质细胞早期发育(主要包括产生和增殖两个阶段)的异常会导致随后少突胶质细胞的数量出现明显异常,因此这一结果表明Yap1的功能并不是少突胶质细胞的早期发育所必需的.
2.2Yap1缺失小鼠脊髓OLs的分化情况
为检测Yap1对少突胶质细胞晚期发育的作用,进一步分析了出生后不同时期小鼠脊髓的成熟少突胶质细胞的发育情况.Mbp、Plp是少突胶质细胞成熟分化后开始表达的基因.图2所示为少突胶质细胞分化的高峰期(出生后两周,P14)和成年期(P72)小鼠中Mbp、Plp的表达结果.可见,P14时期Mbp的表达在突变小鼠中没有明显变化,Plp+的分化的少突胶质细胞数量也没有明显变化(对照组1 139±11,突变体1 106±59;n=3,p>0.05)(图2a—2d).在小鼠进入成年期以后,少突胶质细胞的分化情况也没有受到明显影响,Plp+细胞数量也没有差异(对照组1 910±171,突变体1 720±96;n=3,p>0.05)(图2e—2h).这一结果表明,Yap1基因也不是晚期少突胶质细胞分化所必须的.

a-f:新生小鼠(P0时期)中,相对于对照组小鼠(a,c,e),突变小鼠(b,d,f)中代表少突胶质细胞总数的OLIG2+细胞(a,b)、Sox10+细胞(c,d)和代表OPCs的Pdgfra+细胞(e,f)的数量都没有明显变化;g:统计结果显示P0时期对照小鼠和突变小鼠脊髓中OLIG2+、Sox10+、Pdgfra+的细胞数量没有显著差异(n=3,p>0.05).图1 Yap1基因缺失对少突胶质细胞早期发育的影响Fig. 1 Effect of deletion of Yap1 on the early development of oligodendrocytes

a-h:和对照组小鼠(a,b,e,f)相比,突变小鼠(c,d,g,h)中Mbp的表达和Plp+的分化的少突胶质细胞的数量在P14和P72时期都没有明显变化;i:Plp+少突胶质细胞在P14和P72时期的数量的统计结果(n=3,p>0.05).图2 Yap1基因缺失对少突胶质细胞分化的影响Fig. 2 Effect of deletion of Yap1 on the late differentiation of oligodendrocytes
2.3Yap1缺失小鼠的CNS其他区域OLs的分化情况
考虑到脑等其他部位的少突胶质细胞的发育过程和脊髓有一定的区别,如脑中的少突胶质细胞产生的位置和时间更多样化、经历的增殖时间也更长[6,28],课题组又检测了出生后小鼠大脑和小脑的少突胶质细胞的分化情况.
如图3所示,结果与在脊髓中的情况一致.和对照小鼠相比,突变小鼠中分化后的少突胶质细胞的标记基因Mbp、Plp的表达在P14、P72时期的小鼠脑中没有明显变化(图3a—3h,显示一侧的大脑皮层).而小脑中也观察到同样的结果,P14时期突变小鼠中Mbp、Plp的表达均正常(图3i—3l).这一结果说明Yap1基因突变对大脑和小脑的少突胶质细胞的分化都没有影响,即Yap1基因对整个中枢神经系统的少突胶质细胞的分化都是非必需的.对星形胶质细胞的标记基因Gfap进行检测,也发现P72时期成体小鼠中的星形胶质细胞并无明显的活化现象(图3m,3n).同时,通过免疫荧光实验检测了小胶质细胞的标记基因IBA1的表达,发现在突变小鼠下丘脑等位置的小胶质细胞有一定程度的增多(图3o—3r).这一结果暗示突变小鼠中可能存在一些细胞凋亡或者轴突退行性变化等引起小胶质细胞激活的现象.
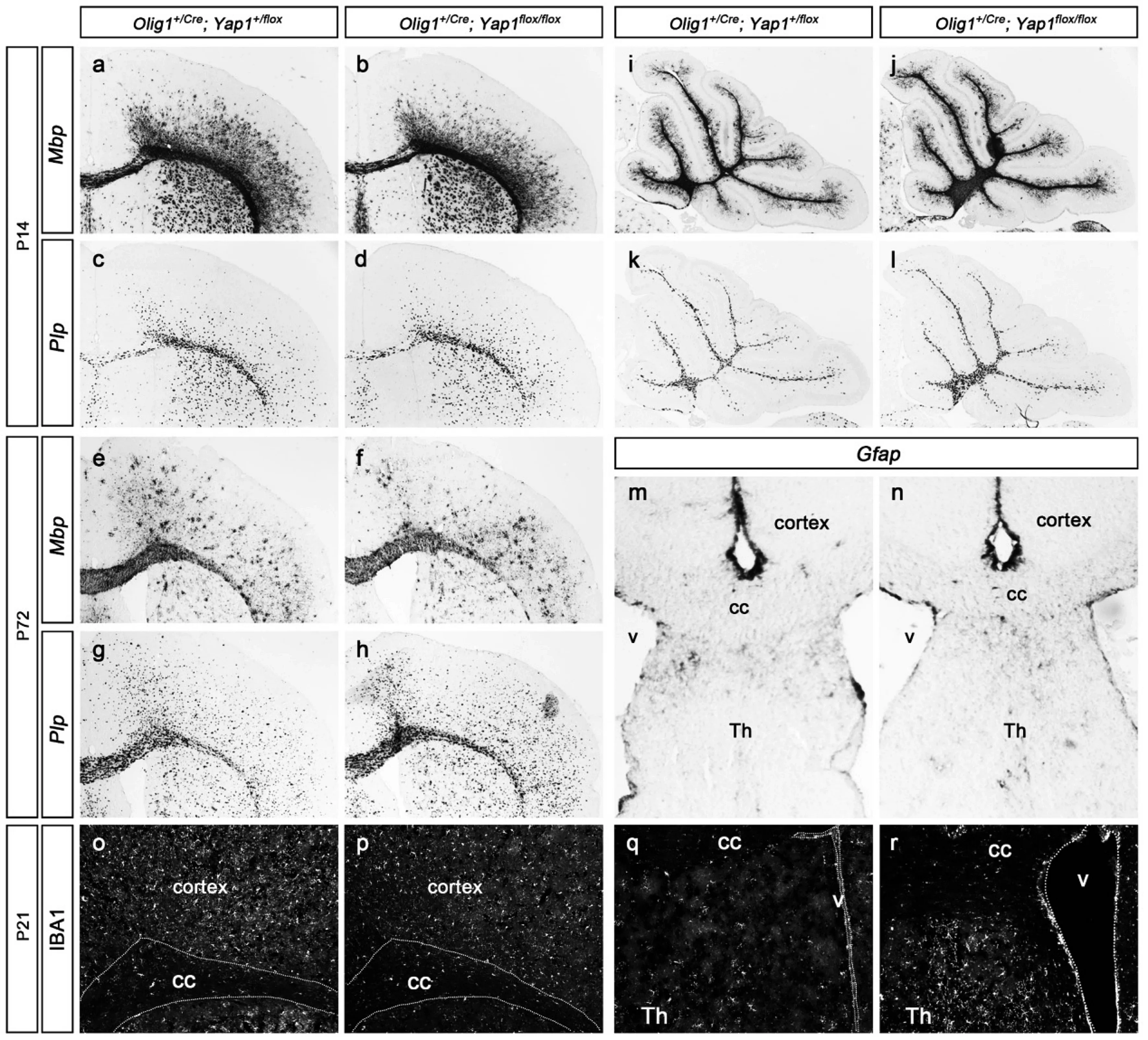
a-h:和对照组小鼠(a,c,e,g)相比,突变小鼠(b,d,f,h)中Mbp(a,b,e,f)和Plp(c,d,g,h)的表达在P14(a-d)和P72(e-h)时期都正常;i-l:和对照组小鼠(i,k)相比,P14时期突变小鼠(j,l)小脑中Mbp、Plp的表达没有变化;m,n:突变小鼠中星形胶质细胞的标记基因Gfap的表达并没有明显变化;o-r:小胶质细胞的标记物IBA1在P21的对照组小鼠(o,q)和突变小鼠(p,r)中的表达,可见在大脑皮层中IBA1的表达没有明显变化(o,p),但是在下丘脑等位置,IBA1的表达有所增多(q,r).cortex,大脑皮层;cc,胼胝体;Th,丘脑;v,脑室.图3 Yap1基因缺失对大脑和小脑少突胶质细胞分化的影响Fig. 3 Effect of deletion of Yap1on the differentiation of oligodendrocytes in cortex and cerebellum
3 讨论
Hippo信号通路参与调控肝脏、心脏等器官的大小,并参与多种器官、组织和细胞的发育过程[11,29].Yap1作为Hippo信号通路下游的关键因子之一,和Tead家族转录因子一起,调控下游基因的表达[30-31].本研究利用Olig1-Cre工具鼠和Yap1-flox条件性敲除小鼠,将Yap1基因从少突胶质细胞以及产生OPCs的神经前体细胞中敲除,探索了Yap1基因对中枢神经系统少突胶质细胞发育的影响.
结果发现,少突胶质细胞缺失Yap1基因的小鼠可以正常存活,出生时具有正常数量的少突胶质细胞,且在随后可以正常分化.这说明Yap1单基因突变并不足以对少突胶质细胞的发育(尤其是成年前)造成明显影响.但实验中也观察到成体以后突变小鼠的大脑会比对照组小一些,暗示Yap1基因缺失可能引起了一些没有检测到的表型变化.另一方面,Yap1缺失是否对最终少突胶质细胞的髓鞘化造成影响还不清楚;此外,由于少突胶质细胞还负责向其包裹的神经元轴突输送营养物质[2-3],少突胶质细胞中有些基因的缺失虽然也对其发育没有明显影响,但是会引起随后由髓鞘包裹的神经元的轴突发生退行性变化[2,32].对这两方面的观察需要借助于电子显微镜和行为学分析.
需要指出的是,Yap1有一个结构上同源、功能上相近的基因Taz(Tafazzin),它们在Hippo信号通路中的位置相同,都可以和Tead家族转录因子形成复合体调节基因表达调控[31].因此,Yap1单基因突变对少突胶质细胞发育没有影响,并不说明Hippo信号通路不参与调控少突胶质细胞的发育.而最近的研究证明了Hippo信号通路对周围神经系统(Peripheral nervous system, PNS)髓鞘的发育至关重要,这一研究便使用了将PNS中形成髓鞘的施旺细胞(Schwann cells)中的Yap1和Taz都敲除的策略[33].他们的结果同时表明在这一过程中Taz起主要作用,而不是Yap1基因,这一情况可能也出现在CNS的髓鞘发育过程中.以后的研究可以借助这些遗传改变的小鼠品系对Hippo信号通路是否参与CNS少突胶质细胞的发育调控这一问题进行分析.
[1] TASAKI I. Conduction of impulses in the myelinated nerve fiber[J]. Cold Spring Harb Symp Quant Biol,1952,17:37-41.
[2] FÜNFSCHILLING U, SUPPLIE L M, MAHAD D, et al. Glycolytic oligodendrocytes maintain myelin and long-term axonal integrity[J]. Nature,2012,485(7399):517-521.
[3] LEE Y, MORRISON B M, LI Y, et al. Oligodendroglia metabolically support axons and contribute to neurodegeneration[J]. Nature,2012,487(7408):443-448.
[4] ZUCHERO J B, BARRES B A. Glia in mammalian development and disease[J]. Development,2015,142(22):3805-3809.
[5] KREMER D, GOTTLE P, HARTUNG H P, et al. Pushing forward: remyelination as the new frontier in CNS diseases[J]. Trend Neurosci,2016,39(4):246-263.
[6] ROWITCH D H, KRIEGSTEIN A R. Developmental genetics of vertebrate glial-cell specification[J]. Nature,2010,468(7321):214-222.
[7] PAN D J. The Hippo signaling pathway in development and cancer[J]. Developmental Cell,2010,19(4):491-505.
[8] ZHAO B, LI L, LEI Q Y, et al. The Hippo-YAP pathway in organ size control and tumorigenesis: an updated version[J]. Genes Dev,2010,24(9):862-874.
[9] YU F X, GUAN K L. The Hippo pathway: regulators and regulations[J]. Genes Dev,2013,27(4):355-371.
[10] LOW B C, PAN C Q, SHIVASHANKAR G V, et al. YAP/TAZ as mechanosensors and mechanotransducers in regulating organ size and tumor growth[J]. FEBS Lett,2014,588(16):2663-2670.
[11] VARELAS X. The Hippo pathway effectors TAZ and YAP in development, homeostasis and disease[J]. Development,2014,141(8):1614-1626.
[12] MOROISHI T, HANSEN C G, GUAN K L. The emerging roles of YAP and TAZ in cancer[J]. Nature Reviews Cancer,2015,15(2):73-79.
[13] MORIN-KENSICKI E M, BOONE B N, HOWELL M, et al. Defects in yolk sac vasculogenesis, chorioallantoic fusion, and embryonic axis elongation in mice with targeted disruption of Yap65[J]. Mol Cell Biol,2006,26(1):77-87.
[14] ELBEDIWY A, VINCENT-MISTIAEN Z I, SPENCER-DENE B, et al. Integrin signalling regulates YAP and TAZ to control skin homeostasis[J]. Development,2016,143(10):1674-1687.
[15] REGINENSI A, SCOTT R P, GREGORIEFF A A, et al. Yap- and Cdc42-dependent nephrogenesis and morphogenesis during mouse kidney development[J]. PLoS Genetics,2013,9(3):e1003380.
[16] SEPTER S, EDWARDS G, GUNEWARDENA S, et al. Yes-associated protein is involved in proliferation and differentiation during postnatal liver development[J]. Am J Physiol Gastrointest Liver Physiol,2012,302(5):G493-G503.
[17] LIN C W, YAO E, CHUANG P T. A conserved MST1/2-YAP axis mediates Hippo signaling during lung growth[J]. Dev Biol,2015,403(1):101-113.
[18] WATT K I, TURNER B J, HAGG A, et al. The Hippo pathway effector YAP is a critical regulator of skeletal muscle fibre size[J]. Nat Commun,2015,6:6048.
[19] GEORGE N M, DAY C E, BOERNER B P, et al. Hippo signaling regulates pancreas development through inactivation of Yap[J]. Mol Cell Biol,2012,32(24):5116-5128.
[20] CHEN Q, ZHANG N L, GRAY R S, et al. A temporal requirement for Hippo signaling in mammary gland differentiation, growth, and tumorigenesis[J]. Genes Dev,2014,28(5):432-437.
[21] SONG J Y, PARK R, KIM J Y, et al. Dual function of Yap in the regulation of lens progenitor cells and cellular polarity[J]. Dev Biol,2014,386(2):281-290.
[22] VAN HATEREN N J, DAS R M, HAUTBERGUE G M, et al. FatJ acts via the Hippo mediator Yap1 to restrict the size of neural progenitor cell pools[J]. Development,2011,138(10):1893-1902.
[23] HAN D, BYUN S H, PARK S, et al. YAP/TAZ enhance mammalian embryonic neural stem cell characteristics in a Tead-dependent manner[J]. Biochem Biophys Res Commun,2015,458(1):110-116.
[24] HEALLEN T, ZHANG M, WANG J, et al. Hippo pathway inhibits Wnt signaling to restrain cardiomyocyte proliferation and heart size[J]. Science,2011,332(6028):458-461.
[25] AZZOLIN L, PANCIERA T, SOLIGO S, et al. YAP/TAZ incorporation in the beta-Catenin destruction complex orchestrates the Wnt response[J]. Cell,2014,158(1):157-170.
[26] PORAZINSKI S, WANG H J, ASAOKA Y, et al. YAP is essential for tissue tension to ensure vertebrate 3D body shape[J]. Nature,2015,521(7551):217-221.
[27] LU Q R, SUN T, ZHU Z M, et al. Common developmental requirement for Olig function indicates a motor neuron/oligodendrocyte connection[J]. Cell,2002,109(1):75-86.
[28] RICHARDSON W D, KESSARIS N, PRINGLE N. Oligodendrocyte wars[J]. Nat Rev Neurosci,2006,7(1):11-18.
[29] HALDER G, JOHNSON R L. Hippo signaling: growth control and beyond[J]. Development,2011,138(1):9-22.
[30] LIU-CHITTENDEN Y, HUANG B, SHIM J S, et al. Genetic and pharmacological disruption of the TEAD-YAP complex suppresses the oncogenic activity of YAP[J]. Genes Dev,2012,26(12):1300-1305.
[31] CHEN L M, LOH P G, SONG H W. Structural and functional insights into the TEAD-YAP complex in the Hippo signaling pathway[J]. Protein Cell,2010,1(12):1073-1083.
[32] LAPPE-SIEFKE C, GOEBBELS S, GRAVEL M, et al. Disruption of Cnp1 uncouples oligodendroglial functions in axonal support and myelination[J]. Nat Genet,2003,33(3):366-374.
[33] POITELON Y, LOPEZ-ANIDO C, CATIGNAS K A, et al. YAP and TAZ control peripheral myelination and the expression of laminin receptors in Schwann cells[J]. Nat Neurosci,2016,19(7):879-887.
The Analysis ofYap1 in the Development of Oligodendrocytes
YI Min1, DU Junqing1, HUANG Hao1, HU Xuemei2, QIU Mengsheng1,2
(1. Institute of Life Sciences, Hangzhou Normal University, Hangzhou 310036, China; 2. Department of Anatomical Sciences and Neurobiology, University of Louisville, Louisville 40292, USA)
Myelin formed by oligodendrocytes in the central nervous system wraps axons to accelerate the conduction of nerve impulses. As a key factor ofHippopathway,Yap1 involves in the development of multiple organs and types of cells. To investigate the function ofYap1 in oligodendrocyte development,Yap1 was conditionally knocked out in oligodendrocytes, and the phonotypes were checked withinsituhybridization and immunofluorescence. However, the data showed that the early development and differentiation of oligodendrocytes were not affected in mutant mice, which indicated thatYap1 was not required for oligodendrocyte development.
Yap1;Hippo; central nervous system; oligodendrocytes
10.3969/j.issn.1674-232X.2017.03.005
2016-06-13
国家自然科学基金项目(31572224,31372150);国家重点基础研究发展规划项目(2013CB531303).
邱猛生(1963—),男,教授,博士,主要从事神经发育生物学研究.E-mail:m0qiu001@yahoo.com
Q189
A
1674-232X(2017)03-0249-06

