大麻二酚抑制小鼠脊髓损伤后炎症反应及促进功能恢复的研究
李萃萃, 张曼辉, 夏 涵, 戴宜武
(1.南方医科大学, 广东 广州 510515 2.陆军总医院附属八一脑科医院超声科, 北京100010 3.北京中医药大学东方医院麻醉科, 北京100078)
大麻二酚抑制小鼠脊髓损伤后炎症反应及促进功能恢复的研究
李萃萃1, 张曼辉2, 夏 涵3, 戴宜武1
(1.南方医科大学, 广东 广州 510515 2.陆军总医院附属八一脑科医院超声科, 北京100010 3.北京中医药大学东方医院麻醉科, 北京100078)
目的:探讨大麻二酚抑制小鼠急性脊髓损伤后炎症反应及其机制。方法:将C57/BL6小鼠随机分为3组(假手术组、对照组和用药组),每组8只,共24只。用药组和对照组小鼠用钳夹法夹断小鼠脊髓,假手术组不夹断脊髓,术后每日为小鼠挤压膀胱,帮助排尿。术后1h、12h、24h、36h、48h、60h给药,依据小鼠体重,对照组和假手术组腹腔注射安慰剂(0.25mL/10g,1%吐温80+生理盐水),用药组予以腹腔注射30mg/kg大麻二酚(1.2mg/mL,溶剂为1%吐温80+生理盐水)。术后72h评价小鼠脊髓神经功能,行BMS(Basso mouse scale,BMS)评分,并通过ELISA检测组织中高迁移率族蛋白1(HMGB1)和肿瘤坏死因子-α(TNF-α)含量。结果:BMS(Basso mouse scale,BMS)评分,假手术组>用药组>对照组(P<0.05);脊髓组织中HMGB1和TNF-α含量均为假手术组<用药组<对照组(P<0.05)。结论:大麻二酚能通过抑制脊髓损伤小鼠模型HMGB1表达来抑制小鼠炎症反应,从而对脊髓损伤小鼠脊髓神经功能保护。
大麻二酚; 脊髓损伤; 炎 症; 运动功能
脊髓损伤(spinal cord injury, SCI)是脊柱损伤临床最严重的并发症一种严重的神经系统损伤,可致躯体运动、感觉以及自主神经功能障碍,包括原发性和继发性损伤。原发性损伤系外力直接或间接致脊髓受损,继发性损伤系脊髓在原发性损伤后发生氧化应激、炎症反应等一系列生理生化机制,致原发性损伤组织周围组织发生进一步损伤,使脊髓损伤进一步加重并扩大脊髓损伤范围[1]。原发性脊髓损伤已发生且难以逆转,因此能有效抑制继发性脊髓损伤,对脊髓损伤具有重要意义。高迁移率族蛋白1(high mobility group box-1 protein,HMGB1)在真核细胞核内表达,系一种非组蛋白DNA结合蛋白,同时也是一种危险分子蛋白,参与炎症反应[2]。HMGB1在脊髓损伤中高度表达, 能加重脊髓炎症反应[1,3]。
大麻二酚系天然植物大麻提取物,无精神效应,具有抗炎作用[4]。目前国内大麻二酚对脊髓损伤的治疗尚无报道。本研究通过脊髓损伤模型探讨验证大麻二酚对脊髓损伤的抗炎作用及对功能恢复的帮助。
1 材料与方法
1.1 材料:小鼠(C57BL/6,北京维通利华实验动物技术有限公司),10周,雄性,20~25g;大麻二酚(98%)购于上海源叶生物有限公司;ELISA试剂盒(Minneapolis, MN, USA)。
1.2 方 法
1.2.1 脊髓损伤模型建立:用3.6%水合氯醛腹腔注射麻醉小鼠(0.01L/kg),备皮(T10棘突为中心)。酒精消毒,背部正中切口(约2cm),逐层切开,暴露棘突,将肌肉分离,用咬骨钳将T9~11棘突和全椎板咬除。以T10为中心暴露硬脊膜(约9mm的圆形区),用显微外科血管夹将其钳夹3s(造模成功标志:钳夹脊髓损伤瞬间,小鼠尾部痉挛性摆动,双下肢和躯体抽动后双下肢瘫痪),脊髓损伤后逐层缝合肌肉,并缝合皮肤。假手术组仅作椎板双侧切除,不钳夹。术后每天挤压膀胱(早中晚3次)帮助排尿。
1.2.2 用药和给药时间:依据小鼠体重,对照组和假手术组腹腔注射安慰剂(0.25mL/10g,1%吐温80+生理盐水),用药组予以腹腔注射30mg/kg大麻二酚(1.2mg/mL,溶剂为1%吐温80+生理盐水)。药物现配现用,给药时间为模型建立后1h、12h、24h、36h、48h、60h。
1.2.3 神经行为学评分:小鼠后肢运动功能BMS(Basso mouse scale,BMS)评分用于评价脊髓神经功能。由不知道分组情况的研究人员进行测试, 受试SCI小鼠测试前均需排空膀胱,0~2分(评价踝关节运动),3~4分(评价后肢对后半身支撑和向前步进的情况),5~8分(评价步进过程中后爪位置和前后肢体的协调性及躯干的稳定性),9分为正常运动小鼠。
1.2.4 HMGB1和TNF-α组织含量测定:酶联免疫吸附法(ELISA)。脊髓损伤72h后,麻醉小鼠,活取小鼠脊髓T10节段上下约1cm,放入冷冻管并迅速置于液氮中冷冻,待取完所有标本时将标本放入-80℃冰箱中冷藏,待使用时取出。按照ELISA试剂盒操作使用说明,测定脊髓损伤组织中HMGB1和TNF-α的含量。

2 结 果
2.1 各组小鼠间BMS评分比较:全部24只小鼠均成功造模,通过BMS评分检测小鼠损伤后各时间点下肢及躯体运动功能恢复情况,用药后72h对各组小鼠进行BMS评分,用药组BMS评分明显高于对照组,差异具有统计学意义(P<0.05)。两两比较可见,假手术组>用药组>对照组,见表1。显然,SCI小鼠经大麻二酚治疗后脊髓神经功能有所恢复,但不能恢复到正常水平。
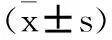
表1 各组小鼠BMS评分结果
注:两两比较采用SNK法。假手术组vs对照组:q=51.983,P<0.05;用药组vs对照组:q=3.907,P<0.05;假手术组vs用药组:q=48.076,P<0.05
2.2 各组小鼠脊髓组织HMGB1和TNF-α的含量比较:用药后72h对损伤脊髓周围组织中HMGB1和TNF-α的含量进行测定。各组HMGB1含量比较,差异具有统计学意义(P<0.05)。两两比较结果为:对照组>用药组>假手术组,差异具有统计学意义(P<0.05);各组TNF-α含量比较,差异具有统计学意义(P<0.05)。两两比较结果为:对照组>用药组>假手术组,差异具有统计学意义(P<0.05),见表2。
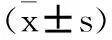
表2 各组间脊髓组织HMGB1和TNF-α的含量比较
注:两两比较采用SNK法。HMGB1含量:假手术组vs对照组:q=30.889,P<0.05;用药组vs对照组:q=8.714,P<0.05;假手术组vs用药组:q=22.175,P<0.05
TNF-α含量:假手术组vs对照组:q=24.221,P<0.05;用药组vs对照组:q=5.308,P<0.05;假手术组vs用药组:q=18.913,P<0.05
3 讨 论
脊髓损伤是一种急性、破坏性极强的疾病,可导致躯体运动和感觉功能障碍,多数幸存者成为了截瘫患者,生活质量差,而且增加社会负担。脊髓损伤包括原发性脊髓损伤和继发性脊髓损伤,目前阶段原发性损伤无有效治疗措施[5]。继发性脊髓损伤加重血-脊髓屏障破坏,导致一系列通透性改变,导致脊髓出血、炎症反应和水肿,使未损伤部位神经组织损伤,进一步破坏神经功能[6,7]。炎症反应在继发性损伤中占有重要组成部分,因此控制炎症反应对脊髓损伤的治疗具有重大意义。
BMS评分是评价脊髓损伤后小鼠神经运动功能恢复情况。研究表明,大麻二酚能抑制神经元细胞凋亡,对神经系统具有保护作用[8]。本实验中,用药组BMS评分比对照组评分高,说明大麻二酚对脊髓损伤小鼠神经功能具有保护作用。其机制可能是大麻二酚能够减轻继发性脊髓损伤,减轻炎症反应,从而保护神经元。
HMGB1是一种危险蛋白分子,主要存在于真核细胞核中,是一种非组蛋白DNA结合蛋白。在神经系统中,HMGB1通过激活和聚集炎症相关细胞,激活炎症反应,包括小胶质细胞、巨噬细胞、中性粒细胞和NK细胞等,并释放出炎症因子加重炎症反应,包括TNF-α等[9~11]。当细胞受损或者细胞坏死后,HMGB1会被表达并释放到细胞外[12]。在本实验中,我们发现用药组组织中HMGB1含量比对照组低。说明大麻二酚能降低组织中HMGB1的表达。目前大麻二酚降低HMGB1表达和释放的机制未明确,有待继续研究。TNF-α是一种重要的炎症因子,正常情况下可有助于机体清除有害物质,对机体具有保护作用,当机体收到损伤或炎症时大量释放,可调控其他因子的产生,在炎症反应过程中起到放大炎症反应作用,对机体产生更大的损伤[13,14]。TNF-α在神经系统炎症反应中可由小胶质细胞分泌[15,16]。
在本实验中,用药组组织中TNF-α含量比对照组低,说明大麻二酚具有抑制TNF-α表达的作用,同时大麻二酚能抑制组织中HMGB1表达。有研究证实,HMGB1在炎症反应中能聚集并激活小胶质细胞,促进并放大炎症反应[16]。因此大麻二酚抑制炎症反应的机制可能是抑制HMGB1表达和释放,从而抑制小胶质细胞聚集和激活,抑制炎症因子的释放,从而抑制炎症反应的进行,最终对脊髓损伤产生保护作用。
本研究采用小鼠模型,与文献中常用的大鼠模型相比,相似的药品剂量和注射浓度并没有造成动物死亡和任何腹膜炎反应。说明大麻二酚在一定剂量范围内是安全的,但由于大麻二酚的治疗剂量范围较窄,神经系统急性损伤后的高血脑屏障通过性及细胞防卫机制受损等因素可能增加药物毒性风险[17]。需给予足够的关注。
[1] Festoff, B W.Designing drugs that encourage spinal cord injury healing[J].Expert Opinionon Drug Discovery,2014, 9(10):1151~1165.
[2] Frank MG, Weber M D, Watkins L R,et al. Stress sounds the alarmin: The role of the danger-associated molecular pattern HMGB1 in stress-induced neuroinflammatory priming[J].Brain Behavior and Immunity,2015, 48:1~7.
[3] 张莹,杨三强,刘均港,等.血浆置换对系统性红斑狼疮患者外周血HMGB-1、TNF-α水平的影响[J].山东医药,2013,53(18):82~83.
[4] Burstein S. Cannabidiol (CBD) and its analogs: a review of their effects on inflammation[J].Bioorganic & Medicinal Chemistry,2015, 23(7):1377~1385.
[5] Lusilla-Palacios P, Castellano-Tejedor C.Spinal cord injury and substance use: a systematic review[J].Adicciones,2015, 27(4):294~311.
[6] Wang J, Pearse D D.Therapeutic hypothermia in spinal cord injury: the status of its use and open questions[J].International Journal of Molecular Sciences,2015, 16(8):16848~16879.
[7] Sharma H S.Early microvascular reactions and blood-spinal cord barrier disruption are instrumental in pathophysiology of spinal cord injury and repair: novel therapeutic strategies including nanowired drug delivery to enhance neuroprotection[J].Journal of Neural Transmission,2011, 118(1):155~176.
[8] Schiavon A P, Soares L M, Bonato J M,et al.Protective effects of cannabidiol against hippocampal cell death and cognitive impairment induced by bilateral common carotid artery occlusion in mice[J].Neurotoxicity Research,2014, 26(4), 307~316.
[9] Frank M G, Weber M D, Fonken L K,et al.The redox state of the alarmin HMGB1 is a pivotal factor in neuroinflammatory and microglial priming: A role for the NLRP3 inflammasome[J].Brain Behavior and Immunity,2016,215~224.
[10] Hayakawa K, Mishima K, Nozako M,et al. Delayed treatment with minocycline ameliorates neurologic impairment through activated microglia expressing a high-mobility group box1-inhibiting mechanism[J].Stroke,2008, 39(3):951~958.
[11] Gelderblom M, Sobey C G, Kleinschnitz C,et al.Danger signals in stroke[J].Ageing Research Reviews,2015:77~82.
[12] Vénéreau E, Ceriotti C, Bianchi M E.DAMPs from Cell Death to New Life[J].FrontiersInImmunology,2015, 18(6): 422.
[13] 王晓燕,张流忠,周莉,等.脓毒症患者血清CRP、TNF-α水平变化及意义[J].山东医药,2012,58(34):34~35.
[14] Cong L, Chen W.Neuroprotective effect of ginsenoside rd on spinal cord injury rats[J].Basic & Clinical Pharmacology & Toxicology,2016, 119(2): 193~201.
[15] Song F, Zeng K, Liao L,et al.Schizandrin a inhibits microglia-mediated neuroninflammation through inhibiting TRAF6-NF-kB and Jak2-Stat3 signaling pathways[J].PLoS One,2016, 11(2).
[16] Han B, Lu Y, Zhao H,et al.Electroacupuncture modulated the inflammatory reaction in MCAO rats via inhibiting the TLR4/NF-κB signaling pathway in microglia[J].Journal of Clinical and Experimental Pathology,2015, 8(9):11199~11205.
[17] Maier I C, Schwab M E.Sprouting,regeneration and circuit formation in the injured spinal cord: factors and activity[J].Philosophical Transactions of the Royal Society B,2006,361(1473): 1611~1634.
Cannabidiol Can Inhibit Inflammation in a Mouse Model of Spinal Cord Injury
LICuicui,etal
(SouthernMedicalUniversity,GuangdongGuangzhou510515,China)
Objective:To investigate the inhibition of inflammation by cannabidiol in a mouse model of spinal cord injury and study its mechanism. Methords: 24 male C57Bl/6 mice were randomized into 3 groups: sham-operation group, control group and medication group. We established an spinal cord injury model by clip method, the mice in sham-operate group and control group were administered with a mixture of 1% of tween 80 and sterile saline (0.25mL/10g) and medication group were treated with cannabidiol (30mg/kg ; was dissolved in a mixture of 1% of Tween 80 and sterile saline (1.2mg/mL)) by intraperitioneal injection at 1h、12h、24h、36h、48h、60h after operation.72h after operation , BMS test was used to evaluate the neurological score, the expression levels of HMGB1 and TNF-αin spinal cord tissue were assayed by ELISA. Rsults: The BMS test showed that medication group had a higher score than the control group(P<0.05). The expression levels of HMGB1 and TNF-α in medication group were significant reduced as comparison with control group P<0.05), but significant increased than the sham-operation group(P<0.05). Conclusion: Cannabidiol can inhibit inflammation in a mouse model of spinal cord injury via inhibiting the expression of HMGB1.
Cannabidiol; Spinal cord injury; Inflammation; Motor function
1006-6233(2017)05-0767-04
国家自然科学基金,(编号:81271391)
戴宜武
A
10.3969/j.issn.1006-6233.2017.05.018

