miR-145通过下调LRRFIP1抑制血管平滑肌细胞增殖及迁移机制
黄 寰, 陆志锋, 陈晞明, 张慧敏, 李纪明
(1.广州医科大学附属第三医院心内科, 广东 广州 510150 2.上海同济大学附属东方医院心内科, 上海 200000)
miR-145通过下调LRRFIP1抑制血管平滑肌细胞增殖及迁移机制
黄 寰1, 陆志锋1, 陈晞明1, 张慧敏1, 李纪明2
(1.广州医科大学附属第三医院心内科, 广东 广州 510150 2.上海同济大学附属东方医院心内科, 上海 200000)
目的:探究miR-145抑制血管平滑肌增殖和迁移的机制。方法:采用实时定量PCR检测血管平滑肌细胞miR-145的表达。采用mimics-miR-145转染血管平滑肌细胞,然后利用荧光素酶检测和Western blot检测miR-145在平滑肌细胞的增殖和迁移。结果:体外过表达miR-145,可抑制血管平滑肌细胞的增殖和迁移,反之,下调miR-145促进血管平滑肌细胞增殖和迁移。LRRFIP1与miR-145表达负相关,下调LRRFIP1可抑制血管平滑肌细胞增殖及迁移。结论:miR-145可能通过下调LRRFIP1抑制血管平滑肌细胞的增殖和迁移。
血管平滑肌细胞; miR-145; RAF作用蛋白; 增 殖; 迁 移
自体静脉移植、血管腔内成形术是目前治疗闭塞性疾病的有效手段,但是血管成形术后血管早期再狭窄一直是困扰治疗效果的一大难题[1~3]。临床观察证实,术后1年血管的闭塞率达15%~30%,并且逐年递增,10年通畅率仅为50%。研究证明,血管平滑肌细胞(Vascular smooth muscle cells,VSMC)从基质迁移至内膜下并增殖是导致新生内膜形成和血管再狭窄形成的主要原因。血管损伤或血管吻合术后,在多种因素的参与下,早期即出现血管内血栓形成和中晚期的血管内膜增生,这些因素共同导致血管早期的再狭窄。VSMC的增殖和迁移是血管增殖性疾病发病的核心环节,异常的VSMC增殖、迁移是血管再狭窄、硬化闭塞等心血管疾病的主要特征,这已成为诸多科研工作者的共识[4~6]。LRRFIP1(也称TRAF作用蛋白,TRIP)是肿瘤坏死因子受体超家族的成员之一,包含一个RING手指序列和一个扩展的coiled-coil区域。miRNAs是小的非编码RNA分子绑定在靶mRNAs的3’非翻译区域,导致翻译抑制和mRNA退化,在各种各样的生物学事件比如增殖,进展,分化和细胞凋亡中扮演着重要角色[7~9]。本研究中,我们的目的是确定miR-145在血管平滑肌细胞中的表达和功能,并探讨miR-145参与血管平滑肌细胞的发展机制。
1 材料与方法
1.1 细胞株:293FT细胞株:慢病毒包装细胞株293FT购自上海中科院细胞库。人主动脉血管平滑肌细胞株(VSMC):购自美国标准生物品收藏中心(ATCC)
1.2 细胞转染:miR-145类似物,抑制剂和非特异性miRNA负调控分子是从锐博生物公司购买的。LRRFIP1的小干扰RNA由上海吉玛制药技术有限公司设计的。转染后培养48h,收集细胞做实时荧光定量PCR分析。所有检测均独立进行三次。
1.3 细胞增殖试验:CCK-8试剂盒测定细胞增殖特性,严格按照说明指示。细胞接种于96孔培养板中,培养24、48、72和96h 37℃在箱中5%的CO2。在450nm处的吸光度测定。所有检测均独立进行三次。
1.4 细胞侵袭试验:细胞的侵袭能力的测定采用Transwell侵袭小室(Abcam公司,美国),严格按照说明进行。培养48h后,细胞被转移到上腔无血清RPMI-1640培养基。下室中加入含10%胎牛血清的RPMI-1640培养。所有检测均独立进行三次。
1.5 实时荧光定量PCR:将miRNA和mRNA逆转录为cDNA.逆转录是使用逆转录试剂盒进行的。实时荧光定量PCR使用SYBR Green PCR 试剂盒在ABI7500快速实时PCR系统进行的,操作过程按照厂家说明书。miR-145的表达均一化到U6,LRRFIP1 mRNA均一化到GAPDH。所有的试验都重复三次。相关基因的表达用2-△△Ct的方法计算。
1.6 荧光素酶试验检测试验:LRRFIP1的3’非翻译区域序列预测与miR-145有关,或者是预测靶点的一个变异序列整合和插入在pGL3的催化剂载体pGL3-LRRFIP1-wt和pGL3-LRRFIP1-mut.细胞是在一个24孔培养皿中培育的,然后分别用miR-145类似物或miRNA控制物,含有萤火虫荧光素酶的野生型或者突变型pGL3-LRRFIP1质粒,含有海肾荧光素酶的pGL3-LRRFIP1载体转染。用脂质体2000试剂进行转染。转染48h后收集细胞并且用双荧光素酶报告分析。所有检测均独立进行三次。

2 结 果
2.1 miR-145抑制细胞增殖和迁移:CCK-8结果显示,转染miR-145 analogue组与Control组比较,24h后,血管平滑肌细胞增殖能力未见明显差异性变化(miR-145 analogue组为0.26±0.01,Control组为0.25±0.01,P>0.05,无统计学意义)。48h后血管平滑肌增殖能力有差异性变化(miR-145 analogue组为0.73±0.11,Control组为0.95±0.21,P<0.05)。转染72h后,差异更加明显(miR-145 analogue组为1.45±0.24,Control组为1.03±0.13,P<0.05)。转染96h后,差异更加明显(miR-145 analogue组为3.15±0.54,Control组为2.03±0.33,P<0.01)。转染miR-145 inhibitor与Control组比较,24h后,血管平滑肌细胞增殖能力未见明显差异性变化(miR-145 inhibitor为0.24±0.01,Control组为0.25±0.01,P>0.05,无统计学意义)。48h后血管平滑肌细胞增殖能力未见明显差异性变化(miR-145 inhibitor为0.78±0.01,Control组为0.95±0.21,P>0.05,无统计学意义)。转染72h后,差异明显(miR-145 inhibitor组为0.75±0.24,Control组为1.03±0.13,P<0.01)。转染96h后,差异更加明显(miR-145 inhibitor组为0.85±0.24,Control组为2.03±0.33,P<0.01),见图1。
Transwell迁移实验发现,与Control组相比较,miR-145 analogue组血管平滑肌细胞迁移穿透小室膜孔的能力明显下降,miR-145 inhibitor组血管平滑肌细胞迁移穿透小室膜孔的能力明显上升。Contorl组迁移数为(50±12)个;miR-145 analogue组(35±6个);miR-145 inhibitor组(300±20个)(P<0.01)。见图1。

图1 miR-145抑制平滑肌细胞的增殖和迁移
A:在miR-145类似物和抑制剂中miR-145的表达量;B:miR-145抑制平滑肌细胞的增殖;C:miR-145抑制平滑肌细胞的迁移。aP<0.05,bP<0.01 vs 对照组。
2.2 LRRFIP1是miR-145的一个直接靶点:LRRFIP1 mRNA的3’非翻译区域含有一个miR-145的靶点。为确定LRRFIP1是miR-145的一个直接靶点,进行了荧光素酶检测试验。结果表明miR-145明显抑制野生型而不是变异型LRRFIP1的3’-UTR的荧光素酶活性(P<0.01)。此外,实时荧光定量PCR分析显示miR-145的过表达显著降低血管平滑肌细胞LRRFIP1的表达(P<0.01)。见图2。
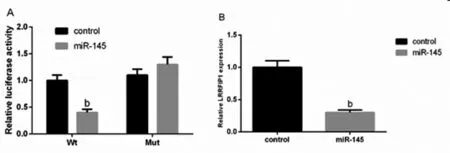
图2 LRRFIP1的直接作用靶点
A:荧光素酶活性检测;B:LRRFIP1的相对表达量。bP<0.01 vs 对照组
2.3 LRRFIP1对细胞增殖和迁移的影响:CCK-8结果显示,转染si-LRRFIP1组与si-SMC Control组比较,24h后,血管平滑肌细胞增殖能力未见明显差异性变化(si-LRRFIP1组为0.13±0.01,si-SMC Control组为0.14±0.01,P>0.05,无统计学意义)。48h后血管平滑肌增殖能力有差异性变化(si-LRRFIP1组为1.03±0.11,si-SMC Control组为0.35±0.14,P<0.05)。转染72h后,差异更加明显(si-LRRFIP1组为1.45±0.34,si-SMC Control组为0.48±0.08,P<0.05)。转染96h后,差异更加明显(si-LRRFIP1组为2.15±0.44,si-SMC Control组为0.72±0.31,P<0.01)。见图3。
Transwell迁移实验发现,与si-SMC Control组相比较,si-LRRFIP1组血管平滑肌细胞迁移穿透小室膜孔的能力明显下降。si-SMC Control组迁移数为(150±22个)(P<0.01)。见图3。
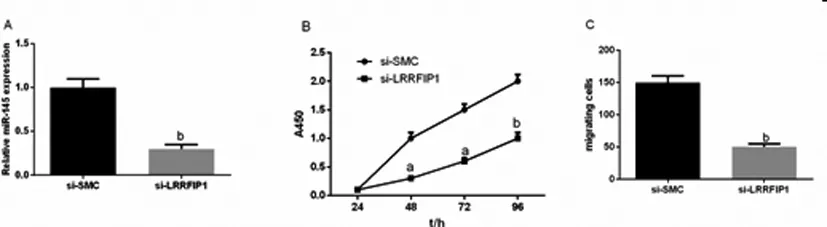
图3 LRRFIP1对细胞增殖和迁移的影响情况
A:si-SMC和si-LRRFIP1中miR-145的相对表达量;B:LRRFIP1对细胞增殖的影响情况;C:LRRFIP1对细胞迁移的影响情况。aP<0.05,bP<0.01 vs si-SMC组。
3 讨 论
本研究探究miR-145在血管平滑肌细胞增殖和迁移中作用。结果发现miR-145过表达明显抑制血管平滑肌细胞的增殖和迁移,相反,miR-145的表达下调促进血管平滑肌细胞的增殖和迁移。结果表明miR-145可能在血管平滑肌的增殖和迁移中抑制闭塞性疾病。进一步研究了miR-145抑制血管平滑肌细胞增殖和迁移的分子机制。
TRIP蛋白的N-端的序列与FLI结合蛋白FLAP的N-端序列有着高度同源性,能与DLILRR蛋白结合,因此TRIP也称LRRFIP1。TRIP位于胞质内,能与双链RNA结合,是肿瘤坏死因子受体超家族成员。我们用生物信息学和实验确定了在血管平滑肌细胞中LRRFIP1是miR-145的一个直接靶点。发现LRRFIP1的mRNA的3'非翻译区域包含着一个miR-145的补充序列。miR-145的过表达显著降血管平滑肌细胞LRRFIP1的表达。LRRFIP1基因是转录因子的LRRFIP1家族的一个成员,在胚胎发育,细胞分化和增殖中扮演重要角色[10-13]。此外,大量的研究显示miRNAs在LRRFIP1的调节中扮演着重要角色。然而LRRFIP1在血管平滑肌细胞中的表达机制仍然不清楚的。敲除LRRFIP1抑制血管平滑肌细胞的增殖和迁移[11, 12]。
miRNA是一类18~25nt的调控性非编码单链小分子RNA,由一段具有发夹环结构的长度为70~80nt的单链miRNA前体剪切后生成。它通过与靶mRNA分子作用后发挥作用,在体内代谢过程中起到多种调控作用[14-17]。研究表明LRRFIP1在血管平滑肌是miR-145的一个功能性靶基因,并且miR-145的过表达与LRRFIP1的低表达相关,抑制血管平滑肌细胞的增殖和迁移[18-22]。总之,miR-145通过下调LRRFIP1抑制闭塞性疾病,miR-145可能是闭塞性疾病的潜在治疗靶点。
[1] Tresoldi C,Pellegata AF,Mantero S.Cells and stimuli in small-caliber blood vessel tissue engineering[J].Regen Med,2015,10(4):505~527.
[2] Zhang H,Jia X,Han F,et al.Dual-delivery of VEGF and PDGF by double-layered electrospun membranes for blood vessel regeneration[J].Biomaterials,2013,34(9):2202~2212.
[3] Opitz F,Schenke-Layland K,Richter W,et al.Tissue engineering of ovine aortic blood vessel substitutes using applied shear stress and enzymatically derived vascular smooth muscle cells[J].Ann Biomed Eng,2004,32(2):212~222.
[4] Paudel KR,Karki R,Kim DW.Cepharanthine inhibits in vitro VSMC proliferation and migration and vascular inflammatory responses mediated by RAW264.7[J].Toxicol In Vitro,2016,34:16~25.
[5] Yu H,Clarke MC,Figg N,et al.Smooth muscle cell apoptosis promotes vessel remodeling and repair via activation of cell migration,proliferation,and collagen synthesis[J].Arterioscler Thromb Vasc Biol,2011,31(11):2402~2409.
[6] Chen S,Ding Y,Tao W,et al.Naringenin inhibits TNF-αinduced VSMC proliferation and migration via induction of HO-1[J].Food Chem Toxicol,2012,50(9):3025~3031.
[7] Douchi D,Ohtsuka H,Ariake K,et al.Silencing of LRRFIP1 reverses the epithelial-mesenchymal transition via inhibition of the Wnt/β-catenin signaling pathway[J].Cancer Lett,2015,365(1):132~140.
[8] Chen WC,Wang CY,Hung YH,et al.Systematic analysis of gene expression alterations and clinical outcomes for long-chain acyl-coenzyme a synthetase family in cancer[J].PLoS One,2016,11(5):e0155660.
[9] Choe N,Kwon JS,Kim JR,et al.The microRNA miR-132 targets Lrrfip1 to block vascular smooth muscle cell proliferation and neointimal hyperplasia[J].Atherosclerosis,2013,229(2):348~355.
[10] Li WQ,Yu HY,Li YM,et al.Higher LRRFIP1 expression in glioblastoma multiforme is associated with better response to teniposide,a type II topoisomerase inhibitor[J].Biochem Biophys Res Commun,2014,446(4):1261~1267.
[11] Li Y,Li W,Yang Y,et al.MicroRNA-21 targets LRRFIP1 and contributes to VM-26 resistance in glioblastoma multiforme[J].Brain Res,2009,1286:13~18.
[12] Ye Y,Perez-Polo JR,Qian J,et al.The role of microRNA in modulating myocardial ischemia-reperfusion injury[J].Physiol Genomics,2011,43(10):534~542.
[13] Greliche N,Zeller T,Wild PS,et al.Comprehensive exploration of the effects of miRNA SNPs on monocyte gene expression[J].PLoS One,2012,7(9):e45863.
[14] Adlakha YK,Saini N.Brain microRNAs and insights into biological functions and therapeutic potential of brain enriched miRNA-128[J].moL Cancer,2014,13:33.
[15] Loyer X,Mallat Z,Boulanger CM,et al.MicroRNAs as therapeutic targets in atherosclerosis[J].Expert Opin Ther Targets,2015,19(4):489~496.
[16] Lee HJ.Additional stories of microRNAs[J].Exp Biol Med(Maywood),2014,239(10):1275~1279.
[17] Connerty P,Ahadi A,Hutvagner G.RNA Binding Proteins in the miRNA Pathway[J].Int moL Sci,2015,17(1).
[18] Climent M,Quintavalle M,Miragoli M,et al.TGFβtriggers miR-143/145 transfer from smooth muscle cells to endothelial cells,thereby modulating vessel stabilization[J].Circ Res,2015,116(11):1753~1764.
[19] Wang YS,Li SH,Guo J,et al.Role of miR-145 in cardiac myofibroblast differentiation[J].moL Cell Cardiol,2014,66:94~105.
[20] Liu X,Cheng Y,Yang J,et al.Flank sequences of miR-145/143 and their aberrant expression in vascular disease:mechanism and therapeutic application[J].Am Heart Assoc,2013,2(6):e000407.
[21] Ji LY,Jiang DQ,Dong NN.The role of miR-145 in microvasculature[J].Pharmazie,2013,68(6):387~391.
[22] Shimizu C,Kim J,Stepanowsky P,et al.Differential expression of miR-145 in children with Kawasaki disease[J].PLoS One,2013,8(3):e58159.
1006-6233(2017)05-0793-04
2012年国家青年科学基金项目,(编号:81100166)
A
10.3969/j.issn.1006-6233.2017.05.026

