云南咖啡果发酵型果酒的酿造
刘 静,傅 冰,刘苏瑶,屈海盼,罗浩然,袁 唯
(云南农业大学食品科技学院,云南昆明 650000)
云南咖啡果发酵型果酒的酿造
刘 静,傅 冰,刘苏瑶,屈海盼,罗浩然,袁 唯*
(云南农业大学食品科技学院,云南昆明 650000)
以新鲜咖啡果肉为原料,通过正交实验及响应面分析,对其果酒酿造过程的前处理工艺及发酵工艺进行优化。结果表明:前处理最优条件:纤维素酶添加量0.1%,35 ℃酶解3 h,此时可溶性固形物含量变化可达1.7%;咖啡果果酒酿造最优工艺条件为:酵母接种量7.5%,发酵温度29 ℃,初始糖度22%,发酵7 d,在此条件下酒精度可达10.8%。酿制的咖啡果果酒呈深琥珀色,咖啡果香浓郁,滋味纯正且咖啡因的含量为34.3 mg/L。
咖啡果肉,酶解,酿造,果酒
咖啡是目前世界上消费量最大的饮料之一,其与茶、可可并称为世界三大饮料[1-3]。国内咖啡种植分布于云南、海南、广西和广东等省,其中云南咖啡在中国占主导地位[4-6]。据报道,2015年云南小粒咖啡的种植面积已经超过180万亩,产量达13万吨,但每加工1000 kg鲜咖啡果,就有500 kg左右的咖啡果肉副产品被当成垃圾废弃物处理[7]。虽然国内外已有将咖啡果肉加工成饲料,但其木质素含量很高,所以牛等反刍动物对咖啡果肉的消化力不强,且未实现规模化生产[8-9]。作为咖啡果实的一部分,咖啡果肉含有多酚类化合物和生物碱类物质,营养成分较为丰富,且含有天然咖啡因。其中咖啡因对神经系统、消化系统及偏头痛等具有一定的积极作用[10-13]。另外,有研究表明,云南小粒种咖啡果皮粗提物样品中的花青素主要为矢车菊素-3-葡萄糖苷和矢车菊素-3-芸香糖苷,它们的含量分别为0.034 mg/g和0.112 mg/g,并且咖啡果皮的粗提物具有抗氧化效果[14]。为提高咖啡果肉的利用率及解决资源浪费问题,本实验以新鲜咖啡果果肉为原料,探讨果酒酿造工艺条件,为规模化生产提供参考。
1 材料与方法
1.1 材料与仪器
小粒种咖啡(卡蒂莫) 云南省普洱市南岛河咖啡种植基地;烘干咖啡果粉、冻干咖啡果粉 自制;白砂糖 A级,市售;安琪果酒酵母 安琪酵母股份有限公司;纤维素酶(5万U/g) 宁夏和氏璧生物技术有限公司;咖啡因标准品 分析纯,贵州迪大生物;其余试剂 均为分析纯。
BS210S型分析天平 北京奥多利斯天平有限公司;打浆机 飞利浦(中国)投资有限公司;LH-T10手持糖度计 杭州陆恒;721型紫外可见分光光度计 北京普析通用仪器有限公司;DELTA-320数显pH计 杭州奥利龙仪器有限公司。
1.2 咖啡果肉的营养成分测定
测定新鲜咖啡果的水分、灰分、粗蛋白等基本营养成分,方法如下:
水分[15]:直接干燥法;灰分[16]:GB 5009.4-2010;粗蛋白[17]:GB 5009.5-2010;粗纤维[18]:GB/T 5009.10-2003;粗脂肪[19]:酸水解法。
1.3 咖啡果肉的水解
取适量的咖啡果肉,榨汁,加入一定量的纤维素酶,在适当的温度下水解一定时间,测定水解后咖啡果肉可溶性固形物的含量变化。在水解的过程中需调节咖啡果肉汁液的pH至纤维素酶的最适pH5.0左右。
1.4 果酒的酿造工艺流程

调整咖啡果肉汁液的糖度之后,取原料量0.2%的干酵母加入100 mL的温水(35~40 ℃)中活化,搅拌至溶解,保持20 min左右[20]。将活化好的酵母倒入发酵罐中,进行控温酒精发酵,装罐量为80%。发酵前期给予充足的氧气促进酵母的繁殖,中后期密闭发酵罐。发酵过程中每天搅动2~3次,注意避免杂菌的污染。酒精发酵结束后经渣滓分离,转入另一个罐内进行后发酵。后发酵过程中,酵母继续利用残糖,后发酵12~15 d。完成后发酵后在室温下陈酿约3个月。
1.5 酶解条件优化
1.5.1 单因素实验设计 加酶量单因素实验:取10 g榨好的咖啡果肉4份,加水量均为100 mL,分别加入纤维素酶0.05%、0.1%、0.15%、0.2%,均在35 ℃酶解3 h,测可溶性固形物的变化。
酶解温度单因素实验:取10 g榨好的咖啡果肉4份,加水量均为100 mL,分别加入纤维素酶0.1%,在25、30、35、40 ℃下酶解3 h,测可溶性固形物的变化。
酶解时间单因素实验:取10 g榨好的咖啡果肉4份,加水量均为100 mL,分别加入纤维素酶0.1%,温度35 ℃,酶解时间分别为2.0、2.5、3.0、3.5 h,测可溶性固形物的变化[21]。
1.5.2 正交实验设计 以单因素实验所得到的各实验参数为依据,采用 L9(33)正交实验确定酶解咖啡果肉的最佳条件[22],因素水平表见表1。
1.6 发酵工艺的确定
1.6.1 单因素实验设计
1.6.1.1 酵母接种量的确定 咖啡果肉汁液的糖度调整至22%,将活性干酵母经过复水、活化加入其中,将pH调至酸性,加入4%、6%、8%、10%的酵母,29 ℃发酵7 d后测定酒精度。
1.6.1.2 发酵温度的确定 咖啡果肉汁液糖度调整至22%,pH调至酸性,选择酵母添加量为8%,发酵温度为27、28、29、30 ℃,发酵7 d后测定酒精度。
1.6.1.3 初始糖度的确定 咖啡果肉汁液的糖度调整至20%、21%、22%、23%,酵母添加量为8%,pH调至酸性,29 ℃发酵7 d后测定酒精度。
1.6.2 响应面实验设计 在单因素实验的基础上,根据Box-Behnken的中心组合设计原理,选择酵母接种量(A)、发酵温度(B)、初始糖度(C)为自变量,以产品的酒精度为响应值,对咖啡果果酒发酵工艺条件进行优化[23-25],如表2所示。
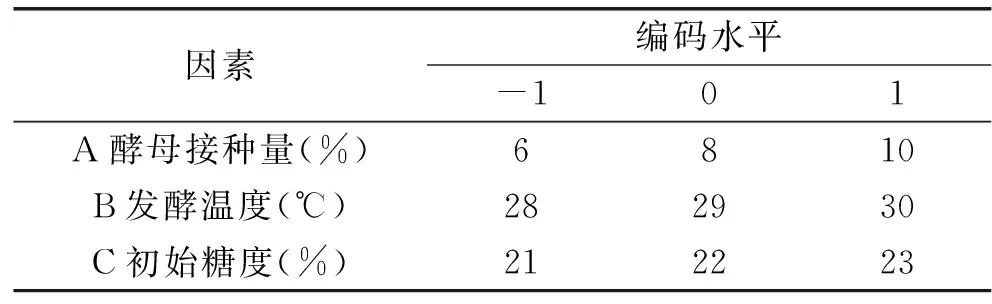
表2 响应面实验因素与水平表Table 2 Factors and levels table of response surface design
1.7 指标的测定
酒精度:蒸馏法[26];可溶性固形物含量:手持糖度仪测定;咖啡因含量的测定:参照GB 5009.139-2014食品安全国家标准;还原糖:斐林试剂法。
微生物指标:对果酒的菌落总数、大肠菌群及治病菌进行测定。
菌落总数采用GB/T 4789.2进行检测,大肠菌群通过GB/T 4789.3,致病菌通过GB/T 4789.5(志贺氏菌检验)、GB/T 4789.10(葡萄球菌检验)。
1.8 数据处理
单因素实验采用Origin8.5软件处理数据,响应面采用Design Expert8.0软件。
2 结果与分析
2.1 咖啡果肉成分的营养成分
从表3中可以看出咖啡果肉可溶性固形物的含量很高,可以发酵产生大量的乙醇,由此可降低糖的添加量。但新鲜的咖啡果肉中粗纤维含量较高,达3.58%。因此,在酿制咖啡果酒之前对果肉进行前处理。

表3 普洱市(卡蒂莫)咖啡果肉成分(%)Table 3 Pu’er(catimor)coffee pulp ingredients(%)
2.2 咖啡果肉前处理条件的优化
2.2.1 加酶量对果汁可溶性固形物的影响 咖啡果肉中的粗纤维可在纤维素酶的作用下降解。由图1可知,随着加酶量的增加,咖啡果肉的水解效率增加,但有一个最佳值。在加酶量为0.1%时,酶解作用迅速又充分,超过此值,酶解效果略有降低。因此实验初步确定加酶量不超过0.1%咖啡果肉为宜。
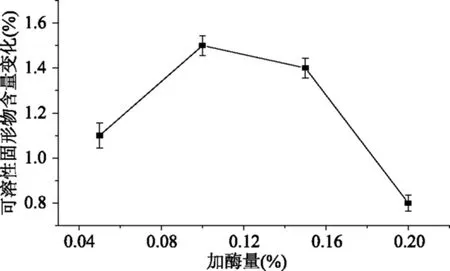
图1 加酶量对可溶性固形物含量变化的影响Fig.1 Effect of the volume of enzyme on the soluble solids content changes
2.2.2 酶解温度对果汁可溶性固形物的影响 酶只有在最适温度条件下才表现出最大活力,过低则会抑制酶的活性,过高则会使酶变性失活。由图2可知,在温度较低时,随温度的提高,酶解效果越好,当酶解温度超过35 ℃时,酶解效率降低,可初步确定酶解温度35 ℃较宜。
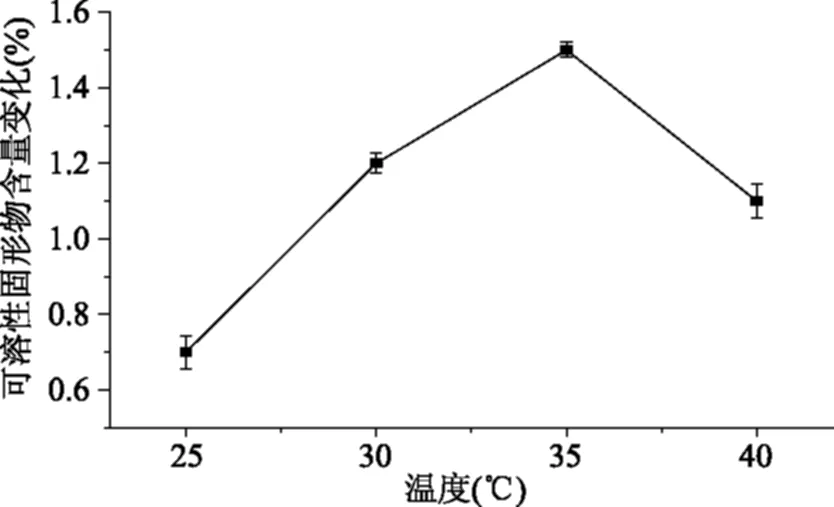
图2 酶解温度对可溶性固形物含量变化的影响Fig.2 Effect of the enzymolysis temperature on the soluble solids content changes
2.2.3 酶解时间对果汁可溶性固形物的影响 由图3可知,处理时间愈长,酶解作用愈充分对咖啡果肉的酶解效率越高,酶解3 h可溶性固形物含量变化为1.5%,超过3 h可溶性固形物含量不再变化,初步确定酶解时间3 h为宜。
图3 酶解时间对可溶性固形物含量变化的影响Fig.3 Effect of the hydrolysis time on the soluble solids content changes
2.2.4 酶解咖啡果肉条件的正交实验 由表4可知,三个因素的主次关系为:C>B>A。正交实验最佳条件为A2B2C2,即加酶量0.1%,酶解温度35 ℃,酶解时间3 h。验证实验证明,此条件下可溶性固形物含量的变化为1.7%。
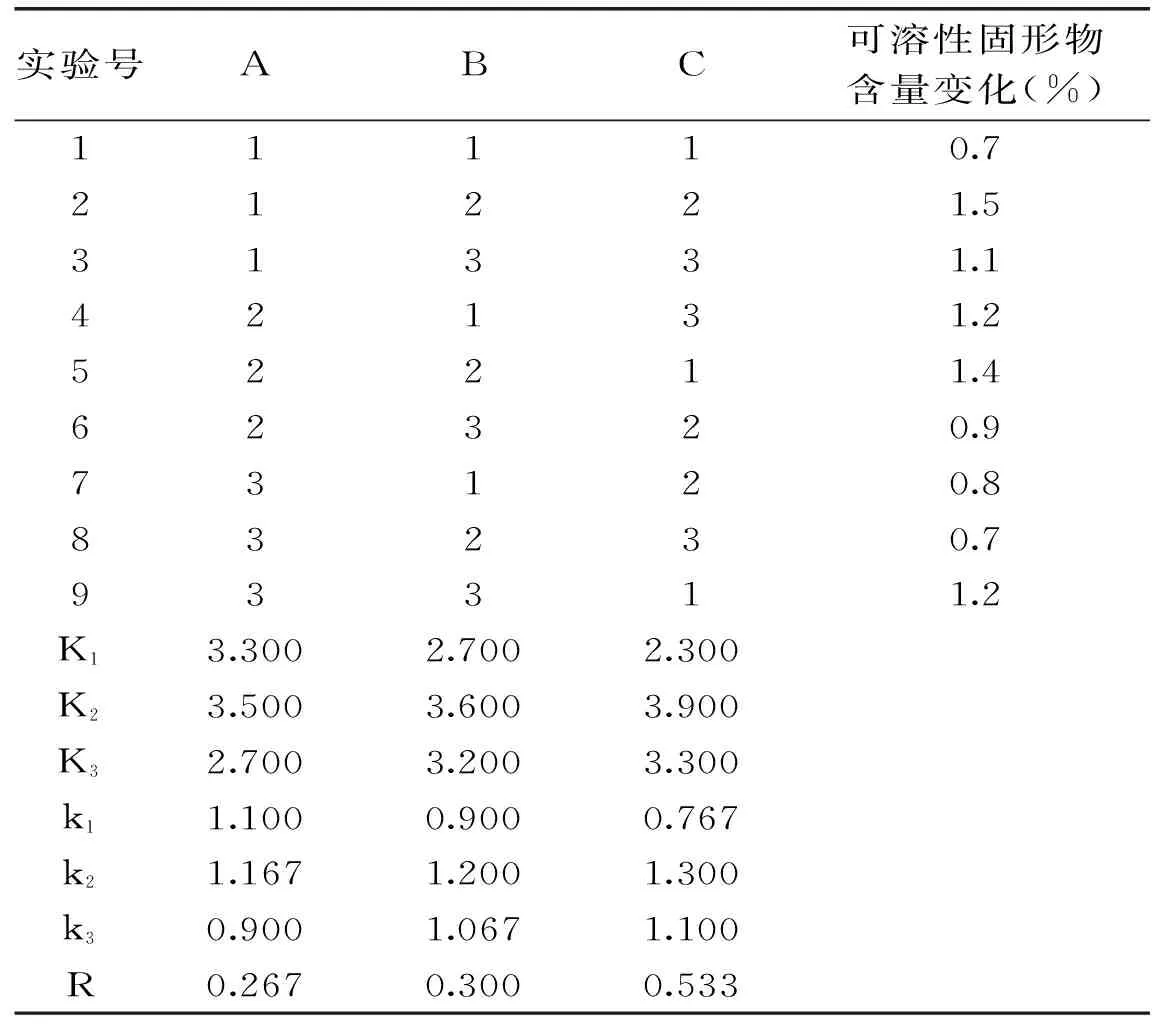
表4 酶解咖啡果肉的正交实验结果Table 4 Results of orthogonal test of enzyme treatment of the coffee pulp
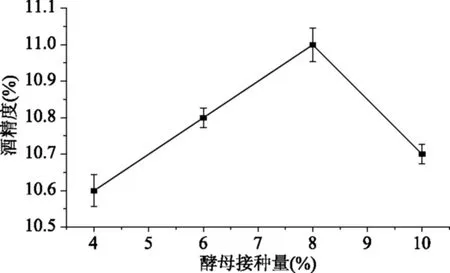
图4 酵母接种量对酒精度的影响Fig.4 Influence of the addition of yeast on degree of alcohol
2.3 果酒发酵单因素实验
2.3.1 酵母接种量的确定 由图4可知,酵母接种量8%时,酒精度为11.0%,且产品风味及口感较好;添加量为10%时酒精度为10.6%,且风味及口感都较差。说明接种量过高,酵母菌用于自身的生长繁殖消耗过多的糖分,酒精产量降低,不利于原酒风味的形成,所以酵母菌接种量以8%为宜。
2.3.2 发酵温度的确定 由图5可知,发酵温度为29 ℃时酒精度达到最高9.8%,当温度为30 ℃时酒度反而下降,可能是由于温度过高抑制了酵母菌的生长繁殖,所以以29 ℃为宜。
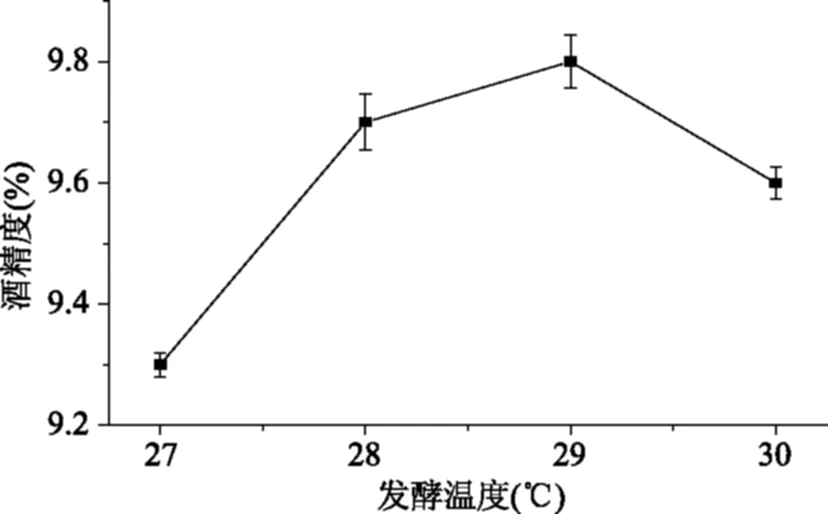
图5 发酵温度对酒精度的影响Fig.5 Influence of the fermentation temperature on degree of alcohol
2.3.3 初始糖度的确定 由图6可知,初始糖度越高,酒精度越高。当初始糖度为23%时,酒精度达到最大10.9%,但此时咖啡果酒口感不好,且仅与初始糖度22%相差0.1%。因此,应将咖啡果肉汁液的初始糖度调整为23%为宜。

图6 初始糖度对酒精度的影响Fig.6 Influence of the initial sugar content on degree of alcohol
2.3.4 Box-Behnken实验结果 实验结果见表5。
2.3.5 模型的建立及显著性实验 利用Design Expert 8.0软件中的ANOVA程序对表5所得的数据进行二次回归分析可得:Y=10.72-0.43A-0.062B+0.037C+0.025AB+0.025AC+0.050BC-0.91A2-0.085B2-0.14C2。表6方差分析显示,模型误差显著,失拟项误差不显著,模型决定系数R2为0.9401,说明建模成功。3个因素对指标值的影响次序为A>B>C。
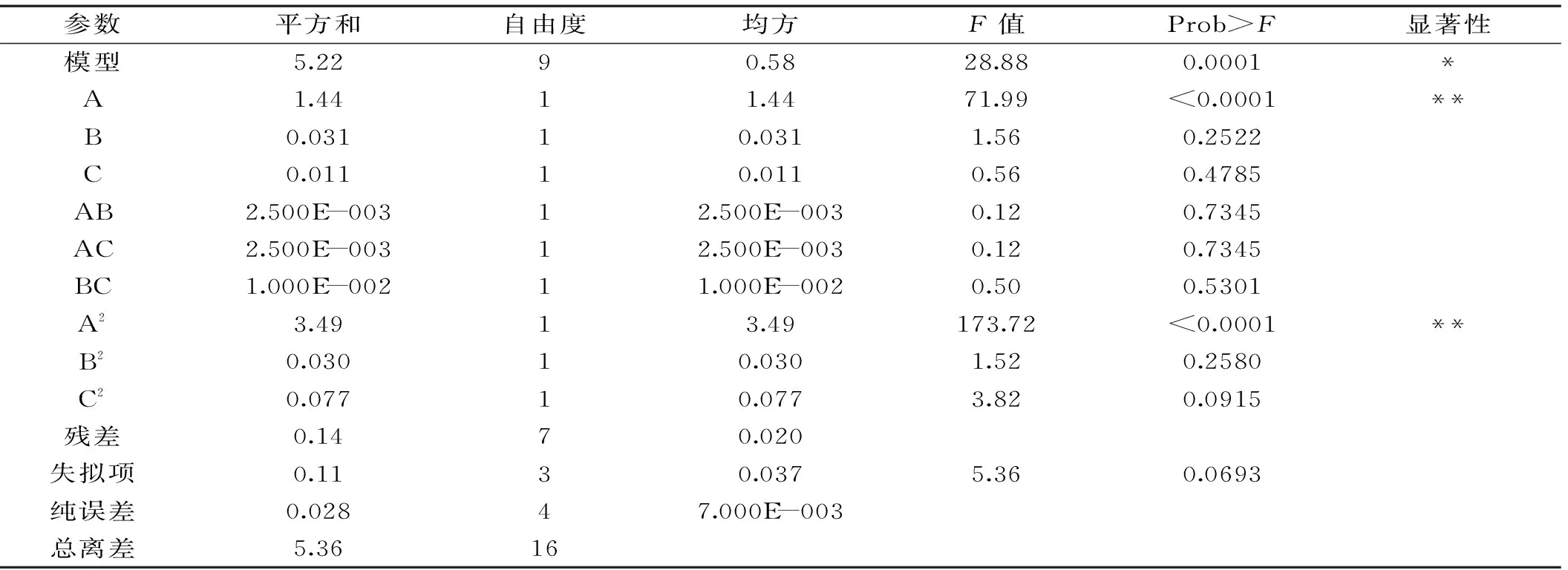
表6 回归统计分析结果Table 6 Regression analysis
注:*,差异显著,p<0. 05;**,差异极显著,p<0. 01。
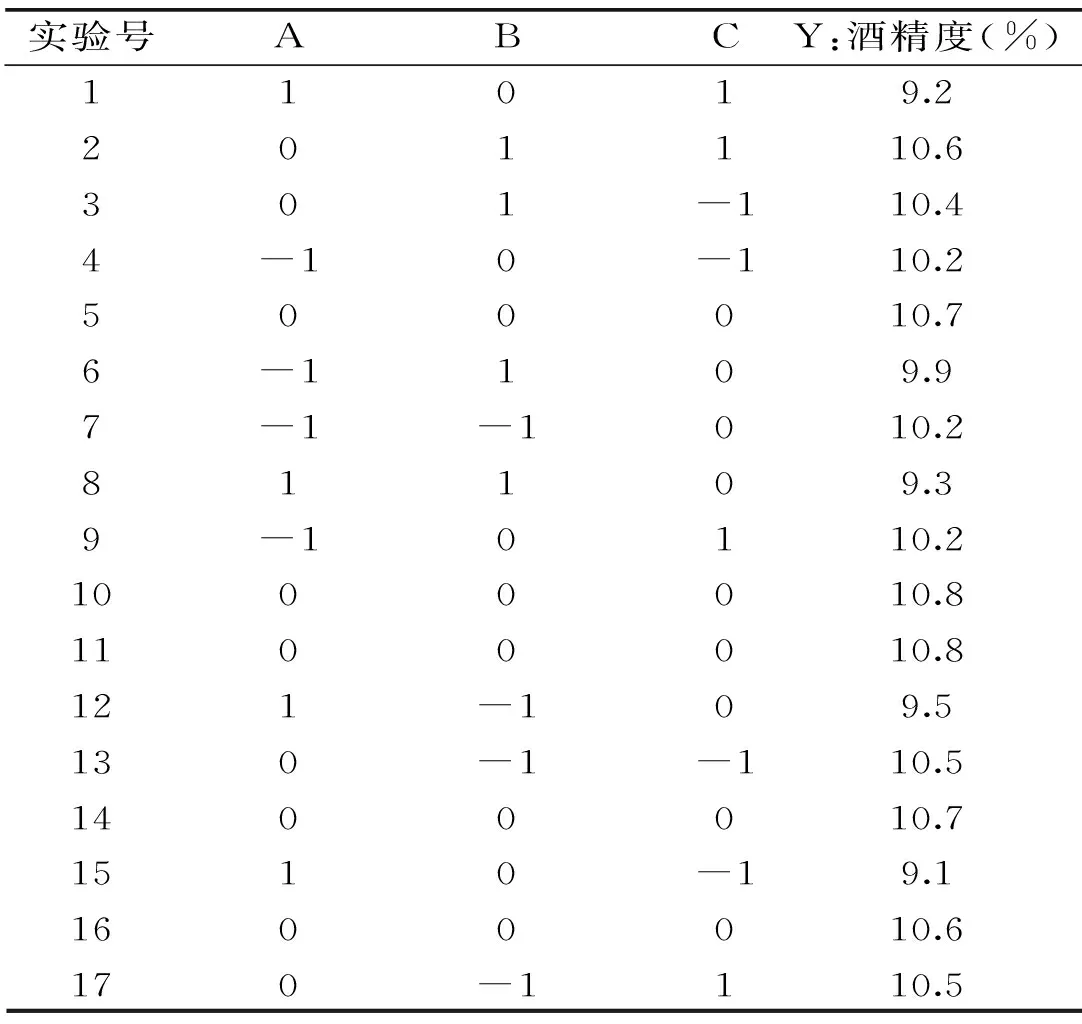
表5 响应面分析方案与结果Table 5 The scheme and results of response surface
由图7可知,响应面较陡峭,说明发酵温度和酵母接种量的交互作用对咖啡果酒的酒精度影响较大。从等高线的形状可以看出酵母的接种量对酒精度的影响大于发酵温度。
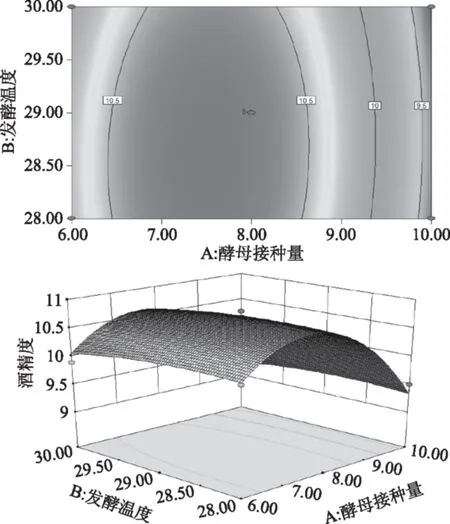
图7 酵母接种量和发酵温度交互影响酒精度的曲面图及其等高线图Fig.7 Surface layer and contour of the mutual-affection of addition of yeast and fermentation temperature on degree of alcohol
由图8可知,响应面较陡峭,说明酵母接种量和初始糖度的交互作用对酒精度的影响较大。从等高线的形状可以看出,酵母的接种量对酒精度的影响大于初始糖度。
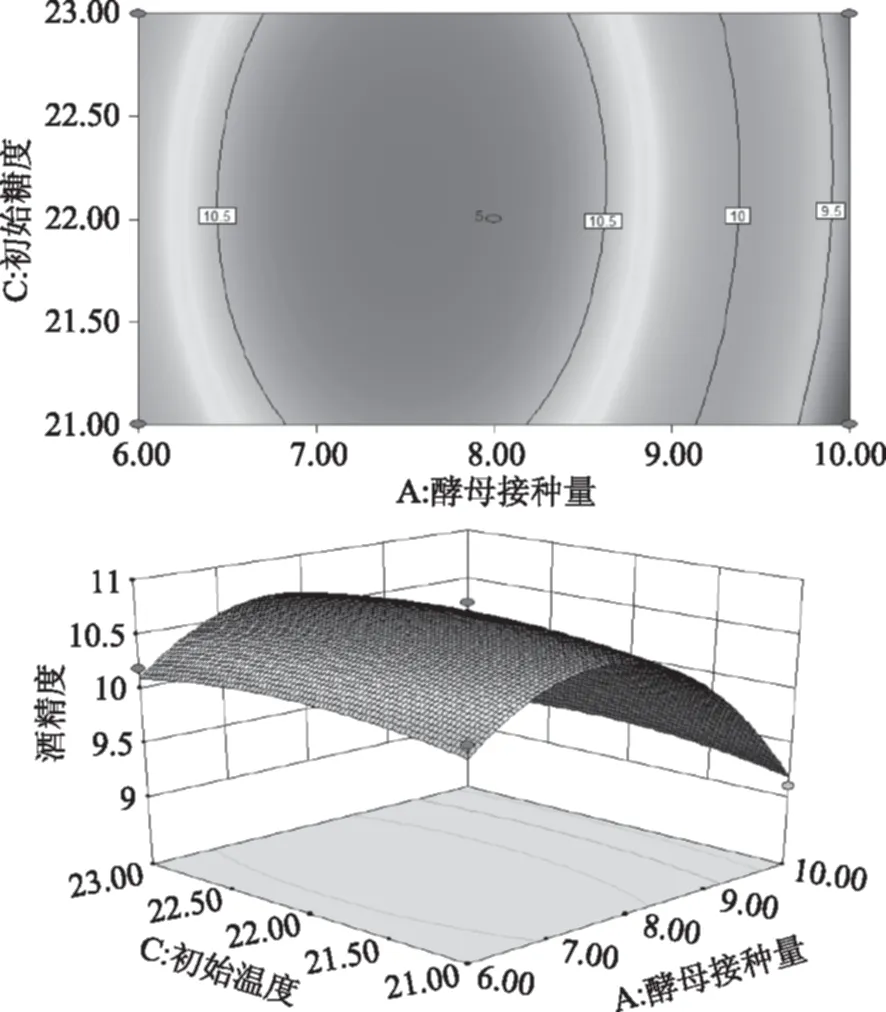
图8 酵母接种量和初始糖度交互影响酒精度的曲面图及其等高线图Fig.8 Surface layer and contour of the mutual-affection of addition of yeast and initial sugar concentration on degree of alcohol
由图9可知,初始糖度和发酵温度的交互作用对咖啡果酒的酒精度有一定的影响。从等高线的形状可知,发酵温度对酒精度的影响大于初始糖度。
图9 发酵温度和初始糖度交互影响酒精度的曲面图及其等高线图Fig.9 Surface layer and contour of the mutual-affection of fermentation temperature and initial sugar concentration on degree of alcohol
2.3.6 最佳工艺条件的预测与检验 根据Box-Behnken设计模型分析得知,咖啡果果酒酿造最优条件为:酵母接种量7.52%,发酵温度28.56 ℃,初始糖度22.04%。在此条件下,酒精度预测值为10.766%。为验证该模型的可靠性,根据实际操作,将发酵工艺参数修正为酵母接种量7.5%,发酵温度29 ℃,初始糖度22%,进行3次重复实验,实际测得的酒精度的平均值为10.8%,实验结果与模型符合较好。
2.4 咖啡果果酒发酵过程中糖度及酒精度的变化
从图10中可以看出:在整个酒精发酵过程中,酒精度随着发酵时间的延长呈上升趋势,但发酵初期酒度变化趋势缓慢,这是因为酵母菌处于有氧繁殖期,菌体繁殖快,但发酵缓慢;第2~4 d是发酵期,耗糖量最大,酒精含量迅速上升;第6~7 d发酵基本趋于平缓,酵母菌菌体及部分代谢产物沉淀,酒精含量累积到最大,这是由于高浓度的酒精对酿酒酵母的生长发酵活动有抑制作用,发酵作用减缓。酒精含量积累到最大达到10.8%,残糖量最低为0.6%,气体产生量较少。
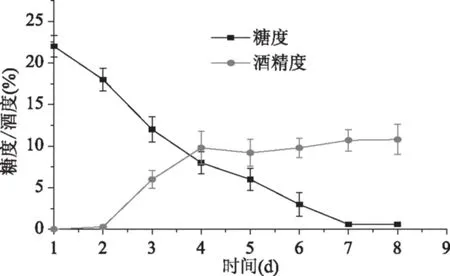
图10 酒精发酵过程中糖度和酒度的变化Fig.10 Changes of degree of alcohol and sugar content during alcohol fermentation
2.5 咖啡果果酒中咖啡因含量的测定
咖啡因含量的测定标准曲线方程为:y=0.46x-0.004,其标准差为0.998接近于1,说明根据标准方程所求值是可靠的。对冻干咖啡果粉、烘干咖啡果粉及咖啡果酒中咖啡因含量的测定,如图11所示,从中可知咖啡果酒中咖啡因的含量为34.3 mg/L。

图11 咖啡果肉及咖啡果酒中咖啡因测定结果Fig.11 Measurement results of caffeine in coffee pulp and the coffee pulp fruit wine
2.6 咖啡果果酒质量指标
2.6.1 感官指标 色泽:深琥珀色;香味:咖啡果香浓郁,气味柔和;口味:无异味,滋味纯正。
2.6.2 微生物指标 细菌总数≤50 cfu/mL,大肠菌群≤50 cfu/100 mL,致病菌:未检出。
2.6.3 理化指标 酒精度:13%;还原糖的含量(以葡萄糖计)≤4 g/L。
以上指标都符合国家果酒质量标准。
3 结论
咖啡果果酒发酵的前处理工艺条件:纤维素酶添加量0.1%,酶解温度35 ℃,酶解时间3 h,可溶性固形物含量的变化为1.7%。发酵最佳工艺条件为:酵母接种量7.5%,发酵温度29 ℃,初始糖度22%,发酵7 d,此时酒精度可达10.8%。酿制的咖啡果果酒呈深琥珀色,咖啡果香浓郁,滋味纯正且咖啡因的含量为34.3 mg/L。
[1]MUSSATTO S I,MACHADO E M S,MARTINS S,et al. Production,composition,and application of coffee and its industrial residues[J].Food and Bioprocess Technology,2011,4(5):661-672
[2]田口护(日本).咖啡豆品鉴大全[M].沈阳:辽宁科学技术出版社,2009,1:5.
[3]杨剀舟,翟晓娜,杜秉健,等.咖啡中功能性成分分离检测技术及安全性评价[J].食品科学,2014,35(3):243-252.
[4]艳霞. 神奇的果子-探密云南咖啡种植园[J]. 中外食品,2008(2):38-40.
[5]徐文静. 无公害小粒种咖啡生产技术[J]. 云南农业,2002(7):16.
[6]黄家雄,李亚男,杨世贵,等.不同产地小粒种咖啡质量比较研究[J].热带农业工程,2010,34(4):7-10.
[7]Saenger M,Hartge E-U,Werther J. Combustion of coffee husks[J].Renewable Energy,2001,23:103-121.
[8]杜华波.云南咖啡产业可持续发展探讨[J].中国热带农业,2007(5):15-17.
[9]Rajasekhar T. Studies on the utilization of coffee by products. Indian Coffee[J]. Food Chemistry,1991,40(1):8.
[10]LI J,FAN L,DING S,et al. Nutritional composition of five cultivars of Chinese jujube[J]. Food Chem,2007,103:454-460.
[11]黄锁义,覃成箭,余美科,等.益母草黄酮的提取及鉴别[J].时珍国医国药,2005,16(5):398-399.
[12]李红,郅洁,马彦梅,等.沙枣黄酮的提取及其抗氧化作用的研究[J]. 时珍国医国药,2010,21(1):35-36.
[13]LOU Z,WANG H,ZHU S,et al. Antibacterial activity and mechanism of action of chlorogenic acid[J]. Journal of Food Science,2011,76(6):398-403.
[14]张云鹤,付晓萍,刘苏瑶,等.云南小粒种咖啡果皮粗提物花青素成分及抗氧化活性研究[J].食品科技,2016,41(5):219-222.
[15]GB 5009.3-2010,食品安全国家标准 食品中水分的测定[S].
[16]GB 5009.4-2010,食品安全国家标准 食品中灰分的测定[S].
[17]GB 5009.5-2010,食品安全国家标准 食品中蛋白质的测定[S].
[18]GB/T 5009.10-2003,植物类食品中粗纤维的测定[S].
[19]GB/T 5009.6-2003,食品中脂肪的测定[S].
[20]Carl Lachat,马兆瑞.苹果酒酿造技术[M]. 北京:中国轻工业出版社,2004.
[21]Liliana Ceei,Jorge Lozano. Determination of enzymatic activities of commercial pectinases for the clarification of apple juice[J]. Food Chemistry,1998,61(1):237-240.
[22]王钦德,杨坚.食品实验设计与统计分析[M].中国农业大学出版社,2003:331-383.
[23]袁辉,白云凤.中心组合和响应面分析优化枇杷果酒发酵工艺[J].中国酿造,2010(2):103-106.
[24]麻成金,李加兴,付伟昌,等.枇杷果酒酿造工艺研究[J]. 食品与机械,2006,22(3):54-56.
[25]范兆军,牛广财,朱丹,等.响应面法优化沙棘果酒发酵条件的研究[J]. 食品与机械,2009,25(1):41-45.
[26]黄伟坤.食品检验与分析[M].中国轻工业出版社,1989:20-21.
Study on the wine brewing technology of coffee pulp grown in Yunnan province
LIU Jing,FU Bing,LIU Su-yao,QU Hai-pan,LUO Hao-ran,YUAN Wei*
(College of Food Science and Technology,Yunnan Agricultural University,Kunming 650000,China)
Coffee pulp was used as material. Orthogonal test and response surface as an approach were to optimize the conditions of pretreatment and fermentation process. The results showed that:the optimum pretreatment conditions were as follows:additive amount of cellulase as 1%,enzymolysis temperature of 35 ℃,hydrolysis time of 3 h,and the content of soluble solids change the most of 1.7%.The optimized fermentation conditions were as follows:inoculums size of yeast 7.5%,the sugar degree of fermentation 22%,fermentation temperature 29 ℃,and the fermentation time for 7 d as well as the alcohol content about 10.8%. The coffee pulp fruit wine possessed amber,rich coffee flavor and clarity. The content of caffeine was 34.3 mg/L.
coffee pulp;enzyme hydrolysis;fermentation;wine
2016-11-01
刘静(1991-),女,硕士,研究方向:农产品加工及贮藏工程,E-mail:18213146702@163.com。
*通讯作者:袁唯(1957-),男,硕士,教授,研究方向:园艺产品贮藏与加工原理与技术,E-mail:yuanwei779@163.com。
云南省建立农科教相结合新型农业社会服务化体系试点云咖啡项目(2014NG004)。
TS273
A
1002-0306(2017)10-0194-06
10.13386/j.issn1002-0306.2017.10.029

