牛奶中β-内酰胺酶抑制剂
——舒巴坦直接竞争ELISA的分析研究
沙芳芳,刘卫华,王 敬,于文龙,王向红
(河北农业大学食品科技学院,河北保定 071001)
牛奶中β-内酰胺酶抑制剂
——舒巴坦直接竞争ELISA的分析研究
沙芳芳,刘卫华,王 敬,于文龙,王向红*
(河北农业大学食品科技学院,河北保定 071001)
建立代表性的β-内酰胺酶抑制剂-舒巴坦直接竞争酶联免疫吸附分析法(dcELISA)。通过对封闭液浓度、离子浓度、pH、包被条件等分析条件优化后建立dcELISA,并进行应用。结果表明方法的IC50为5.25 ng/mL,IC15为1.07×10-3ng/mL,板内和板间平均变异系数分别为6.69%、9.02%,对他唑巴坦和克拉维酸的交叉反应率分别是7.12%、0.93%。牛奶样品的添加回收率在85.66%~89.23%之间。该方法灵敏度较高,稳定性较好,特异性较强,可以应用于乳制品中舒巴坦残留的快速检测。
舒巴坦,直接竞争酶联免疫法,检测方法
舒巴坦(sulbactam,SBT),又称青霉烷砜酸,是一种竞争性不可逆的β-内酰胺酶抑制剂,对革兰氏阳性和阴性菌产生的大多数β-内酰胺酶有较强的抑制作用[1]。已有研究证明,舒巴坦可引起乳酸脱氢酶、碱性磷酸酶和转氨酶的升高,还可能引起过敏反应,并能透过胎盘到达胎儿体内,危害健康[2-3]。
我国非常重视食品安全,农业部235号公告[4]对乳品中抗生素残留作出了严格规定。一些不法分子为了逃避抗生素检测,在乳品中加入β-内酰胺酶分解残留的抗生素。因此,国家在“打击非法添加非食用物质和滥用食品添加剂”专项整治行动中,将β-内酰胺酶列为非食用物质且禁止在食品中添加。某些商家又为了逃避β-内酰胺酶的检测,将舒巴坦添加到乳品中,使β-内酰胺酶失去活性,不能被检出[5-6],给乳品埋下安全隐患,严重威胁消费者的身体健康。
国内外常用的舒巴坦检测方法主要有分光光度法[7-8]、高效液相色谱(HPLC)[9-12]、高效液相色谱-质谱(HPLC-MS)[13-15]。姜红[16]等人采用分光光度法测定注射用头孢哌酮钠和舒巴坦钠的含量。该方法灵敏度较低,且多用于药物中舒巴坦的测定。林钦[17]利用高效液相色谱同时测定乳制品中的克拉维酸、他唑巴坦和舒巴坦。张立[18]等人利用超高压液相色谱-串联质谱法同时测定牛奶中的β-内酰胺类抗生素(头孢噻肟、头孢哌酮)和其酶抑制剂(舒巴坦、他唑巴坦)。这些仪器分析方法样品前处理复杂,所需仪器昂贵,对操作人员要求较高,不适用于现场大批量样品的快速检测[19]。现阶段,关于牛奶中舒巴坦检测的酶联免疫吸附法(ELISA)还未见报道。基于抗原抗体特异性反应建立的酶联免疫分析法,灵敏度高、特异性强、操作简便、不需要复杂仪器设备[20],适用于现场大通量样品的检测,在我国有非常广泛的应用前景。而与间接竞争ELISA相比,直接竞争ELISA简化了检测步骤,缩短了检测时间,在实际应用中具有显著优势。
本研究旨在建立一种直接竞争ELISA法,用于牛奶中舒巴坦的快速检测,以期为乳品安全提供更有效的保障,切实保障消费者的身体健康。
1 材料与方法
1.1 材料与仪器
舒巴坦(SBT)、辣根过氧化酶(HRP) 上海源叶科技有限公司;牛血清白蛋白(BSA)、四甲基联苯胺(TMB) Sigma公司;抗SBT多克隆抗体 本实验室自制;96孔酶标板 美国Costar;NaNO2、Na2CO3、NaHCO3、NaH2PO4、Na2HPO4、NaCl(分析纯) 天津市科密欧试剂有限公司;免疫动物 雄性新西兰大耳白(10周龄),1.5~2.0 kg。
酶标仪、洗板机 美国Thermo公司;八道微量可调移液枪 德国eppendorf公司;电子感量分析天平 北京赛多利斯仪器有限公司;MS3 digital涡旋混匀器 德国IKA公司;pH计 梅特勒-托利多仪器有限公司;TDL-5冷冻离心机 上海Anke;电热恒温培养箱 天津泰斯特仪器有限公司。
1.2 实验方法
1.2.1 缓冲溶液的配制
1.2.1.1 包被缓冲液(CBS,pH=9.6) 准确称取1.6 g Na2CO3与2.9 g Na3HCO3,加双蒸水至1000 mL,调节pH至9.6。
1.2.1.2 磷酸盐缓冲液(5×PBS) 准确称取NaCl 45 g,Na2HPO4·12H2O 68.8 g,NaH2PO4·2H2O 8.97 g,加双蒸水至1000 mL,并调节pH至7.4。
1.2.1.3 洗涤液(PBST) 取200 mL 5×PBS缓冲溶液,双蒸水800 mL,10% Tween-20 5 mL,充分混匀后待用。
1.2.1.4 封闭液 5%(w/v)的BSA/PBS溶液。
1.2.1.5 底物液 为3,3′,5,5′-四甲基联苯胺(TMB)-过氧化氢脲溶液,配制方法如下:
底物A:取β-糊精0.25 g,无水醋酸钠0.82 g,过氧化氢脲 42.86 mg,加双蒸水至100 mL,柠檬酸调节pH至5.0,4 ℃保存,使用时需恢复室温;
底物B:取3,3′,5,5′-四甲基联苯胺100 mg溶于10 mL二甲基亚砜;
使用前15 min,将底物A与底物B进行混合。
1.2.1.6 终止液 1.25 mol/L硫酸。
1.2.2 动物免疫程序 选取10周龄左右,体重为2 kg左右的新西兰大耳白兔,在标准实验动物房中饲养。观察一周之后,确定身体状况正常后进行免疫。分别采取多点皮下和大腿肌肉注射法进行免疫。初次免疫人工抗原的量均是1 mg/只,分别于初次免疫后2、4、6、8周进行加强免疫。第二、三、四、五次加强免疫完后10 d,兔子耳缘静脉取血后进行抗血清效价与特异性的测定。第五次加强免疫后10 d进行心脏取全血,4 ℃离心15 min,收集全部血清。
1.2.3 抗体的纯化 采用Protein A-Sephaorse 4B亲和层析法对抗体进行纯化。以1×PBS为空白,在280 nm处测吸光度值,计算抗体浓度。
1.2.4 ELISA操作步骤 包被:用CBS稀释抗血清,4 ℃包被过夜;封闭:PBST洗板3次,加入封闭液,37 ℃封闭1 h;加样:PBST洗板3次,用1×PBS将SBT标准品稀释成10000、1000、10、1、0.01、0.0001 ng/mL,50 μL/well,再加入50 μL稀释到最佳倍数的酶标抗原,并设空白和阴性对照,37 ℃孵育1 h;显色:PBST洗板5次,加入TMB显色剂,37 ℃显色30 min;终止:加入终止液,用酶标仪在450 nm下测定OD值。
1.2.5 直接ELISA反应体系条件的优化
1.2.5.1 抗SBT抗体与酶标抗原最佳工作浓度的确定 采用矩阵法确定直接竞争ELISA法的抗SBT抗体与酶标抗原最佳工作浓度。用1×PBS将初始浓度为653.55 μg/mL的抗体依次稀释为16、14、12、10、8、6、4、0 μg/mL,加入96孔酶标板,4 ℃包被过夜;PBST洗板3次,加入封闭液,37 ℃封闭1 h;PBST洗板3次,加入用PBS梯度稀释的酶标抗原,37 ℃孵育1 h;PBST洗板5次,加入TMB显色剂,37 ℃显色30 min;加入终止液,用酶标仪在450 nm下测定OD值,以OD值为1.0左右确定抗SBT抗体与酶标抗原最佳工作浓度。
1.2.5.2 封闭液浓度的优化 将抗SBT抗体稀释至最佳工作浓度,包被过夜;采用不同浓度(0%、2.5%、5%、10%)的牛血清白蛋白(BSA)磷酸盐缓冲液进行封闭,再依次进行加样、显色和终止步骤。选择OD为1.0左右,灵敏度高的封闭液浓度作为最佳条件。
1.2.5.3 离子浓度的优化 将抗SBT抗体稀释至最佳工作浓度,包被过夜;用最适浓度的牛血清白蛋白(BSA)磷酸盐缓冲液进行封闭;采用不同的离子强度(双蒸水、1×PBS、2×PBS、3×PBS、4×PBS、5×PBS)稀释SBT标准品后,进行加样,显色和终止步骤。选择OD为1.0左右,灵敏度高的离子浓度作为最佳条件。
1.2.5.4 pH的优化 将抗SBT抗体稀释至最佳工作浓度,包被过夜;用最适浓度的牛血清白蛋白(BSA)磷酸盐缓冲液进行封闭;采用不同pH的磷酸盐缓冲液(4.5、5.5、6.5、7.5、8.5、9.5)稀释SBT标准品后,进行加样,显色和终止步骤。选择OD为1.0左右,灵敏度高的pH作为最佳条件。
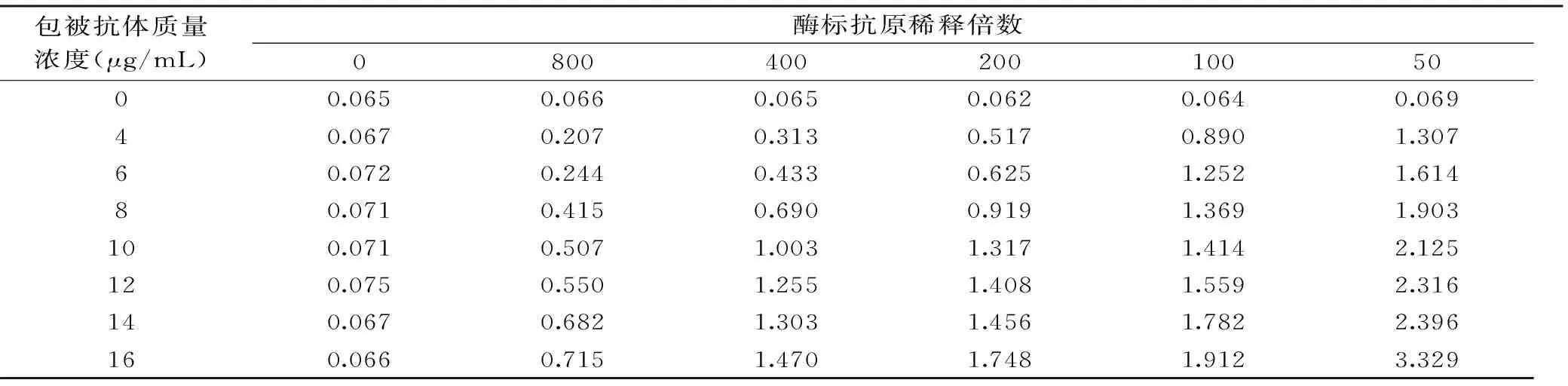
表1 SBT抗体与酶标抗原稀释度的确定Table 1 The optimum concentration of SBT antibody and enzyme labeled antigens
1.2.5.5 包被条件的确定 将抗SBT抗体稀释至最佳工作浓度,采用不同的条件(4 ℃过夜、37 ℃孵育1 h、37 ℃孵育2 h)进行包被;用最适浓度的牛血清白蛋白(BSA)磷酸盐缓冲液进行封闭;采用最适pH的磷酸盐缓冲液稀释SBT标准品后,进行加样,显色和终止步骤。选择OD为1.0左右,灵敏度高的包被条件作为最佳条件。
1.2.6 标准曲线绘制 在最优工作条件下,将SBT标准品稀释为10000、1000、10、1、0.01、0.0001 ng/mL,采用直接竞争ELISA法,以SBT浓度的对数为横坐标X,抑制率为纵坐标Y,绘制标准曲线,并确定其灵敏度(IC50)、最低检测限(IC15)以及线性检测范围。抑制率计算公式如下:
式(1)
1.2.7 抗体特异性与精密度
1.2.7.1 特异性 他唑巴坦、克拉维酸与SBT都属于β-内酰胺酶的抑制剂,三者结构相近。将他唑巴坦、克拉维酸配成不同质量浓度的溶液作为待测样品,采用直接竞争ELISA法检测,按式(2)计算交叉反应率。
式(2)
1.2.7.2 精密度 对建立的ELISA方法进行板内与板间变异系数的分析测定。板内和板间变异系数分别是同一包被批次与不同包被批次的SBT标准曲线的变异系数。
1.2.8 样品的检测
1.2.8.1 样品的前处理 准确称取牛奶样品15 g,加入5 mL三氯醋酸(TCA,300 g/L),高速涡旋5 min后,于5000 r/min离心15 min,取上清液,加入NaOH调节pH到7.0。将牛奶样品处理后所得的上清液,用1×PBS分别进行0倍、10倍、20倍、40倍、80倍稀释后,绘制基质曲线,再与标准曲线进行对比,以考察样品基质的影响。
1.2.8.2 添加回收率测定 向空白牛奶中分别添加25、50、100 μg/kg的标准品,按照1.2.7.1方法进行样品处理,dcELISA测定样品中SBT浓度,每个样品设3个重复,计算回收率。
2 结果与分析
2.1 直接ELISA反应体系条件的优化
2.1.1 SBT抗体与酶标抗原最适工作浓度 通过方阵法选择OD值为1.0左右的SBT抗体包被质量浓度与酶标抗原的稀释度为最佳工作浓度,实验结果见表1:
由表1可知,包被抗体的最适质量浓度为10.0 μg/mL,酶标抗原最佳稀释倍数为400。
2.1.2 封闭液浓度的优化 由图1可以看出随着封闭液浓度的增加,OD值降低,后期逐渐平稳。这主要是因为,随着封闭液浓度的增加,游离的结合位点逐渐减少,则结合的酶标抗原也相应减少;当封闭液能够完全封闭酶标板上的结合位点后,则酶标抗原也不会与板上的位点结合,此时再增加封闭液的浓度,OD值也不减少。当封闭液浓度达到5%时,OD值基本稳定在1.0左右,且IC50与封闭液浓度为10%时相差不大,所以选择5%的BSA作为封闭液。
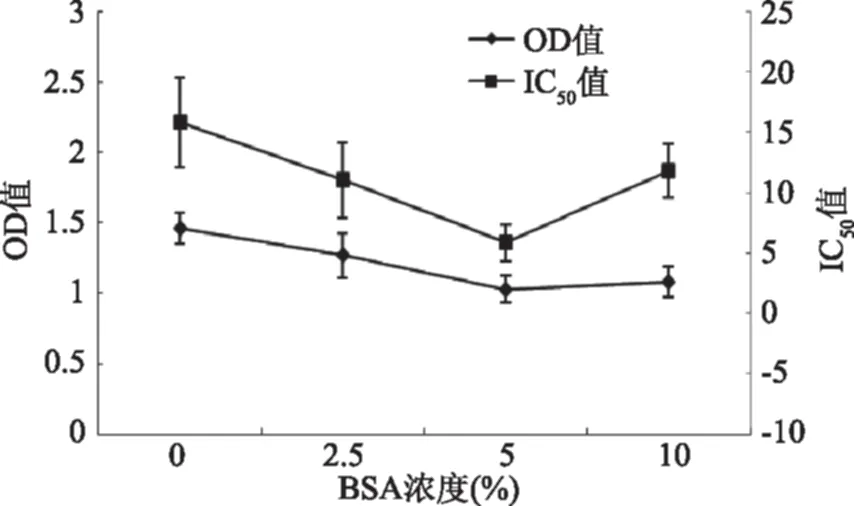
图1 封闭液浓度的优化Fig.1 The selection experiment of blocking solution concentration
2.1.3 离子浓度的优化 在选定的条件下,比较了双蒸水、1×PBS、2×PBS、3×PBS、4×PBS、5×PBS对ELISA反应体系的影响。由图2可以看出OD值随着离子浓度的增加逐渐减小。当离子浓度是1×PBS时,OD值在1.0左右,且IC50最低,故选择1×PBS作为最适工作浓度。
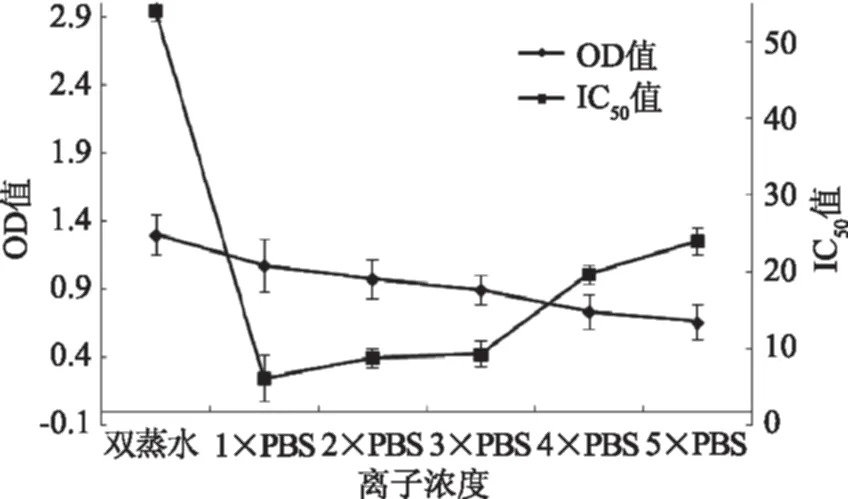
图2 离子浓度的优化Fig.2 The optimization of ion concentration
2.1.4 pH的优化 在选定的条件下,比较了不同pH缓冲液对ELISA反应体系的影响,为后续样品的测定条件提供借鉴。由图3看出,随着pH的升高OD逐渐降低;而IC50先降低,于过碱的条件下又升高。当缓冲液pH为7.5时,OD为1.0左右,且IC50最低,所以选择7.5为最佳反应条件。
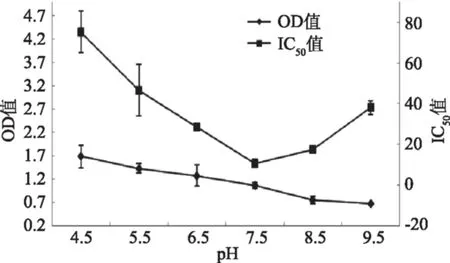
图3 pH的优化Fig.3 The optimization of pH value
2.1.5 包被条件的优化 在所确定的条件下,比较了4 ℃过夜、37 ℃孵育1 h和37 ℃孵育2 h三种包被条件的OD值和IC50。由图4可以看出,当包被条件为4 ℃过夜时,OD值较大,并且IC50最低,因此选其作为最佳包被条件。
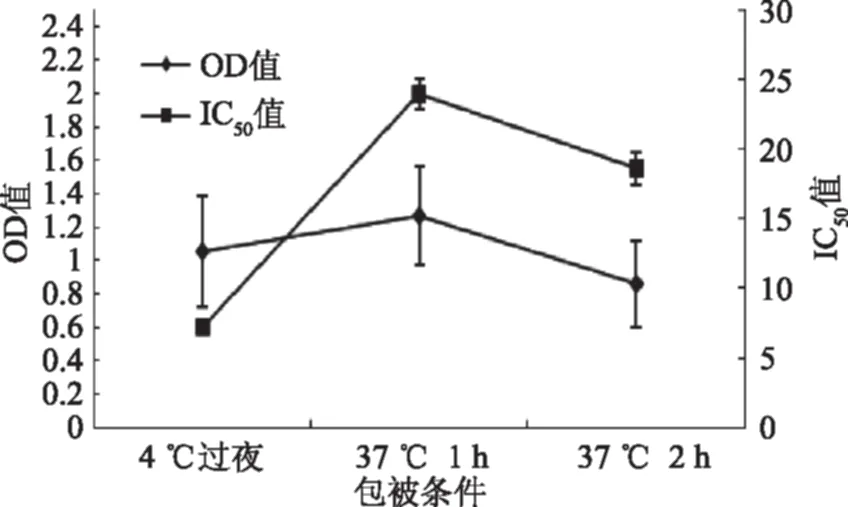
图4 包被条件的优化Fig.4 The optimization of different conditions of coating
2.2 标准曲线的绘制
将SBT标准品稀释为10000、1000、10、1、0.01、0.0001 ng/mL,在确定的最优条件下绘制标准曲线,并进行方程的拟合(见图5),拟合方程为Y=4.121X+43.17(R2=0.9941),IC50是5.25 ng/mL,IC15可以达到1.07×10-3ng/mL,灵敏度较高。
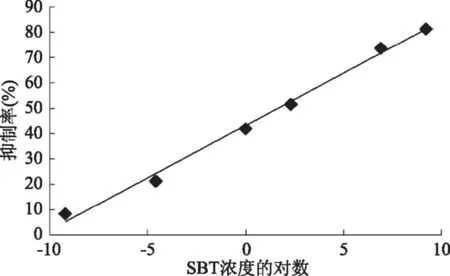
图5 舒巴坦标准曲线的拟合Fig.5 Equation fitting of standard curve for detecting sulbactam
2.3 抗体的特异性
用上述所建立的直接竞争ELISA法对舒巴坦的结构类似物他唑巴坦和克拉维酸进行直接竞争实验。实验结果(表2)表明,抗体对他唑巴坦和克拉维酸的交叉反应率分别为7.12%、0.93%,说明实验获得的抗体具有很高的特异性。

表2 SBT抗体对他唑巴坦、克拉维酸的交叉反应率Table 2 The Cross-reactivity of tazobactam,clavulanic acid
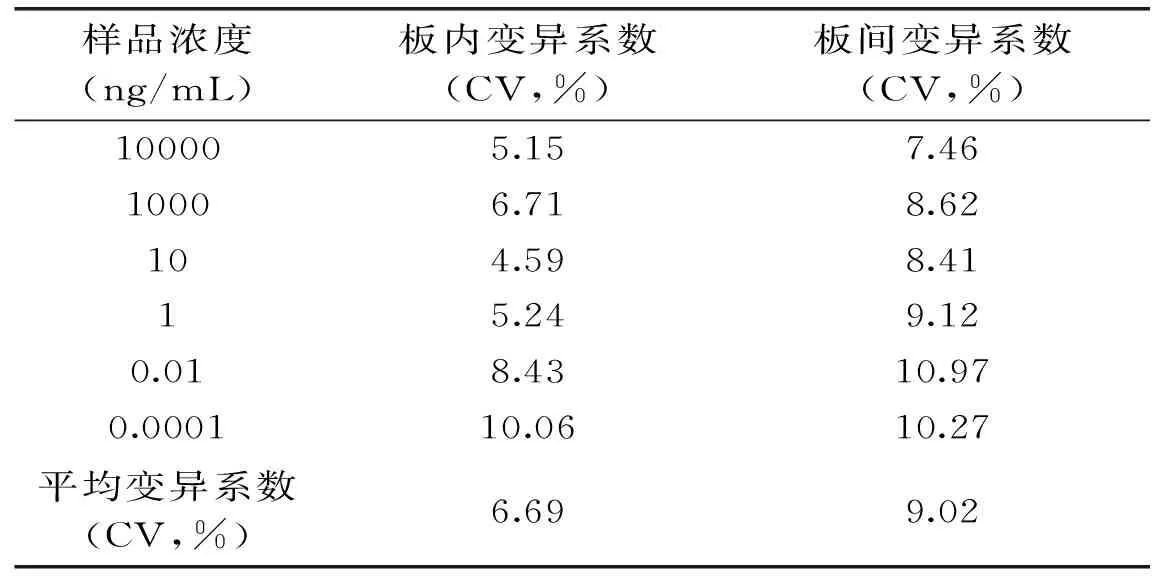
表3 板内与板间变异实验Table 3 Plate variation with inter-assay and intra-assay
2.4 方法的精密度
通过对板内与板间系数的分析,确定板内变异系数与板间平均变异系数分别是6.69%、9.02%。因此,该方法的准确性比较高,可以满足食品中SBT检测的要求。
2.5 样品的添加回收率
2.5.1 样品的基质消除 如图6所示,未经稀释的、稀释10倍的与稀释20倍的牛奶样品上清液的基质曲线与标准曲线均不能重合,说明基质影响没有消除。而样品上清液经过40倍稀释后绘制的基质曲线与标准曲线均基本吻合,说明基质影响基本消除。因此,样品提取液稀释40倍后可以直接用于dcELISA检测。
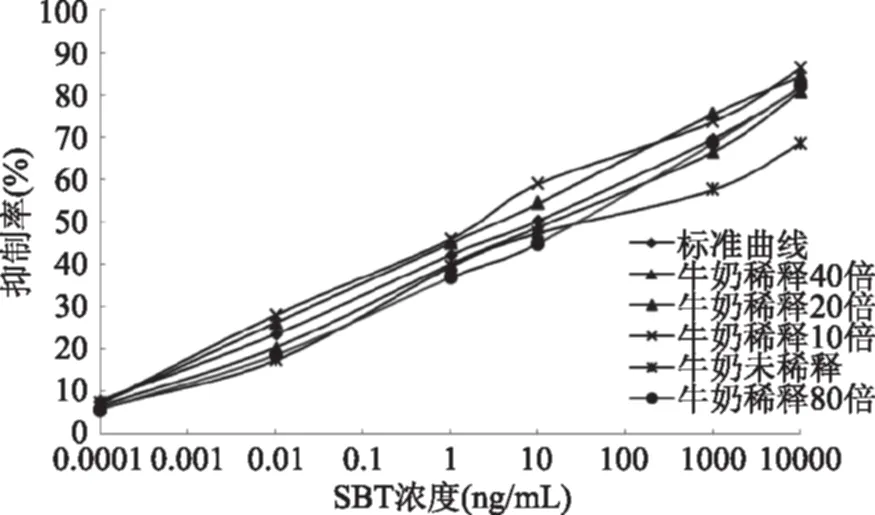
图6 牛奶曲线与标准曲线的比较Fig.6 Comparison between curves of SBT in milk and standard curve of SBT
2.5.2 添加回收率 在阴性牛奶样品中分别添加不同量的SBT标准品,每一浓度重复5次,求出平均ELISA结果,计算添加回收率(见表4)。结果显示回收率在85.66%~89.23%之间,变异系数为1.19%~6.59%。

表4 牛奶的添加回收实验(n=5)Table 4 Test of recovery in milk(n=5)
3 结论
通过对直接竞争ELISA反应体系中封闭液浓度、离子浓度、包被条件和pH进行优化,建立了舒巴坦直接竞争ELISA分析方法。该方法的IC50值为5.25 ng/mL,IC15值为1.07×10-3ng/mL,检测的线性范围为0.0001~1000 ng/mL。抗体与同属于β-内酰胺酶抑制剂的他唑巴坦和克拉维酸的交叉反应率较低,分别为7.12%、0.93%。该方法对牛奶平均回收率在85.66%~89.23%之间,变异系数为1.19%~6.59%,灵敏度较高,稳定性好,可以应用于乳制品中舒巴坦残留的快速和大批量检测。本实验室以此实验为基础,正在进行电化学免疫传感器的研究,以期可以建立更加灵敏、快速的舒巴坦检测方法。
[1]刘珊珊,单艺,满朝新,等. 高效液相色谱-二极管阵列检测法测定原料乳中的舒巴坦[J]. 食品工业科技,2012,33(16):64-66.
[2]马晓斐,张敬轩,李挥,等. 超高效液相色谱-串联质谱法同时测定液态奶中克拉维酸和舒巴坦[J]. 食品科学,2013,34(16):257-260.
[3]薛霞,王骏,刘桂亮,等. 亲水作用色谱-串联四极杆质谱测定液态奶中舒巴坦[J]. 分析测试学报,2012,31(6):700-704.
[4]农业部.中华人民共和国农业部第235号公告. 动物性食品中兽药最高残留限量[Z].2002.
[5]郭启雷,王浩,杨红梅,等. 液相色谱-串联质谱法测定牛奶中舒巴坦和他唑巴坦[C].质谱学报,2009,30(增刊):162-164.
[6]丁红梅,李进军,李静. 原料乳中舒巴坦的测定——高效液相色谱仪-二极管阵列检测法[J]. 食品安全导刊,2015(33):97-98.
[7]全红,白小红,杜江. 分光光度法测定注射用头孢哌酮钠/舒巴坦钠药物含量[J]. 山西医科大学学报,2003,34(6):573-574.
[8]Vu Dang Hoang,Nguyen Thi Loan,Vu Thi Tho,et al. UV spectrophotometric simultaneous determination of cefoperazone and sulbactam in pharmaceutical formulations by derivative,Fourier and wavelet transforms[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2014,121:701-714.
[9]Dinc E,Baleanu D,Kucukbagriacik E. Ultra Performance Liquid Chromatography for the Quantitative Analysis of Ampicillin Sodium and Sulbactam Sodium in a Pharmaceutical Preparation[J]. Revista de Chimie-Bucharest-Original Edition,2012,63(5):451-454.
[10]Qi Pei,Guo-Ping Yang,Zuo-Jun Li,et al. Simultaneous analysis of amoxicillin and sulbactam in human plasma by HPLC-DAD for assessment of bioequivalence[J]. Journal of Chromatography B,2011,879(21):2000-2004.
[11]A J Shah,M W Adlard,J D Stride. A sensitive assay for clavulanic acid and sulbactam in biological fluids by high-performance liquid chromatography and precolumn derivatization[J]. Journal of Pharmaceutical and Biomedical Analysis,1990,8(5):437-443.
[12]Jun Haginaka,Yuki Nishimura. Simultaneous determination of ampicillin and sulbactam by liquid chromatography:post-column reaction with sodium hydroxide and sodium hypochlorite using an active hollow-fibre membrane reactor[J]. Journal of Chromatography B:Biomedical Sciences and Applications,1990,532:87-94.
[13]彭力,陈华,徐波,等. 高效液相色谱梯度洗脱法测定注射用美洛西林钠-舒巴坦钠中有关物质[J]. 中南药学,2013(6):462-466.
[14]Zhou Y,Zhang J,Guo B,et al. Liquid chromatography/tandem mass spectrometry assay for the simultaneous determination of cefoperazone and sulbactam in plasma and its application to a pharmacokinetic study[J]. Journal of Chromatography B Analytical Technologies in the Biomedical & Life Sciences,2010,878(30):3119-3124.
[15]郑小严,林钦,游飞明,等. 超高效液相色谱-串联四极杆质谱法同时检测乳制品中β-内酰胺酶抑制剂克拉维酸钾、他唑巴坦和舒巴坦的残留量[J]. 分析实验室,2013(7):47-51.
[16]姜红,范艺腾. 导数分光光度法测定注射用头孢哌酮钠和舒巴坦钠的含量[J]. 华西药学杂志,1999,14(z1):401-402.
[17]林钦. 高效液相色谱法同时检测乳制品中3种β-内酰胺酶抑制剂的残留量[J]. 色谱,2013,31(5):441-446.
[18]张立,李娜思,冯峰,等. 超高压液相色谱-串联质谱法测定牛奶中的β-内酰胺类抗生素及其酶抑制剂[J]. 食品安全质量检测学报,2013(6):1821-1827.
[19]奚茜,张明洲,李沐洁,等. 链霉素残留检测直接竞争ELISA法的建立[J]. 中国食品学报,2013,13(11):124-131.
[20]陶光灿,李勇,崔廷婷,等. 酶联免疫吸附法检测动物源性食品中氨苯砜残留[J]. 食品与生物技术学报,2013,32(7):778-783.
Research on the direct competition ELISA analysis ofβ-lactamase inhibitor-sulbactam in milk
SHA Fang-fang,LIU Wei-hua,WANG Jing,YU Wen-long,WANG Xiang-hong*
(College of Food Science & Technical,Agricultural University of Hebei,Baoding 071001,China)
The aim of this study was to establish a direct competitive enzyme-linked immunoassay(dc-ELISA)method to detect the representativeβ-lactamase inhibitor-sulbactam in dairy products. After analyzing the condition of blocking solution concentration,ion concentration,coating conditions,pH,and other optimization,this developed method presented an IC50of 5.25 ng/mL,a detection limit IC15of 1.07×10-3ng/mL. Intra-and inter-batch relative standard deviations(RSD)were 6.69%,9.02%,respectively. The cross-reactivity rates for tazobactam and clavulanic acid were 7.12%,0.93%,respectively. The recoveries of milk in spiked samples ranged from 85.66%~89.23%. The developed dcELISA method was satisfied for the the field of mass rapid screen of sulbactam residue in milk samples.
sulbactam;dcELISA;test method
2016-11-08
沙芳芳(1991-),女,硕士研究生,研究方向:食品安全,E-mail:shp14181514@163.com。
*通讯作者:王向红(1973-),博士,教授,研究方向:食品科学,E-mail:wangxianghong@hebau.edu.cn。
国家重点研发计划 (2016YFD0401101);河北省科技支撑项目(152776120D)。
TS207.3
A
1002-0306(2017)10-0067-05
10.13386/j.issn1002-0306.2017.10.005

