高效液相色谱法测定山楂叶中的9种酚类成分
杨晓博,王荣芳,贾亚楠,毕振良,陆凤琴,崔 同,*
(1.河北农业大学食品科技学院,河北保定 071000;2.兴隆县林业局,河北承德 067000)
高效液相色谱法测定山楂叶中的9种酚类成分
杨晓博1,王荣芳1,贾亚楠1,毕振良2,陆凤琴2,崔 同1,*
(1.河北农业大学食品科技学院,河北保定 071000;2.兴隆县林业局,河北承德 067000)
利用反相高效液相色谱法同时测定山楂叶中的9种酚类成分。结果表明,9种酚类成分在2~500 μg/mL之间呈良好的线性关系,r介于0.9995~0.9999。加标回收率为93.7%~110.2%,相对标准偏差在0.69%~4.58%之间。对29个品种的山楂叶进行测定,9种酚类成分的平均含量由低到高依次为:异槲皮苷、金丝桃苷、原花青素C1、原花青素D1、表儿茶素、原花青素B2、绿原酸、红果酸、牡荆素鼠李糖苷。其中黄酮和酚酸含量较高,达15 mg/g D.W左右,原花青素类成分含量达6 mg/g D.W。该方法具有简便、准确的优点。
高效液相色谱法,山楂叶,原花青素,红果酸,黄酮
山楂(CrataeguspinnatifidaBge.var.majorN.E. Br.)为蔷薇科山楂属植物。山楂及山楂叶作为中药材早在《本草经集注》和东晋葛洪的《肘后备急方》[1]中便有记载。山楂叶的现代药学研究起源于上世纪80年代前后联邦德国开展的系统研究,并开发出一种用于NYHA Ⅰ~Ⅱ级心脏病治疗的标准化山楂提取物[2]。上世纪末中国学者也曾以同属的中国山楂叶为原料,开发出山楂叶黄酮药物,并被《中国药典》所收录[3]。目前,还有多名学者利用山楂提取物做NYHA I~II级心脏病的临床研究[4]。山楂叶中不仅含有黄酮类成分,而且还含有原花青素和酚酸等酚类成分[5-7]。
近年来,部分学者曾采用HPLC法分别对山楂叶中的绿原酸、牡荆素葡萄糖苷、牡荆素鼠李糖苷、金丝桃苷和槲皮素等成分进行了分析[8-10],但未涉及原花青素等成分。欧洲学者曾开发出山楂叶中原花青素分析方法[11],但却不能同时分析黄酮。许文[12]等采用UPLC-MS/MS对三叶青中黄酮、原花青素成分进行同时检测,但该方法对仪器要求较高,不利于广泛应用。本研究拟在前期学者研究[13-14]的基础上开发一种用于同时测定山楂叶中的原花青素、黄酮和酚酸等9种主要酚类成分的检测方法,并对29个不同品种的山楂叶样品进行了测定,为山楂叶及相关产品的质量控制提供参考。
1 材料与方法
1.1 材料与仪器
山楂叶 共29个品种(大旺、豫北红、集安紫肉、大货、窄口、小糖球、伏里红、大糖球、丰收红、敞口、秋金星、大黄绵楂、辽红、大绵球、甜水、安泽大果、西丰红、涞水大金星、锦红、自根系、磨盘、9039、绵红、兴隆二号、兴隆三号、兴隆紫肉、小金星、雾灵红、燕瓤红),均采自河北省兴隆县山楂资源圃,采样时间为2015年5月27日,采样后冷冻干燥,保存于真空干燥器中备用;标准对照品:表儿茶素、绿原酸 购于美国Sigma公司;金丝桃苷、异槲皮苷、牡荆素鼠李糖苷 购于上海源叶生物科技有限公司;原花青素B2、原花青素C1、原花青素D1以及红果酸 均由本实验室从山楂果实中分离提纯[14],采用电喷雾质谱、NMR法以及硫解-HPLC法对上述化合物进行结构鉴定,与相关参考文献对比得到证实[13],通过峰面积归一化法测得其纯度均在95%以上;纯净水 杭州娃哈哈集团有限公司;乙腈、甲醇 Honeywell Burdick & Jackson公司,色谱纯;其余试剂 为分析纯。
Agilent-1200型高效液相色谱仪 由在线脱气机,低压四元梯度泵,光电二极管阵列检测器以及Agilent Chemstation色谱工作站组成,Agilent公司;CO-3010柱恒温控制箱 天津美瑞泰克科技有限公司;KQ-5200E型数控超声波清洗器 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 样品制备 称取山楂叶样品0.5 g于研钵中,滴入3滴80%磷酸并分次加入15 mL纯净水研磨均匀,用95%乙醇转移至50 mL容量瓶中,超声波提取11 min,用95%乙醇定容,静置,取上清液离心(4000 r/min,5 min),经0.45 μm微孔滤膜过滤后,待HPLC分析。
1.2.2 HPLC分析条件的选择 分别选用3种色谱柱:Hypersil BDS C18(250 mm×4.6 mm id,5 μm)、Hypersil BDS C18(200 mm×4.6 mm id,5 μm)和Sino Chrom ODS C18(200 mm×4.6 mm id,5 μm),3种流动相(甲醇-0.05%甲酸、乙腈-0.05%甲酸、甲醇-乙腈-0.05%甲酸)及不同的梯度洗脱程序进行实验。
1.2.3 HPLC分析条件 色谱柱Hypersil BDS C18(250 mm×4.6 mm id,5 μm);流动相A:甲醇/乙腈=1∶2含500 μL/L甲酸;流动相B:500 μL/L甲酸水溶液;梯度洗脱程序:0~26 min,8%~20% A;26~30 min,20%~50% A;30~35 min,50% A;35~37 min,50% A;37 min~47 min,8% A;流速:0.8 mL/min;柱温45 ℃;进样量10 μL;DAD检测器,检测波长:原花青素B2、原花青素C1、原花青素D1、红果酸为280 nm,绿原酸、牡荆素鼠李糖苷、金丝桃苷、异槲皮苷为350 nm,外标峰面积法进行定量分析。
1.2.4 标准曲线的绘制 将绿原酸、红果酸、表儿茶素、原花青素B2、原花青素C1、原花青素D1、牡荆素鼠李糖苷、金丝桃苷及异槲皮苷标准对照品溶于甲醇中,配制成0.5 mg/mL的混合标准对照品储备液,用甲醇稀释成不同浓度的标准液,进样分析后绘制标准曲线。
2 结果与分析
2.1 色谱柱的比较
对于同样规格的ODS和BDS柱,BDS柱分离的色谱峰型和分离度较ODS柱好;较长的色谱柱塔板数高,使原花青素B2、原花青素C1、原花青素D1与其他杂峰分离良好,故确定Hypersil BDS C18(250 mm×4.6 mm id,5 μm)为本实验的色谱柱。
2.2 流动相的选择
用甲醇-0.05%甲酸为流动相时,采用40%的甲醇,10种多酚成分不能很好的分开,当甲醇降到25%时,原花青素B5的保留时间较长。采用乙腈-0.05%甲酸为流动相,当乙腈溶液为20%时,原花青素B5出峰时间较早,但其余的成分不能很好分开,当降低乙腈为12%时,其余成分能够很好分开。当采用甲醇-乙腈-0.05%甲酸作为流动相时,为了节约时间,采用梯度洗脱的方式,以甲醇和乙腈1∶2(v/v)作A液,水为B液。当样品采用1.2.3的HPLC分析条件时,目标化合物之间分离效果较好,且基线平稳。9种酚类成分对照品和山楂叶样品的色谱图见图1。由图1看出,在选定的分析条件下,样品中的9种多酚与其他杂峰在47 min内实现了良好分离。
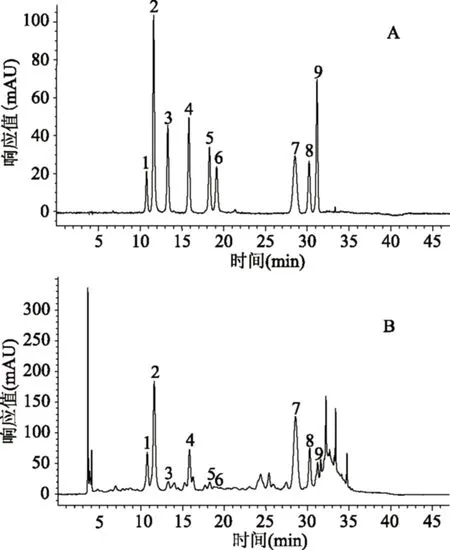
图1 9种山楂酚类成分对照品(A)和山楂叶样品(B)的HPLC图Fig.1 HPLC profile of nine phenolic references(A)and Chinese hawthorn leaves sample(B)注:1-红果酸,2-绿原酸,3-原花青素B2,4-表儿茶素,5-原花青素C1,6-原花青素D1,7-牡荆素鼠李糖苷,8-金丝桃苷,9-异槲皮苷。

表1 方法精密度的评价Table 1 Evaluation of the precision
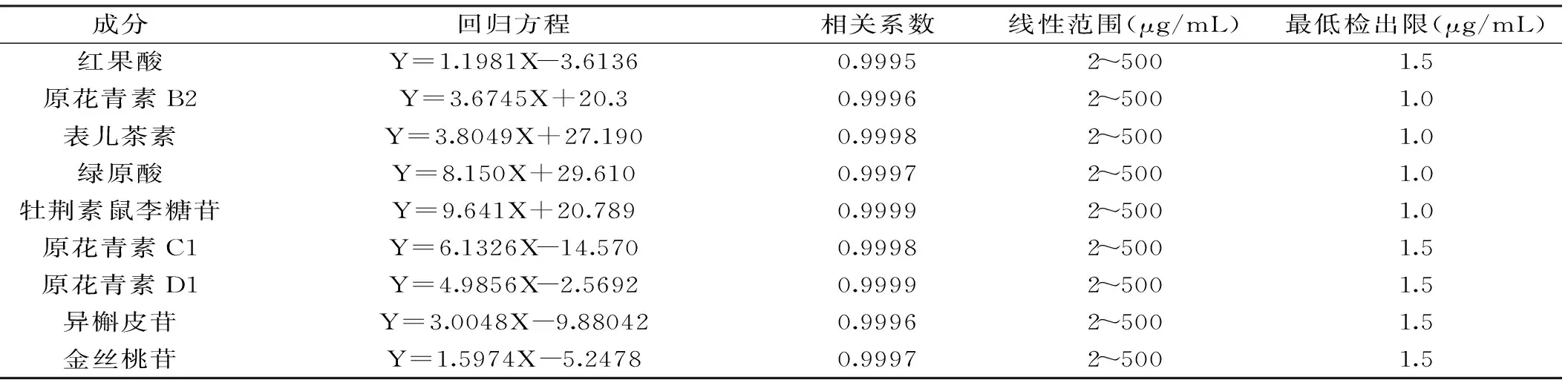
表2 对照品的回归方程、相关系数、线性范围及最低检出限Table 2 The regression equation,correlation coefficient,linear range and the minimum detection limit
2.3 HPLC方法评价
2.3.1 精密度实验 准确吸取0.5 mg/mL混合对照品,按1.2.3中的色谱条件连续进样5次,对各个色谱峰的峰面积进行统计,结果见表1,相对标准偏差(RSD)在0.80%~1.96%之间,表明该方法精密度良好。
2.3.2 方法的回归方程、线性范围和最低检出限 按1.2.4步骤配制混合标准对照品溶液,对各个标准对照品的峰面积进行统计,经过计算得到回归方程、相关系数和线性范围。
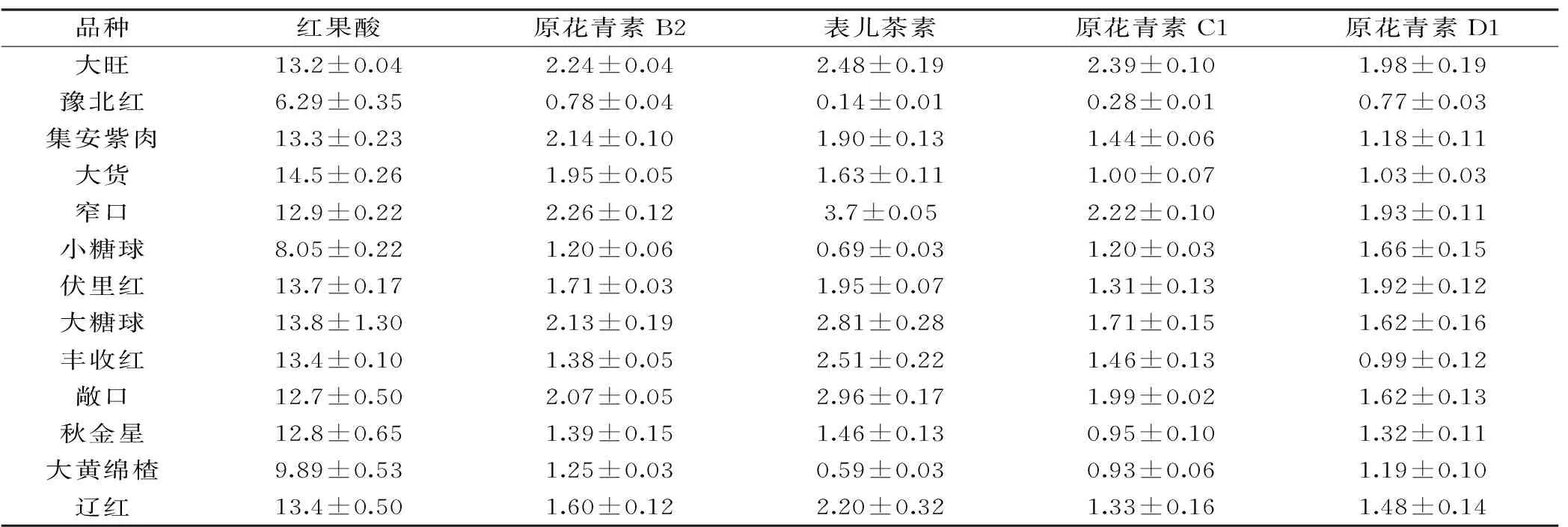
表4 不同山楂叶中9种酚类成分的含量测定结果(mg/g D.W)Table 4 Determination results of 9 phenolic compounds in hawthorn leaves among different cultivars(mg/g D.W)
以3倍信噪比得到最低检出限。结果列于表2。结果表明,响应值与进样量之间具有良好线性相关性,相关系数介于0.9995~0.9999之间,最低检出限范围为1.0~1.5 μg/mL,可以满足常规样品的定量分析。
2.3.3 加标回收率 在山楂叶样品中加入准确称取的9种酚类物质的标准品,按1.2.1所述对样品进行处理,平行5份,用1.2.3所述的色谱条件对未加标样品和已加标样品进行测定,通过统计峰面积,计算出各组成分的加标回收率,结果见表3。结果表明,9种酚类的加标回收率介于93.7%~110.2%,RSD为0.69%~4.58%,回收率均较高,可满足常规定量分析需要。
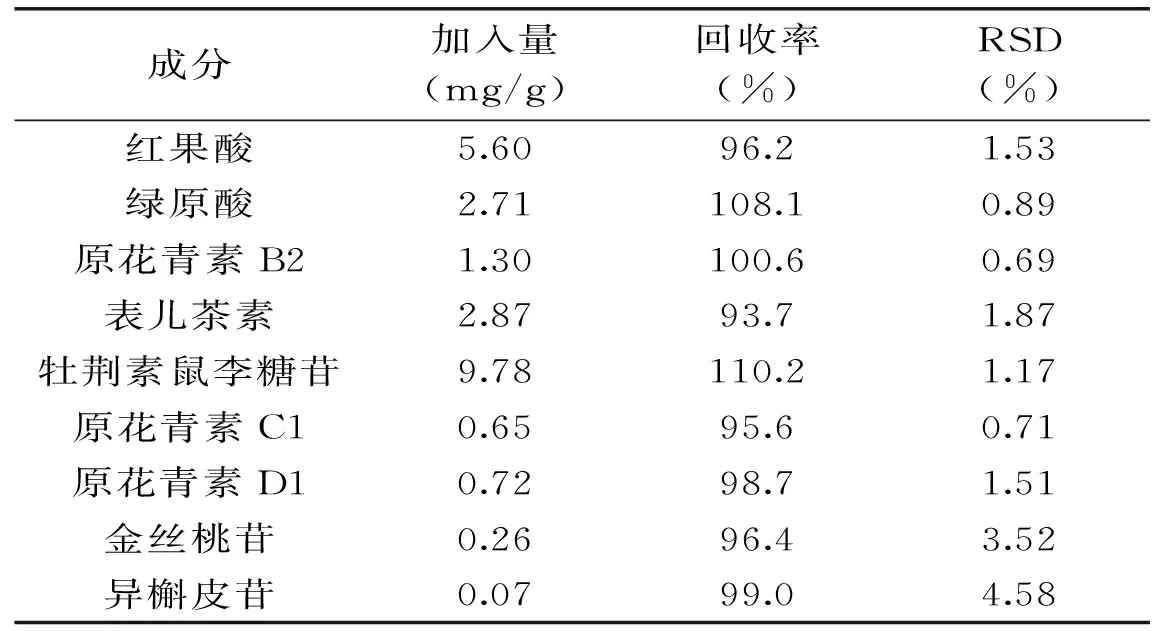
表3 九种酚类的加标回收率Table 3 Recoveries of nine phenolic compounds
2.4 不同品种山楂叶中9种酚类成分的含量测定
采用1.2.3所述方法对5月采集并冻干后的29种山楂叶中9种酚类成分的含量进行分析检测,结果见表4。

续表
注:a.含量低于检测限。
由表4可以看出,在29个不同品种的山楂叶中均检出了红果酸、原花青素B2、表儿茶素、原花青素C1、原花青素D1、绿原酸、牡荆素鼠李糖苷7种酚类成分。金丝桃苷和异槲皮苷等氧苷黄酮的含量较低,平均值为0.53 mg/g D.W和0.13 mg/g D.W,其中大绵球中金丝桃苷和异槲皮苷的含量均低于检出限。根据检测的结果得出碳苷黄酮(牡荆素鼠李糖苷)/氧苷黄酮(C/O)比为22.6,山楂叶中红果酸的含量高于绿原酸,与文献报道[5]的结果相似。山楂叶中表儿茶素的含量较高,平均为1.61 mg/g D.W,这些结果与文献报道[15]一致。山楂叶中的9种酚类成分的含量由低到高依次为:异槲皮苷、金丝桃苷、原花青素C1、原花青素D1、表儿茶素、原花青素B2、绿原酸、红果酸、牡荆素鼠李糖苷。山楂叶中的黄酮类即金丝桃苷、异槲皮苷、牡荆素鼠李糖苷的平均总含量达15 mg/g D.W左右和酚酸类即绿原酸、红果酸的平均总含量达15 mg/g D.W左右,原花青素类成分原花青素B2、原花青素C1、原花青素D1平均总含量达6 mg/g D.W。
3 结论
建立了一种用于检测山楂叶中9种酚类成分的反相高效液相色谱法,在优化的色谱条件下,9种酚类成分在47 min内实现了良好分离,且该方法灵敏度高、准确性好及重复性较好,可用于山楂叶中酚类成分定量分析。采用建立的方法对29种不同品种山楂叶中9种酚类成分的含量进行了分析,结果表明,山楂叶中的多酚类成分以黄酮和酚酸类成分为主,不同品种中的9种酚类成分含量有所不同。
[1]宋立人,洪恂,丁绪亮,等. 现代中药学大辞典[M]. 上册. 北京:人民卫生出版社,2001:165-168.
[2]Wagner H. Phytomedicine research in Germany[J]. Environ Health Perspect,1999,107(10):779-781.
[3]国家药典委员会. 中华人民共和国药典一部[S]. 北京:化学工业出版社,2005:575-576.
[4]李挺,张莉,齐刚. 350山楂鲜果标准提取物治疗NYHAⅡ期充血性心力衰竭的临床研[J]. 现代药物与临床,2004,19(6):264-265.
[5]Gao Z,Jia YN,Cui TY,et al. Quantification of ten polyphenols in the leaves of Chinese hawthorn(CrataeguspinnatifidaBge. var. major N.E. Br.)by high performance liquid chromatography[J]. Asian Journal of Chemistry,2013,25(18):10344-10348.
[6]李保利,赵凌,申艳红,等. 超声波法提取山楂叶中原花青素的条件优化[J]. 广州化工,2016,11(10):138-140.
[7]许红蕾. 山楂叶中化学成分的HPLC-DAD-ESI-MS/MS鉴识及其3个高纯度黄酮苷的制备色谱研究[D]. 上海:第二军医大学,2008.
[8]杜义龙,潘海峰. HPLC法同时测定承德山里红叶中绿原酸和牡荆素鼠李糖苷的含量[J]. 山西职工医学院学报,2016,26(1):4-7.
[9]潘伟东,杜义龙,赵胜男,等. HPLC法同时测定承德产山楂叶4种成分的含量[J]. 承德医学院学报,2015,32(4):279-281.
[10]王领弟,李艳荣,张晓峰,等. 山楂叶指纹图谱研究[J]. 中国实验方剂学杂志,2011,17(19):74-78.
[11]Gabriela ER,Beat OS. Quantitative reversed-phase high-performance liquid chromatography of procyanidins in Crataegus leaves and flowers[J]. Journal of Chromatography A,1999,835(1-2):59-65.
[12]许文,傅志勤,林婧,等. UPLC-MS/MS法同时测定三叶青中10种黄酮类成分[J]. 药学学报,2014,49(12):1711-1717.
[13]Cui T,Li JZ,Kayahara H,et al. Quantification of the polyphenols and triterpene acids in Chinese hawthorn fruit by high-performance liquid chromatography[J]. Journal of Agricultural and Food Chemistry,2006,54(13):4574-4581.
[14]康小虎. 山楂原花青素色谱行为及其硫解转换系数研究[D]. 保定:河北农业大学,2014.
[15]Liu P,Kallio H,Yang B. Phenolic compounds in hawthorn(Crataegusgrayana)fruits and leaves and changes during fruit ripening[J]. Journal of Agricultural & Food Chemistry,2011,59(20):11141-11149.
Determination of nine phenolic components in the leaves of Chinese hawthorn by HPLC
YANG Xiao-bo1,WANG Rong-fang1,JIA Ya-nan1,BI Zhen-liang2,LU Feng-qin2,CUI Tong1,*
(1.College of Food Science and Technology,Agriculture University of Heibei,Baoding 071000,China;2.Forestry Bureau of Xinglong County,Chengde 067000,China)
Nine phenolic components in the leaves of Chinese hawthorn were determined by RP-HPLC simultaneously. The results indicated that the linearity ranges of nine compounds were between 2~500 μg/mL and the correlation coefficient(r)were between 0.9995~0.9999. The recovery was 93.7%~110.2%. The relative standard deviations were between 0.69%~4.58%. The average content of nine phenolic components from low to high were isoquercitrin,hyperoside,procyanidin C1,procyanidins D1,epicatechin,proanthocyanidin B2,chlorogenic acid,eucomic acids,vitexin-2″-O-rhamnoside. Among them,the content of flavonoids and phenolic acids was higher than 15 mg/g D.W and the content of proanthocyanidins was up to 6 mg/g D.W. The method of HPLC was simple and accurate.
high performance liquid chromatography;Chinese hawthorn leaves;procyanidins;eucomic acids;flavonoids
2016-11-28
杨晓博(1993-),女,在读硕士研究生,研究方向:农产品加工及贮藏工程,E-mail:15031258295@163.com。
*通讯作者:崔同(1956-),男,博士,教授,研究方向:天然产物活性成分分析,E-mail:cuitong98@aliyun.com。
河北省自然科学基金(C2015204187)。
TS255.7
A
1002-0306(2017)10-0062-05
10.13386/j.issn1002-0306.2017.10.004

