珊瑚菌多糖RBP-Ⅰ的结构及抗氧化活性分析
董 芳,颜盛繁,高呈琳,陈 健,*
(1.华南理工大学轻工与食品学院,广东广州 510640;2.广州时代食品与生命健康研究有限公司,广东广州 510670)
珊瑚菌多糖RBP-Ⅰ的结构及抗氧化活性分析
董 芳1,颜盛繁2,高呈琳1,陈 健1,*
(1.华南理工大学轻工与食品学院,广东广州 510640;2.广州时代食品与生命健康研究有限公司,广东广州 510670)
珊瑚菌经热水浸提分离得到粗多糖,纯化后得到珊瑚菌多糖RBP-Ⅰ,采用凝胶渗透色谱测定其分子量,并结合Sephadex G-100层析柱鉴定其纯度。利用苯酚-硫酸法测定糖含量,碘-碘化钾法判定是否含有淀粉,考马斯亮蓝G-250法测蛋白含量,硫酸-咔唑法测糖醛酸含量。采用红外光谱扫描、气相色谱分析其结构及单糖组成。结果表明,RBP-Ⅰ的Mw为15857 Da,为均一多糖;总糖含量86.94%,糖醛酸含量5.14%,不含蛋白及淀粉;多糖RBP-Ⅰ中单糖的摩尔比为鼠李糖∶岩藻糖∶阿拉伯糖∶甘露糖∶葡萄糖∶半乳糖=1.00∶6.53∶1.99∶8.29∶70.05∶53.80;红外光谱表明其具有多糖特征峰,且为吡喃型多糖。体外抗氧化结果表明:当多糖质量浓度为10000 μg/mL时,FRAP值达到0.0672 mmol/L,DPPH自由基的清除率达到22.83%,ABTS+·的清除率达到15.71%。由此可见,珊瑚菌多糖RBP-Ⅰ具有一定的抗氧化活性。
珊瑚菌,多糖,理化性质,结构,抗氧化活性
珊瑚菌,属于多孔菌目(Aphyllophorales),珊瑚菌科(Clavariaceae)[1],又名葡萄色顶枝瑚菌、扫帚菌,是我国食用菌资源中不可或缺的一部分[2]。珊瑚菌科约含有500种大型真菌,目前在我国发现的不足百种,在我国有记载食用的约30种,可见待开发利用的珊瑚菌资源较为丰富[3]。珊瑚菌营养成分丰富[4],矿质元素含量高于常见食用菌,必需氨基酸和非必需氨基酸种类较为齐全,尤其是必需氨基酸的相对含量较高[5],窦晓兰[6]从珊瑚菌中提取得到棕榈酸、油酸及亚油酸等有机酸,郑永标[7]从珊瑚菌中分离出芳香类、大环内酯及吡喃酮等22个化合物。常正尧等[8]发现珊瑚菌的水煎剂具有抗乳腺癌的作用,当珊瑚菌的浓度在0.0721 g/mL时,对乳腺癌细胞有最大抑制率。王丽娟等[9]提取珊瑚菌粗多糖,并以清除羟基自由基能力为指标进行体外抗氧化实验,当多糖浓度达到5 mg/mL时羟基自由基的清除率达到34.99%。但是对于珊瑚菌纯化多糖的研究还未见报道。本文对分离纯化得到的珊瑚菌均一多糖RBP-Ⅰ进行理化性质、结构的初步分析,并对其进行体外抗氧化活性进行测定,以期为珊瑚菌多糖的活性研究奠定基础。
1 材料与方法
1.1 材料与设备
珊瑚菌 购于云南滇彩农产品公司;葡萄糖、半乳糖醛酸、岩藻糖、鼠李糖、木糖、半乳糖标准品 均购于美国Sigma公司;DEAE-52纤维素 美国Whatman公司,广州展晨生物科技有限公司进口分装;Sephadex G-100 美国Pharmacia公司;1,1-二苯基-2-三硝基苯肼(DPPH)、Trolox、VC、2,2′-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS) 均为分析纯试剂,广州试剂公司;牛血清白蛋白、考马斯亮蓝G-250 均为进口分装,上海聚源生物科技有限公司;葡聚糖标品分子量依次为:5200、11600、23800、48600、148000、273000、410000、668000 Da。
DBS-100部分自动收集器 上海康华生化仪器制造;UV-5000分光光度计 上海元析仪器有限公司;DE-310冷冻干燥机 德国威思公司;1525高效液相色谱泵、717plus自动进样器、2414示差检测仪 均为美国Waters;Vector 33傅里叶红外光谱仪 Bruck公司;Aglient气相色谱仪 美国AGLIENT公司。
1.2 实验方法
1.2.1 多糖RBP-Ⅰ的制备 珊瑚菌粉末→热水浸提(90 ℃、1 h,重复3次)→D354FD树脂脱色(48 ℃、3 h)→醇沉(4倍体积无水乙醇,静置24 h)→Sevage法脱蛋白(多糖溶液∶氯仿∶正丁醇=25∶5∶1)→醇沉→离心(4000 r/min、10 min)→DEAE-52层析(去离子水为洗脱液,流速0.5 mL/min)→收集组分→蒸馏水透析(24 h)→冷冻干燥→多糖RBP-Ⅰ。
1.2.2 多糖RBP-Ⅰ的分子量测定及纯度判断
1.2.2.1 分子量测定 利用高效凝胶渗透色谱对RBP-Ⅰ的分子量进行测定。
标准曲线绘制:将已知相对分子质量的葡聚糖标准品分别用流动相配制成2.0 mg/mL的溶液,进样量为20 μg,记录GPC色谱图,利用Breeze软件分析绘制标准曲线。
色谱条件:流动相为0.02 mol/L的KH2PO4缓冲溶液,凝胶柱为TSK G-5000PWXLcolumn(7.8 mm×300 mm)和TSK G-3000PWXLcolumn(7.8 mm×300 mm)串联使用,流速为0.6 mL/min,waters 2414示差检测器,柱温35 ℃[10]。
1.2.2.2 葡聚糖凝胶柱层析分析 将冻干后得到的RBP-Ⅰ用Sephadex G-100装柱,去离子水为洗脱液,自动收集器收集,苯酚硫酸法测多糖洗脱曲线[11]进一步判定RBP-Ⅰ是否为单一多糖。
1.2.3 多糖RBP-Ⅰ的基本理化指标
1.2.3.1 化学组成测定 采用苯酚-硫酸法测定多糖RBP-Ⅰ的总糖含量[12];采用考马斯亮蓝-G250法测定蛋白质含量[13];采用硫酸-咔唑法测定糖醛酸含量[14];将精密称取的多糖RBP-Ⅰ用蒸馏水配制成1 mg/mL的溶液,加入碘-碘化钾试剂,观察溶液颜色变化,以判定是否含有淀粉。
1.2.3.2 紫外全波段扫描 将精密称取的多糖RBP-Ⅰ用蒸馏水配制成1 mg/mL的溶液,在190~500 nm处进行紫外全波段扫描,以波长为横坐标,吸光度值为纵坐标,绘制多糖溶液的紫外扫描曲线[15]。从而判断多糖RBP-Ⅰ中是否含有蛋白和核酸。
1.2.4 多糖RBP-Ⅰ的结构分析
1.2.4.1 单糖组成分析 多糖RBP-Ⅰ水解:称10.0 mg RBP-Ⅰ于安培管,加4 mL 2 mol/L三氟乙酸,密封后110 ℃恒温水解6 h。加入少量甲醇蒸干,反复操作,以除尽残余三氟乙酸。
多糖水解产物及单糖标品衍生化:称取各单糖标品葡萄糖、鼠李糖、木糖、阿拉伯糖、岩藻糖、甘露糖、半乳糖各10.0 mg于10 mL的螺口试管中,并将多糖的水解产物也转移至螺口管,称取10.0 mg的盐酸羟胺加入多糖水解产物及各单糖标品中,并各加1.0 mL的吡啶沸水浴30 min,冷却至室温加1.0 mL醋酸酐,沸水浴30 min,衍生化处理完毕。
气相色谱条件:Agilent 6890N气相色谱仪、FID检测器;色谱柱:DB-1701毛细管柱(30 m×0.25 mm,0.25 μm);载气:高纯氮;流速:1 mL/min;程序升温:色谱柱初始温度180 ℃,以2 ℃/min的速度升至220 ℃,保持1 min,再以5 ℃/min的速度升至250 ℃,保持2 min;其他条件:进样口温度250 ℃,汽化室温度250 ℃,检测器温度300 ℃,吹扫流速4.0 mL/min[16]。
对比样品与标品保留时间,可得单糖组成,根据各色谱峰峰面积可得各单糖比例。
1.2.4.2 红外光谱分析 称多糖RBP-Ⅰ约2 mg,与KBr粉末充分混合研磨均匀,在4000~500 cm-1波段范围内扫描,可得RBP-Ⅰ红外扫描光谱[17]。
1.2.5 多糖RBP-Ⅰ抗氧化活性研究
1.2.5.1 多糖RBP-Ⅰ的还原能力 采用FRAP法[18],FRAP反应液配制:10 mmol/L TPTZ溶液、20 mmol/L氯化铁溶液以及0.3 mol/L 醋酸钠缓冲液,三者按体积比1∶1∶10混合后,37 ℃水浴保温。
FeSO4标准曲线绘制:以不同浓度(0、0.1、0.2、0.4、0.6、0.8、1.0 mmol/L)FeSO4溶液替代样品测定其吸光度,以FeSO4的浓度为横坐标,吸光度值为纵坐标,建立标准曲线。
珊瑚菌多糖样品测定:于96孔板依次加入20 μL不同浓度(250、500、1000、2000、4000、6000、8000、10000 μg/mL)珊瑚菌多糖溶液与180 μL FRAP反应液,37 ℃避光振荡反应10 min后测定其在595 nm波长处的吸光度。空白对照组及阳性对照组分别用蒸馏水及VC代替珊瑚菌多糖样品。
1.2.5.2 多糖RBP-Ⅰ对DPPH自由基的清除作用 于96孔板依次加入20 μL不同浓度(250、500、1000、2000、4000、6000、8000、10000 μg/mL)的多糖溶液及180 μL 180 μmol/L DPPH工作液,空白对照用蒸馏水代替多糖样品,阳性对照用VC代替多糖样品,振荡,517 nm处测定吸光度值[19-20]。
清除率(%)=(A0-A1)/A0×100
式(1)
式中,A0-空白对照孔的吸光度;A1-样品孔的吸光度。
1.2.5.3 珊瑚菌多糖对ABTS+·的清除作用 参照文献方法[21-22]测定,配制浓度为0.2626 mmol/L ABTS工作液。
珊瑚菌多糖样品测定:于96孔板依次加入20 μL不同浓度(250、500、1000、2000、4000、6000、8000、10000 μg/mL)珊瑚菌多糖样品和180 μL的0.2626 mmol/L的ABTS工作液,37 ℃避光振荡反应6 min后在波长734 nm处测定吸光度值。空白对照组及阳性对照组分别用蒸馏水及VC代替珊瑚菌多糖样品。ABTS+·清除率计算方法同式(1)。
1.3 数据处理
采用Breeze、Origin8.5软件对实验数据进行分析处理。
2 结果与分析
2.1 多糖RBP-Ⅰ分子量测定及纯度检测
2.1.1 分子量测定 葡聚糖标准品相对分子质量的对数(lgMw)对洗脱体积(V)回归处理的标准方程为:lgMw=3.59e-5.13eV+2.92e-1V2-5.87e-3V3,R2=0.998946。图1是RBP-Ⅰ的GPC图谱,色谱峰为单一对称峰,初步判定RBP-Ⅰ为均一多糖,具体还需要结合Sephadex G-100柱层析判断。RBP-Ⅰ的重均分子量Mw为15857 Da,数均分子量Mn为11829 Da,峰位分子量Mp为19367 Da。

图1 RBP-Ⅰ的GPC图谱Fig.1 The GPC diagram of the RBP-Ⅰ
2.1.2 RBP-Ⅰ的Sephadex G-100层析柱分析 图2是RBP-I的Sephadex G-100洗脱曲线,为单一对称峰,结合GPC分析结果,判定RBP-I为相对均一多糖。

图2 RBP-I的Sephadex G-100洗脱曲线Fig.2 Elution curve of Sephadex G-100 column chromatography of RBP-Ⅰ
2.2 RBP-Ⅰ多糖的基本理化指标
2.2.1 化学组成测定 由表1可知,RBP-I不含淀粉及蛋白质,是一种酸性多糖。

表1 RBP-I的化学组成Table 1 Chemical compositions of RBP-I
注:“-”表示未检测出。
2.2.2 紫外全波段扫描 由图3可知,RBP-Ⅰ在260 nm处无特征吸收峰,说明RBP-Ⅰ中不含或含少量蛋白,与考马斯亮蓝-G250法测定蛋白质含量结果一致;在280 nm处没有特征吸收峰,说明RBP-Ⅰ中不含或含少量核酸。
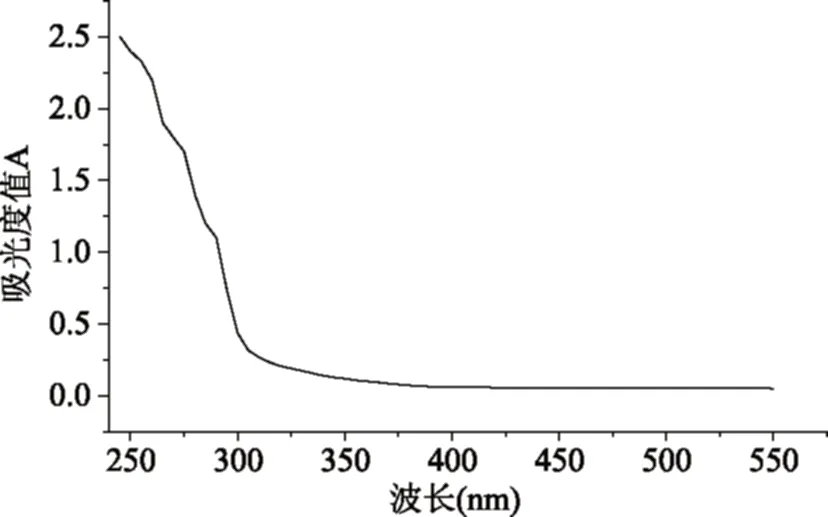
图3 RBP-I的紫外扫描光谱图Fig.3 The UV scanning spectrum of RBP-I
2.3 多糖RBP-I的单糖组成
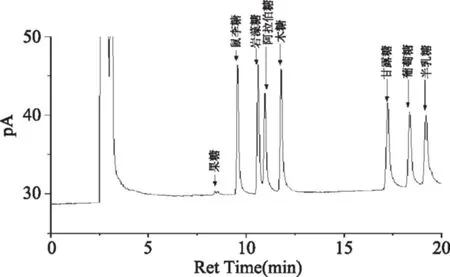
图4 单糖标准品的GC色谱图Fig.4 GC diagram of standard mixture
图4为单糖标准品衍生化生成糖腈乙酸酯衍生物的GC图谱,由图4可知,果糖、鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖的保留时间分别为8.543、9.562、10.612、10.968、11.788、 17.246、18.369、19.209 min。图5为RBP-Ⅰ的GC色谱图,色谱峰保留时间依次为9.57、10.605、11.076、17.228、18.381、19.209 min,对应单糖依次为鼠李糖、岩藻糖、阿拉伯糖、甘露糖、葡萄糖、半乳糖,根据对应色谱峰的峰面积,且各单糖相对分子质量相同,可得RBP-Ⅰ中单糖的摩尔比为鼠李糖∶岩藻糖∶阿拉伯糖∶甘露糖∶葡萄糖∶半乳糖=1.00∶6.53∶1.99∶8.29∶70.05∶53.80。
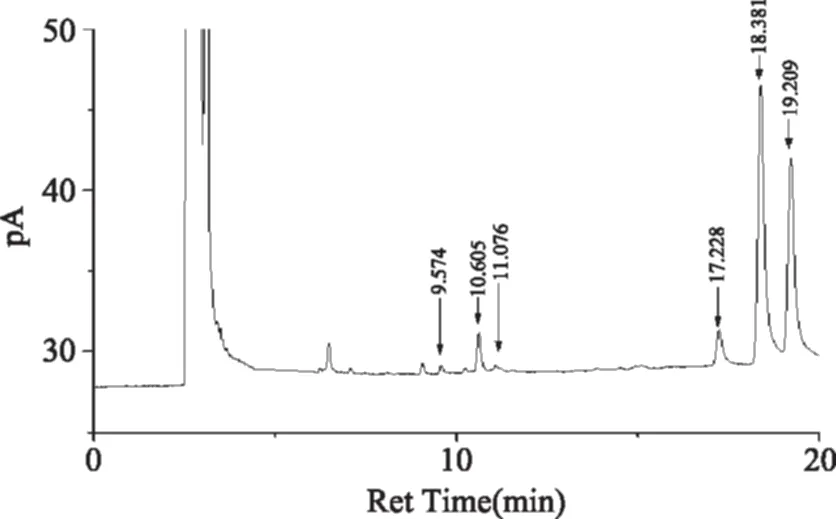
图5 RBP-Ⅰ的GC色谱图Fig.5 GC diagram of RBP-Ⅰ
2.4 多糖RBP-I的红外光谱分析

表2 VC对DPPH和ABTS+·的清除率Table 2 Removal ability of DPPH and ABTS+· of VC
由图6 RBP-Ⅰ的红外光谱图可知,RBP-Ⅰ在3406 cm-1处有吸收峰,为多糖中的O-H的伸缩振动(可能含N-H);在2931 cm-1处为多糖的特征吸收峰C-H振动吸收峰;在1637 cm-1处为酰胺键的C=O伸缩振动吸收峰,表明RBP-Ⅰ中含有酰基[23];1413 cm-1及1359 cm-1处均为C-H变角振动吸收峰;1251 cm-1处为环上C-O伸缩振动吸收峰,1151 cm-1处为环上C-C骨架伸缩振动吸收峰,1082 cm-1处说明多糖为吡喃糖,921 cm-1是非对称吡喃环伸缩振动,763 cm-1处D-葡萄吡喃糖环对称伸缩振动,说明RBP-Ⅰ含有β-D-吡喃葡萄糖环;813 cm-1处特征吸收峰表示甘露糖的存在;621 cm-1处为吡喃糖骨架对称收缩振动吸收峰[24]。
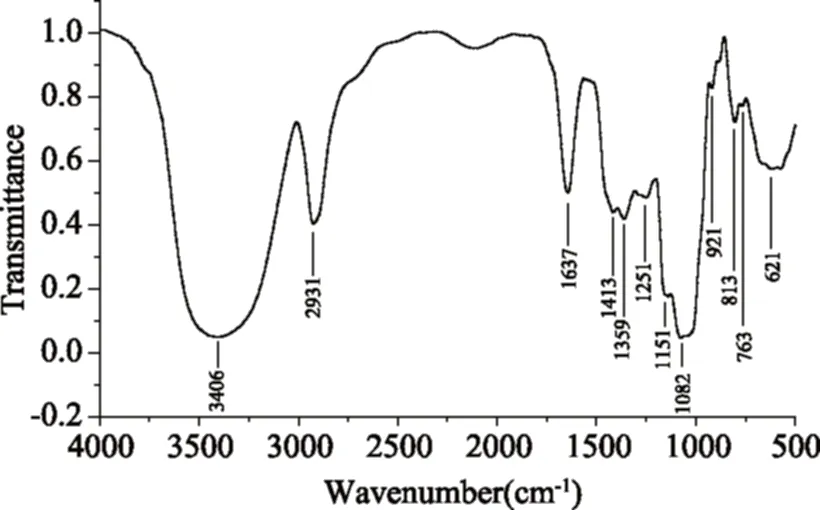
图6 RBP-Ⅰ的红外光谱图Fig.6 FT-IR spectrum of RBP-Ⅰ
2.5 抗氧化活性
FRAP法测定多糖抗氧化能力得到FeSO4的标准曲线为Y=0.786X+0.04528,R2=0.9988,其中X为FeSO4的浓度(mmol/L),Y为对应的样品的吸光度值大小。如图7所示,在250~10000 μg/mL,FRAP值随珊瑚菌多糖浓度的升高而增大,浓度为10000 μg/mL时,RBP-Ⅰ的FRAP值可达到0.0672 mmol/L,说明珊瑚菌多糖有一定的还原三价铁离子的能力,但是弱于同浓度的老鹰茶多糖[25]和铁皮石斛对铁离子的还原能力[26]。

图7 珊瑚菌多糖还原Fe3+的能力Fig.7 Reduction ability of Fe3+ of RBP-Ⅰ
在珊瑚菌多糖对清除DPPH的能力测定中,以VC阳性对照(如表2所示)。如图8所示,随着珊瑚菌多糖浓度的升高,清除自由基DPPH的能力增强,当达到10000 μg/mL时,DPPH自由基的清除率达到最大值22.83%,高于相同浓度的水浸提物和粗多糖对DPPH自由基的清除能力[27]。

图8 珊瑚菌多糖清除DPPH的能力Fig.8 Removal ability of DPPH of RBP-Ⅰ
如图9所示,在250~10000 μg/mL范围内,珊瑚菌多糖对ABTS+·的清除能力均随多糖浓度增大而增加,当10000 μg/mL时,RBP-Ⅰ的ABTS+·清除率达到最大值15.71%,但仍然弱于低浓度的VC对ABTS+·的清除能力(如表2所示),与刘阳[28]对东北菱多糖,杜清华[29]等对翼齿六棱菊多糖,马艺丹[30]等对神秘果子多糖的抗氧化的研究结果相似。
3 结论
珊瑚菌经热水浸提分离得到粗多糖,纯化后得到珊瑚菌多糖RBP-Ⅰ,通过GPC及Sephadex G-100层析柱分析,判定RBP-Ⅰ为相对均一多糖,且Mw为15857 Da,Mn为11829 Da,Mp为19367 Da。不含淀粉及蛋白质,总糖含量86.94%,糖醛酸含量5.14%。RBP-Ⅰ红外光谱显示其为吡喃型多糖,单糖组成分析显示RBP-Ⅰ含有鼠李糖、岩藻糖、阿拉伯糖、甘露糖、葡萄糖、半乳糖,且对应摩尔比为1.00∶6.53∶1.99∶8.29∶70.05∶53.80,珊瑚菌多糖RBP-Ⅰ具有较强的抗氧化活性,当多糖质量浓度为10000 μg/mL时,FRAP值达到0.0672 mmol/L,DPPH自由基的清除率达到22.83%,ABTS+·的清除率达到15.71%。
[1]卯晓岚. 食用珊瑚菌[J]. 中国食用菌,1987,9(1):22-24.
[2]李仲贤. 秦巴山区野生珍稀珊瑚菌分离培养研究[J]. 陕西农业科学,2013,59(3):54-55.
[3]王法云,崔波,古奕庆,等. 河南的珊瑚菌科食用菌资源研究及开发利用[J]. 河南科学,1997(1):60-67.
[4]李华,卫敏,陈俙妍,等.珊瑚菌总萜提取工艺研究[J]. 时珍国医国药,2012(4):950-951.
[5]陈文强,胥成浩.葡萄色顶枝瑚菌中矿质元素及氨基酸含量的测定[J]. 氨基酸和生物资源,2001,23(3):7-8.
[6]窦晓兰. 珊瑚菌化学成分的研究[D]. 郑州:河南工业大学,2013.
[7]郑永标. 5种食药用大型真菌天然产物的研究[D]. 厦门:厦门大学,2008.
[8]常正尧,吴亚楠,李永芳,等. 珊瑚菌抗乳腺癌作用的研究[J]. 时珍国医国药,2013,24(1):152-154.
[9]王丽娟,张飞,苗玉洁. 珊瑚菌多糖的提取及其对羟自由基的清除作用研究[J]. 食品工业,2012,33(10):43-46.
[10]Li C,You L,Fu X,et al. Structural characterization and immunomodulatory activity of a new heteropolysaccharide fromPrunellavulgaris[J]. Food Funct,2015,6(5):1557-1567.
[11]Li F,Gao J,Xue F,et al. Extraction Optimization,Purification and Physicochemical Properties of Polysaccharides fromGynuramedica[J]. Molecules,2016,21(4):397.
[12]Wang Y,Wang F,Ma X,et al. Extraction,purification,characterization and antioxidant activity of polysaccharides from Piteguo fruit[J]. Industrial Crops and Products,2015,77:467-475.
[13]Hu H,Liang H,Wu Y. Isolation,purification and structural characterization of polysaccharide fromAcanthopanaxbrachypus[J]. Carbohydrate Polymers,2015,127:94-100.
[14]Pu X,Ma X,Liu L,et al. Structural characterization and antioxidant activityinvitroof polysaccharides from angelica and astragalus[J]. Carbohydrate Polymers,2016,137:154-164.
[15]Chen R,Tan L,Jin C,et al. Extraction,isolation,characterization and antioxidant activity of polysaccharides fromAstragalusmembranaceus[J]. Industrial Crops and Products,2015,77:434-443.
[16]Wu M,Zhang F,Yu Z,et al. Chemical characterization andinvitroantitumor activity of a single-component polysaccharide from Taxus chinensis var. mairei[J]. Carbohydrate Polymers,2015,133:294-301.
[17]Sun Z,Peng Y,Zhao W,et al. Purification,characterization and immunomodulatory activity of a polysaccharide fromCelosiacristata[J]. Carbohydrate Polymers,2015,133:337-344.
[18]杨娜,王鸿飞,许凤,等. 蕨麻多糖提取及抗氧化活性研究[J]. 中国食品学报,2014,14(2):60-66.
[19]王俊亮,肖苏尧,陈运娇,等.广林9号桉叶多酚抗氧化活性研究[J].食品科学,2012(1):20-24.
[20]Shahwar D,Shafiq-ur-Rehman,Ahmad N,et al. Antioxidant activities of the selected plants from the family Euphorbiaceae,Lauraceae,Malvaceae and Balsaminaceae[J]. African Journal of Biotechnology,2010,9(7):1086-1096.
[21]张颖. 不同食用菌菌糠多糖的组分分析与抗氧化活性评价[J]. 食品科学,2012,33(1):18-21.
[22]邹林武,赵谋明,游丽君. 香菇多糖提取工艺的优化及其抗氧化活性研究[J]. 食品工业科技,2013,34(19):177-182.
[23]张惟杰. 糖复合物生化研究技术[M]. 杭州:浙江大学出版社,1999.
[24]李伟欣,陈倩,李平兰,等. 双歧杆菌22-5胞外多糖结构分析[J]. 食品科学,2008,29(4):267-271.
[25]贾学静. 老鹰茶总黄酮与多肽和多糖的提取及生物活性研究[D]. 雅安:四川农业大学,2014.
[26]张勇. 铁皮石斛茎、叶、花多糖理化性质及抗氧化、免疫调节活性研究[D]. 杭州:浙江大学,2016.
[27]李华,窦晓兰,陆启玉. 葡萄状枝瑚菌粗多糖的提取及其清除DPPH自由基活性[J]. 食用菌学报,2012,19(3):69-72.
[28]刘阳. 东北菱提取物抗氧化作用研究[D]. 长春:吉林大学,2016.
[29]杜清华,黄元河,潘乔丹,等. 翼齿六棱菊多糖的含量测定及抗氧化活性考察[J]. 中国实验方剂学杂志,2013,19(15):67-69.
[30]马艺丹,刘红,马思聪,等. 神秘果种子多糖的响应面优化提取及其抗氧化活性研究[J]. 食品工业科技,2016,37(10).
Structural analysis and antioxidation activity of polysaccharide RBP-Ⅰ fromRamariabotrytoides
DONG Fang1,YAN Sheng-fan2,GAO Cheng-lin1,CHEN Jian1,*
(1.College of Food Science and Engineering South China University of Technology,Guangzhou 510640,China; 2.Guangdong Institute of Food and Life Science,Guangzhou 510670,China)
RamariabotrytoidesRBP-Ⅰ was isolated and purified fromRamariabotrytoidesthrough water extraction identified as homogeneous polysaccharide by gel permeation chromatography and Sephadex G-100 arbitration. The contents of total sugar,starch,protein and union acid were analyzed by phenol-sulfuric acid,law of iodine-potassium iodide,coomassie brilliant blue stain and sulfuric-carbazole method. The structure and monosaccharide composition were studied by infrared(IR)spectra analysis and gas chromatograph. The results showed that the average molecular of RBP-Ⅰwas 15857 Da,the total sugar was 86.94%,the uronic acid was 5.14% with no starch and protein.It was composed of rhamnose,fucose,arabinose,manose,glucose and galactose with a mole ratio of 1.00∶6.53∶1.99∶8.29∶70.05∶53.80. RBP-Ⅰexhibited characteristic absorption peak of polysaccharide by IR,indicating that it was pyranoid polysaccharide. Moreover,at 10000 μg/mL of RBP-Ⅰ,the FRAP value was 0.0672 mmol/L,the scavenging rate was 22.83% and 15.71% for DPPH and ABTS+· respectively. These results suggested that RBP-Ⅰhad potent antioxidant activity.
Ramariabotrytoides;polysaccharides;physicochemical properties;structure;antioxidant activity
2016-08-12
董芳(1992-),女,在读硕士研究生,研究方向:天然产物分离纯化,E-mail:15622116540@163.com。
*通讯作者:陈健(1967-),男,博士,副教授,主要从事食品化学、天然产物化学、多糖生物技术等方面的研究,E-mail:fejchen@scut.edu.cn。
TS201.2
A
1002-0306(2017)10-0124-05
10.13386/j.issn1002-0306.2017.10.016

