掌叶半夏凝集素基因的克隆及亚细胞定位分析
赵 欢
(西华师范大学 生命科学学院,四川 南充 637009)
掌叶半夏凝集素基因的克隆及亚细胞定位分析
赵 欢
(西华师范大学 生命科学学院,四川 南充 637009)
为了克隆掌叶半夏凝集素基因(Pinelliapedatisectaagglutinin,PPA),并对其进行生物信息学分析和亚细胞定位。采用PCR技术扩增掌叶半夏凝集素基因的ORF序列,构建pCAMBIA1300-35S-PPA-eGFP重组载体,导入农杆菌GV3101并在烟草中进行瞬时表达,采用激光扫描共聚焦显微镜观察其亚细胞定位。克隆获得的PPA基因全长由777个核苷酸组成,编码258个氨基酸,含有3个甘露糖结合位点和2个保守的B-lectin结构域,GenBank登录号为KF154981,氨基酸序列登录号为AGV40779。序列比对表明,该序列与天南星、滴水珠、花南星和半夏凝集素的氨基酸序列相似性分别为96%,91%,86%和83%。亚细胞定位的结果表明,pCAMBIA1300-35S-PPA-eGFP融合蛋白在细胞核内无分布,而是点状分布在细胞质膜上。为进一步解析掌叶半夏凝集素基因的结构与功能,开展掌叶半夏凝集素抗病虫害机制的研究奠定基础。
掌叶半夏;掌叶半夏凝集素;基因克隆;亚细胞定位
植物凝集素是一类非酶和非免疫起源的植物蛋白,含有至少一个非催化结构域且能可逆结合到特异糖及糖复合物[1]。自Herman Stillmark在蓖麻籽中发现蓖麻毒蛋白(Ricin)以来,现已从豆科、兰科、茄科、葱科、大戟科、百合科、禾本科、石蒜科、天南星科等植物中分离获得了1 000多种植物凝集素[2]。Van Danme等[3-4]根据氨基酸序列的同源性及其在进化上的关系,将植物凝集素分为7个基因家族,分别为豆科凝集素(The legume lectins)、含Hevein结构域的壳多糖结合蛋白(The chitin binding lectins composed of hevein domains)、Ⅱ型核糖体失活蛋白(RIP)、葫芦科韧皮部凝集素(Cucurbitaceae phloem lectins)、Jacalin相关凝集素(Jacalin-related lectins)、雪花莲相关凝集素(GNA-related agglutinin)和含蓖麻毒蛋白B结构域凝集素(Lectins with ricin-B domains)。已有研究表明,雪花莲相关凝集素家族对刺吸式口器的害虫(如叶蝉、蚜虫、豆象、飞虱、粉虱、棉铃虫等)及一些病原微生物具有显著的抑制或致死作用,且具有稳定性好、污染小及相对安全等优点,在病虫害防治方面已日益受到重视[5]。
掌叶半夏又名虎掌南星或简称为虎掌,为天南星科半夏属多年生草本植物,其性辛、味平、入肝经,具有燥湿化痰、祛风定惊、消肿散结之功效[6-8]。掌叶半夏的化学成分主要有生物碱、黄酮、多糖、甾醇、脂肪酸、氨基酸、掌叶半夏蛋白等[9-10]。掌叶半夏凝集素(Pinelliapedatisectaagglutinin,PPA)蛋白是掌叶半夏蛋白的重要组分之一,其隶属于与雪花莲相关的凝集素家族,能专一结合甘露糖,具有抗虫、抗菌、抗肿瘤和凝集血细胞等生物学活性[11-12]。孙光星等[13]应用Sephadex G-100分子筛层析、DE-32离子交换层析和制备电泳等方法首次从掌叶半夏中分离纯化出掌叶半夏凝集素A,分析发现,该蛋白为一糖蛋白,其分子量为16.3 kDa,等电点为5.8,主要含18种氨基酸。Lin等[14]分别以掌叶半夏叶片的DNA为模板克隆了PPA基因全长,结果显示,PPA基因的开放读码框的长度为777 bp,编码258个氨基酸的前体蛋白,与同属半夏凝集素序列的相似性很高。Wu等[15]以掌叶半夏块茎的cDNA为模板克隆了PPA基因,序列比对发现,PPA基因无内含子。
目前,对掌叶半夏凝集素的研究集中于其抗癌机制和转基因作物抗虫活性的研究等方面,对其亚细胞定位尚未见报道。本研究以掌叶半夏叶的基因组DNA为模板,根据已报道的掌叶半夏凝集素序列(GenBank登录号:HM593586)设计扩增引物,克隆了PPA基因的全长,并将其连接到含有增强型绿色荧光蛋白(eGFP)标记的植物表达载体pCAMBIA1300-35S上,通过分析基因序列,了解PPA基因的亚细胞定位,旨在为从显微水平上阐明掌叶半夏凝集素抗病虫害的作用机制奠定基础。
1 材料和方法
1.1 试验材料
以掌叶半夏为研究材料,样品采集自四川省南充市顺庆区白土坝乡,经西华师范大学彭正松教授鉴定为掌叶半夏(Pinelliapedatisecta),现栽培保存于西华师范大学生命科学院教学科研田。大肠杆菌DH5α由西华师范大学生命科学学院分子生物学实验室保存。植物表达载体pCAMBIA1300-35S-eGFP、农杆菌GV3101和本生烟Nicotianatabacum均由四川农业大学水稻重大病害抗性机制研究室王文明研究员惠赠。
1.2 掌叶半夏凝集素PPA基因的扩增
于2014年9月采集掌叶半夏单株,采用CTAB法提取叶片的DNA,并以之为模板,根据GenBank的PPA基因序列(登录号为HM593586),设计特异性引物PPA_F:5′-ACAGGTACCATGGCCTCCAAGCTCCTCCTCTTCCT-3′和PPA_R:5′-ACAGGTACCCGCGGCAATTGGGC-3′(划线部分为KpnⅠ酶切位点的序列)进行PCR扩增。反应体系为25 μL:KOD酶 0.5 μL,10×KOD PCR Buffer 2.5 μL,dNTP Mixture 2 μL,MgSO41 μL,DNA 2 μL,上下游引物各0.8 μL,灭菌双蒸 H2O 15.4 μL。PCR反应程序为:94 ℃预变性3 min,共30个循环包括:94 ℃变性15 s,65 ℃退火30 s,68 ℃ 延伸1 min,最后于72 ℃延伸10 min。PCR 产物经切胶纯化后,于16 ℃与 pEASY-Blunt 载体连接过夜,采用冻融法将连接产物转化至E.coliDH5α感受态细胞中,并涂布于含50 mg/mL卡那霉素(Kanamycin,Kan)的LB 固体培养基,37 ℃过夜培养。用PCR检测、酶切鉴定挑选阳性克隆,将其命名为pEASY-Blunt-PPA,送上海生工生物工程有限公司测序。
1.3 PPA基因对植物表达载体的转化
将鉴定正确的pEASY-Blunt-PPA用KpnⅠ单酶切,回收目的片段。同时将pCAMBIA1300-35S-eYFP用KpnⅠ单酶切和CIP处理,回收目的载体。用Implen超微量分光光度计分别测其浓度,根据目的基因与载体摩尔比10∶1计算出各所需的体积。用DNA ligation high连接酶连接目的片段和载体,再转化大肠杆菌DH5α感受态细胞,菌落PCR扩增、酶切筛选阳性克隆,将含正确片段的重组质粒命名为pCAMBIA1300-35S-PPA-eGFP,送上海生工测序。重组子向农杆菌GV3101的转化方法参照文献[16]。将重组子pCAMBIA1300-35S-PPA-eGFP通过冻融转化法导入农杆菌GV3101感受态细胞中,涂布在含50 mg/L利福平(Rifampicin,Rif)和50 mg/L Kan的YEB固体培养基,于28 ℃培养2 d。PCR检测、酶切鉴定阳性克隆,备用。
1.4 PPA-eGFP融合蛋白在烟草中的瞬时表达
将已鉴定的农杆菌单克隆接种到2 mL含Kan和Rif的YEB液体培养基,于28 ℃过夜培养。将菌液6 600 r/min离心2 min,弃上清收集菌体,用1 mL 缓冲液10 mmol/L MgCl2重悬。用1 mL无菌医用注射器吸取菌液,将菌液从叶片背面注射进叶片内,注射好后的本生烟于培养室照常培养,36 h后制片,在荧光共聚焦显微镜下观察本生烟叶背面荧光表达情况。试验重复3次。
1.5 序列分析
采用NTI软件进行引物设计;PPA基因氨基酸序列的翻译、相对分子量与等电点等预测采用瑞士生物信息学研究所网站http://expasy.org/完成;PPA基因的信号肽切割位点、亚细胞定位和结构域等预测分别采用在线软件SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)、WoLF PSORT(http://psort.hgc.jp/)和SMART(http://smart.embl-heidelberg.de/)程序完成;采用DNAMAN 6.0软件比对氨基酸序列;采用MEGA软件进行聚类分析。
2 结果与分析
2.1 PPA基因克隆及表达载体的构建
以掌叶半夏叶的基因组DNA为模板进行PCR扩增,电泳结果显示,扩增片段大小约为750 bp左右,与预期值相符(图1-A)。将PCR产物回收,克隆到pEASY-blunt载体,再转化到大肠杆菌DH5α,筛选阳性重组子,以PPA基因的ORF正确克隆提取质粒经KpnⅠ单酶切,同时将表达载体pCAMBIA1300-35S-eGFP用KpnⅠ单酶切并经CIP处理,用DNA ligation high将回收后的PPA基因连接到pCAMBIA1300-35S-eGFP,构建融合表达载体pCAMBIA1300-35S-PPA-eGFP,将其进行单酶切鉴定,结果表明,单酶切在10 kb和750 bp 左右分别有明显条带,结果与预期相符(图1-B)。进一步对载体的目标区域进行测序验证发现,PPA基因完整ORF的长度为777 bp,与GenBank数据库的HM593586的序列相似度为98.6%,编码区完整,表明载体构建成功。现已在GenBank中登录,其核苷酸序列的登录号为KF154981,氨基酸序列的登录号为AGV40779。
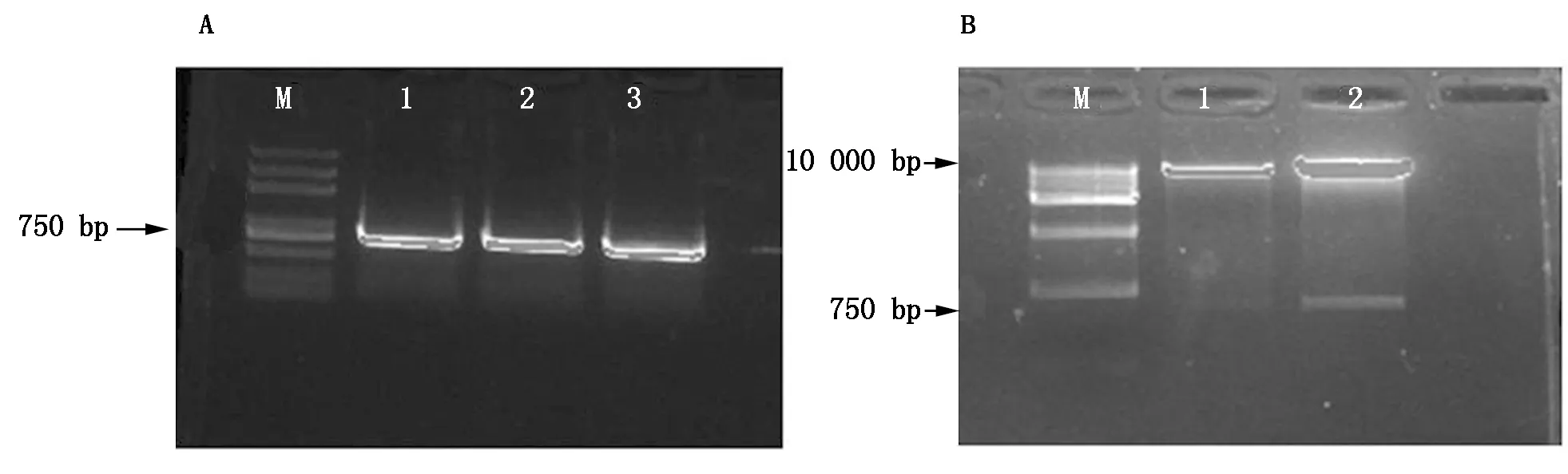
A:M.DM2000;1~3.PCR产物;B:M.DM10000;1~2.单酶切结果。A:M.DM2000;1-3.PCR production;B:M.DM10000;1-2.The result of single digestion.
2.2 PPA基因氨基酸序列分析
序列分析表明,PPA蛋白由258个氨基酸组成,分子质量为28.2 kDa,理论等电点为7.7。信号肽区域预测结果表明,PPA蛋白为分泌型蛋白,含一条24 aa的信号肽序列,切割位点在丙氨酸A与缬氨酸V之间。蛋白质结构域预测结果表明,PPA氨基酸序列含2个保守的B-lectin结构域,分别位于第27-133 aa和第148-255 aa处。此外,序列还含有3个甘露糖结合位点基序(QXDXNXVXY),分别位于52-60,173-181,235-243位。
结合前人所报道的PPA氨基酸序列分析发现(GenBank的登录号分别为ADK56179和AAR27793),3条PPA氨基酸序列长度差异不大为256~258 aa,其中本试验克隆的掌叶半夏凝集素序列AGV40779和ADK56179的长度均为 258 aa,序列AAR27793分别在102,139 aa处有2个氨基酸的缺失,长度为256 aa(图2)。除去缺失位点外,3条PPA氨基酸共含有39个变异位点,占序列总长的15.2%。其中,信号肽区含有4个氨基酸变异位点,占序列总长的1.5%;靠N端的B-lectin结构域含有21个氨基酸变异位点,占序列总长的8.2%;靠C端的B-lectin结构域含有9个氨基酸变异位点,占序列总长的3.5%(表1)。另外,3条PPA氨基酸序列的甘露糖结合位点基序上也存在差异,其中,第1个甘露糖结合位点的第2个氨基酸在天冬氨酸(D)和谷氨酸(E)之间变化;第2个结合位点的氨基酸序列完全一致;第3个结合位点的第5个氨基酸在苯丙氨酸(F)和亮氨酸(L)之间变化(表2)。

表1 掌叶半夏凝集素氨基酸序列的变异位点

表2 掌叶半夏凝集素甘露糖活性位点氨基酸序列分析
3条PPA氨基酸序列相似性为94.7%,其中,AGV40779与ADK56179序列相似性较高,为97%;而与AAR27793序列相似性较低,为86%,推测掌叶半夏凝集素基因AGV40779和AAR27793在结构和功能上可能存在一定的不同。此外,其与天南星、滴水珠、花南星和半夏凝集素的氨基酸序列相似性分别为96%,91%,86%和83%,说明天南星科植物凝集素序列存在较高的相似性,推测该科植物凝集素蛋白在部分功能上应具有相似性。
2.3 PPA基因氨基酸序列的相似性分析
将克隆所得的掌叶半夏凝集素(AGV40779)与已报道的天南星科5个物种9条凝集素氨基酸序列,即掌叶半夏凝集素(PPA,GenBank的登录号:AAR27793和ADK56179)、天南星凝集素(AHA、AAP50524和AAQ16181)、滴水珠凝集素(PCA,ABK88277)、花南星凝集素(ALA,AAS66304)和半夏凝集素(PTA,AAR27794、ABX47148和AFY06641)绘制进化树,结果表明,天南星科植物凝集素的氨基酸序列被分为两类,其中,本试验克隆所得的掌叶半夏凝集素AGV40779与掌叶半夏凝集素ADK56179、天南星凝集素、滴水珠凝集素和花南星凝集素聚为一类,而半夏凝集素和掌叶半夏凝集素AAR27793聚为另一类(图3)。推测天南星科植物中可能存在两类凝聚活力不同的凝集素基因。
2.4 PPA基因亚细胞定位
亚细胞定位预测表明PPA蛋白可在膜、细胞质和液泡中表达。为了进一步验证PPA的亚细胞定位,本试验构建了PPA融合蛋白植物表达载体pCAMBIA1300-35S-PPA-eGFP并导入农杆菌菌株GV3101,并在本生烟叶片进行瞬时表达中,培养36 h后,以FM4-64为荧光探针标记细胞膜,在激光共聚焦显微镜下观察。结果表明,重组质粒在细胞核内无分布,其绿色荧光点状散布于整个细胞膜上(图4-A),且该区域同FM4-64的红色荧光区域(图4-B)完全重叠(图4-C),表明PPA点状分布于细胞质膜上。

图2 掌叶半夏凝集素氨基酸序列比对

图3 基于Neighbor-joining方法构建掌叶半夏凝集素及相关序列的系统进化树

A.重组质粒pCAMBIA1300-35S-PPA-eGFP;B.FM4-64;C.A图和B图的融合图像。A.Represented pCAMBIA1300-35S-PPA-eGFP;B.Represented FM4-64;C.Represented Merged.
3 讨论
Wu等[15]从掌叶半夏球茎中克隆获得了PPA的cDNA序列全长,抗蚜虫鉴定表明,转基因烟草植株有效地抑制了蚜虫的增长。本试验以掌叶半夏叶片DNA为模板,克隆所得的掌叶半夏凝集素全长777 bp,编码258个氨基酸的前体蛋白,具有半夏属植物凝集素特有的信号肽序列、甘露糖结合位点基序和蛋白质结构域,与Wu等[15]所报道的核苷酸和氨基酸序列相似性分别为99%和97%,说明不同掌叶半夏植株的凝集素序列具有高度保守性,且该凝集素蛋白的分布不存在组织器官的特异性。Lin等[14]以掌叶半夏叶片的DNA为模板克隆了PPA基因,本试验克隆所得的掌叶半夏凝集素与其所报道的氨基酸序列相似性仅为86%,说明掌叶半夏的叶中存在2种同工凝集素。聚类结果表明,该2种掌叶半夏同工凝集素位于不同的大类中,推测其功能可能存在一定的不同。
植物凝集素的抗虫机制主要表现为三方面:植物凝集素可结合虫体中肠上皮细胞表面的特异糖化合物,干扰虫体对营养物质的吸收;可结合虫体的消化酶或转运蛋白中的聚糖结构,影响昆虫对食物的消化;可影响一些与虫体生理代谢相关基因的表达等[17-18]。本研究对PPA融合蛋白的共聚焦显微镜观察发现,转染pCAMBIA1300-35S-PPA-EGFP的细胞产生明显的绿色荧光蛋白,并且融合蛋白点状分布在质膜上。结合Wu等[15]的报道,推测当植物受到蚜虫伤害时,其质膜分布的PPA会分泌并特异结合蚜虫消化道上皮细胞表面的甘露糖,进而影响害虫对营养物质的吸收,抑制其生长发育和繁殖。
梁江丽等[19]在体外成功表达了掌叶半夏和半夏凝集素蛋白并对其凝集兔血红细胞的活性进行比较分析,结果发现,PPA的凝集活力为PTA的4倍,推测可能是第3个甘露糖结合位点(QDNGXGVXY)2个氨基酸的差异(X位点分别为Y/F;I/V)造成了2种半夏属植物凝集素的凝集活性不同。此外,笔者亦对PTA的亚细胞定位进行了分析,结果表明,PTA均匀分布于整个细胞膜上[20]。2种半夏属植物凝集素生物活性的差异,是否由第3个甘露糖结合位点序列的特异性和亚细胞定位的不同造成,此点有待深入研究。
[1] 向 阳,杜才富,马正强.Jacalin类凝集素研究进展[J].植物生理学报,2013,49(10):1023-1029.
[2] 蔡茜茜,李巧玲,刘舒云,等.植物凝集素研究与展望[J].食品科学技术学报,2013,3(6):51-57.
[3] Van Damme E J,Peumans W J,Barre A,et al.Plant lectins:A composite of several distinct families of structurally and evolutionary related proteins with diverse biological roles[J].Critical Reviews in Plant Sciences,1998,17(6):575-692.
[4] Peumans W J,Van Damme E J.Lectins as plant defense proteins[J].Plant Physiology,1995,109(2):347-352.
[5] 张小霞,曹素梅,梁振普,等.植物凝集素在抗刺吸式害虫转基因工程中的应用[J].植物保护,2010,36(4):23-28.
[6] 郁红礼,张 倩,吴 皓,等.掌叶半夏(虎掌南星)矾制前后致炎毒性比较研究[J].中国中药杂志,2013,38(22):3893-3897.
[7] 王 莉,杨永杰,归绥琪,等.掌叶半夏主要成分对子宫颈癌细胞生长的抑制作用[J].复旦学报:医学版,2009,36(6):675-680.
[8] 魏淑红,彭正松.半夏类药材研究概况[J].中药材,2003,26(11):828-832.
[9] 黄和平,聂久胜,黄 鹏,等.中国半夏属药用资源研究概况[J].中国现代中药,2014,16(3):258-261.
[10] 王 乾,王康才,郑晨曦,等.不同形态氮对掌叶半夏生长及块茎主要化学成分的影响[J].植物营养与肥料学报,2014(4):1038-1043.
[11] 赵 欢,彭正松.半夏属植物凝集素的研究进展[J].天然产物研究与利用,2014,26(9):1531-1537
[12] Lu Q,Li N,Luo J,et al.Pinelliapedatisectaagglutinin interacts with the methylosome and induces cancer cell death[J].Oncogenesis,2012,1(10):e29.
[13] 孙光星,丁声颂,钱瑶君.掌叶半夏凝集素A的分离纯化及分析[J].上海医科大学学报,1995,22(4):299-302.
[14] Lin J,Zhou X,Fei J,et al.Genomic cloning and characterization of aPPAgene encoding a mannose-binding lectin from Pinellia pedatisecta[J].Biocell,2006,30(1):15-25.
[15] Wu Z M,Yan H B,Pan W L,et al.Transform of an ectopically expressed bulb lectin gene fromPinelliapedatisectainto tobacco plants conferring resistance to aphids(Myzusnicotianae)[J].Aust J Crop Sci,2012,6(5):904-911.
[16] 贾小霞,齐恩芳,王一航,等.转录因子DREB1A基因和Bar基因双价植物表达载体的构建及对马铃薯遗传转化的研究[J].草业学报,2014,23(7):110-117.
[17] Xiang Y,Du C F,Zq M,et al.Progress in research on Jacalin-related lectins[J].Plant Physiol J,2013,49(10):1023-1029.
[18] De Hoff P,Brill L,Hirsch A.Plant lectins:the ties that bind in root symbiosis and plant defense[J].Molecular Genetics and Genomics ,2009,282(1):1-15.
[19] 梁江丽,陈 波,田晓平,等.三叶半夏和掌叶半夏凝集素原核表达及特性研究[J].中国生物工程杂志,2009,29(3):80-84.
[20] 赵 欢,彭正松,雷 杨,等.半夏凝集素基因的克隆、生物信息学分析及其蛋白的亚细胞定位[J].中草药,2014,45(13):1914-1919.
Genomic Cloning an Agglutinin Gene fromPinelliapedatisectaand Analysis on Its Subcellular Localization
ZHAO Huan
(College of Life Science,China West Normal University,Nanchong 637009,China)
To clonePinelliapedatisectaagglutinin gene(PPA)from the leaves ofPinelliapedatisecta,analyzed on its biological information characteristics,and observed its subcellular localization.The open reading frame sequence ofPPAgene was amplified by PCR method.The recombinant vector pCAMBIA1300-35S-PPA-eGFP was constructed and then transferred intoAgrobacteriumstrain GV3101.Agrobacteriumsuspensions expressing PPA were injected at different concentrations intoNicotianatabacumleaves and the subcellular location was observed by confocal laser scanning microscope.It showed that the open reading fragment sequence length ofPPAgene was 777 bp,encoding 258 amino acids with GenBank accession number KF154981 and AGV40779,respectively.It contained two conservative B-lectin domains and three mannose binding sites.Sequence alignment demonstrated that the deduced amino acid sequence of PPA,which were 96%,91%,86% and 83% identical respectively,with the corresponding region ofArisaemaheterophyllum,Pinelliacordata,ArisaemalobatumandPinelliaternata.The subcellular location results indicated that the PPA-eGFP was located in the plasma membrane as large spots,but not found in nucleus.The results would provide the foundation for further study the structure and function ofPPAgene,and elucidate anti-microbial mechanism of PPA.
Pinelliapedatisecta;Pinelliapedatisectaagglutinin;Gene cloning;Subcellular localization
2017-01-13
四川省教育厅重大培育项目(15CZ0015);西华师范大学青年教师资助专项(1D012);西华师范大学青年教师资助专项(14D012)
赵 欢(1982-),女,四川雅安人,讲师,博士,主要从事药用植物基因资源保护与研究开发。
Q78
A
1000-7091(2017)02-0032-06
10.7668/hbnxb.2017.02.005

