N-氢化诺卜基吡啶类卤化铵的合成及抑菌活性研究
金霖霖, 肖转泉, 范国荣*, 陈金珠, 王 鹏, 王宗德, 陈尚钘
(1.江西农业大学 林学院,江西 南昌 330045; 2.江西师范大学 化学化工学院,江西 南昌 330027; 3.江西农业大学 理学院,江西 南昌 330045)
N-氢化诺卜基吡啶类卤化铵的合成及抑菌活性研究
金霖霖1, 肖转泉2, 范国荣1*, 陈金珠3, 王 鹏1, 王宗德1, 陈尚钘1
(1.江西农业大学 林学院,江西 南昌 330045; 2.江西师范大学 化学化工学院,江西 南昌 330027; 3.江西农业大学 理学院,江西 南昌 330045)

JIN Linlin
以氢化诺卜基氯、氢化诺卜基溴和氢化诺卜基碘为原料,分别与吡啶及其同系物(α-甲基吡啶、4-二甲氨基吡啶、4-甲基吡啶)通过季铵化反应,制得N-氢化诺卜基吡啶类氯化铵、N-氢化诺卜基吡啶类溴化铵和N-氢化诺卜基吡啶类碘化铵共7种氢化诺卜基吡啶的季铵盐类化合物,分别为N-氢化诺卜基吡啶溴化铵(2a)、N-氢化诺卜基吡啶碘化铵(2b)、N-氢化诺卜基吡啶氯化铵(2c)、N-氢化诺卜基-γ-二甲氨基吡啶溴化铵(2d)、N-氢化诺卜基-γ-二甲氨基吡啶碘化铵(2e)、N-氢化诺卜基-α-甲基吡啶碘化铵(2f)、N-氢化诺卜基-γ-甲基吡啶溴化铵(2g)。采用了质谱(MS),核磁共振(1H NMR,13C NMR)及红外光谱(FT-IR)表征了化合物的结构;采用菌丝生长速率法测试了7种化合物对葡萄座腔菌(Botryosphaeriadothidea)、柑橘茎点霉菌(Phomacitricarpa)、柑橘炭疽刺盘孢菌(Colletotrichumglecosporioides)、猕猴桃拟盘多毛孢菌(Pestalotiopsisactinidia)和枣拟茎点霉菌(Phomopsismauritiana)的抑制效果。结果表明:在500 mg/L下,7种化合物对5种供试病原菌均具有一定的抑制效果,2d和2e对柑橘茎点霉菌和猕猴桃拟盘多毛孢菌的抑菌率为100%,均高于对照样多菌灵对这2种病原菌的抑制率,而2d对葡萄座腔菌的抑制率达到100%,与对照样多菌灵的抑菌效果一样。
氢化诺卜基; 吡啶; 季铵盐; 合成; 结构分析; 抑菌活性
β-蒎烯主要存在于松节油中,是松节油的主要成分之一,其化学性质活泼,具有天然和可再生性的优势。对β-蒎烯活泼的官能团进行改性修饰,可得到一系列性能优良的产品[1],并用于香料、医药、食品、农业、林业等行业[2-4]。本课题组将β-蒎烯作为单独的起始原料,合成诺卜醇、氢化诺卜醇[5],然后经过一系列的反应合成其羧酸酯[6],卤化物[5],氢化诺卜酸的酰胺类化合物[7],烷基醚[8],氢化诺卜基甲酸及其酰胺化合物[9],酯类化合物[10],氢化诺卜醛及其环状缩醛类化合物[11]以及氢化诺卜基3同烷基卤化铵[12],并对其中多种化合物进行了一些生物活性(驱避性、抑菌等)测试,实验结果表明:其中有些化合物具有一定的生物活性[13],且氢化诺卜基3同烷基卤化铵中氢化诺卜基三乙基碘化铵及氢化诺卜基三正丁基溴化铵在体外抗肿瘤活性试验中表现出良好的体外抗肿瘤活性[12]。作者将氢化诺卜醇的卤代物分别与吡啶、α-甲基吡啶、 4-甲基吡啶、 4-二甲氨基吡啶反应,合成了氢化诺卜基吡啶类卤化铵共7种季铵盐类化合物,并采用质谱(MS)、核磁共振(1H NMR,13C NMR)及红外光谱(FT-IR)表征了化合物的结构,并以5种真菌为供试菌种,以多菌灵为阳性对照,采用生长速率法测定这7种氢化诺卜基吡啶类卤化铵的抑菌活性。本研究增加了萜类化合物的品种、数量以及在抑菌方面的应用,有利于开发β-蒎烯利用新途径,为β-蒎烯的精细化学利用提供了一定的理论基础。
1 实 验
1.1 试剂、菌种与仪器
氢化诺卜基卤代物(按文献[5]自制);吡啶、α-甲基吡啶、 4-甲基吡啶、 4-二甲氨基吡啶(DMAP)、石油醚等,市售分析纯;多菌灵,天津市汉邦植物保护剂有限责任公司。
葡萄座腔菌(Botryosphaeriadothidea)、柑橘茎点霉菌(Phomacitricarpa)、柑橘炭疽刺盘孢菌(Colletotrichumglecosporioides)、猕猴桃拟盘多毛孢菌(Pestalotiopsisactinidia)、枣拟茎点霉菌(Phomopsismauritiana),均由江西农业大学农学院植物病理教研室提供。
福立GC9790型气相色谱仪,HW-2000色谱工作站(千谱软件有限公司);BRUKER AVANCE 400型核磁共振仪(TMS为内标,CDCl3作溶剂,1H NMR观测频率为400 MHz,13C NMR观测频率为 100 MHz);Nicolet IR 6700红外光谱仪(KBr压片法),BRUKER amaZon SL质谱仪;电热恒温培养箱、电热恒温鼓风干燥箱、超净工作台、LDZX型立式不锈钢压力蒸汽灭菌锅、微波炉、移液枪等实验室常用仪器。
1.2 合成路线
氢化诺卜基卤代物(1)分别与吡啶,α-甲基吡啶、 4-甲基吡啶、 4-二甲氨基吡啶反应合成制得7种季铵盐(2a~2g)(见图1)。

图1 N-氢化诺卜基吡啶类卤化铵(2a~2g)的合成路线
1.3 氢化诺卜基吡啶季铵盐的合成
在装有冷凝回流装置和搅拌子的100 mL的锥形瓶中加入约0.01 mol的1、0.02 mol 吡啶、α-甲基吡啶、 4-甲基吡啶或4-二甲氨基吡啶和适量石油醚(60~90 ℃),在70~75 ℃加热数小时后,冷却结晶,过滤出固体,并用石油醚淋洗数次,重结晶,真空干燥,得到季铵盐(2)。
1.4 结构表征
取少量洗涤后且干燥过的化合物,采用KBr压片法在Nicolet IR 6700红外光谱仪上进行测定,扫描范围为4000~450 cm-1;采用Bruker Avance 400型核磁共振仪,以TMS为内标物,以CDCl3为溶剂,在400 HMz的观测频率下测定1H NMR,在100HMz的观测频率下测定13C NMR;采用电喷雾电离源(ESI)在BRUKER amaZon SL 质谱仪进行质谱分析。
1.5 抑菌活性测定
采用生长速率法测定所合成的季铵盐类化合物对上述5种真菌的抑制作用。将合成的7种化合物用无菌水溶解,并稀释成质量浓度为5 g/L的溶液,然后与配置好且已灭菌的马铃薯葡萄糖琼脂培养液(PDA)以体积比1 ∶9混合,得到最终质量浓度为500 mg/L的含药培养液,将含药培养液倒入9 cm的培养皿中,得到含药液的平板,每个浓度重复3个培养皿。以多菌灵作阳性对照,比较7种化合物对5种真菌菌丝的抑制效果,以空白组为阴性对照,接菌后置于 25 ℃ 恒温培养箱中培养数天后,采用十字交叉法测量菌落直径,根据菌落直径计算各化合物对真菌的抑制率,使用DPS和SPSS等数理统计软件对数据进行统计分析。计算抑制率的公式如下:
菌落直径=菌落实际生长直径-菌饼直径
抑制率=(对照组菌落直径-处理组菌落直径)/对照组菌落直径×100%
本实验中菌饼直径为0.5 cm。活性分级指标:抑菌率≥90%为A级;抑菌率70%~90%为B级;抑菌率50%~70%为C级;抑菌率<50%为D级[14]。
2 结果与讨论
2.1 反应分析
吡啶及其同系物分子中的氮原子上有一对孤对电子,是分子中电子云密度较高的地方,因而这些化合物都具有一定的亲核性,它们与卤代烷能发生季铵化反应而生成相应的季铵盐。卤代烷的反应活性以碘代烷最强,溴代烷次之,氯代烷最差。而吡啶分子中,环上α-位有取代基(如甲基)时,氮原子的亲核进攻能力受到很大的空间阻碍,反应能力大为削弱,所以目前只合成得到7种季铵盐。
2.2 7种季铵盐的结构分析
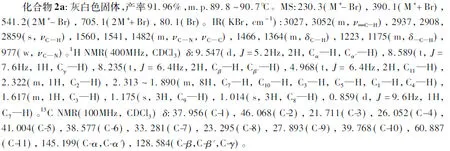
化合物2b:淡黄色固体,产率65.93%,m.p. 136.4~138.4℃。MS:230.4(M+-I), 484.0(M++I), 587.2(2M+-I), 840.9(2M++I), 127.3(I)。IR(KBr, cm-1) :3049(m,ν—C—H), 2984, 2936, 2902, 2861(s,νC—H), 1560, 1482(m,νC—N,νC—C), 1466, 1383, 1366(m,δC—H), 1207, 1166(m,δ—C—H), 926(w,νC—N)。1H NMR(400MHz, CDCl3)δ:9.443(d,J=5.6Hz, 2H, Cα—H, Cα′—H), 8.629(t,J= 7.2Hz, 1H, Cγ—H), 8.217(t,J= 6.4Hz, 2H, Cβ—H, Cβ′—H), 4.921(t,J= 8.6Hz, 2H, C11—H), 2.328(m, 1H, C2—H), 2.141~1.801(m, 8H, C7—H, C10—H, C3—H, C5—H, C1—H,C4—H), 1.615(m, 1H, C3—H), 1.185(s, 3H, C9—H), 1.022(s, 3H, C8—H), 0.871(d,J=9.2 Hz, 1H, C7—H)。13C NMR(100MHz, CDCl3)δ:37.929(C-1), 45.993(C-2), 21.861(C-3), 26.067(C- 4), 41.030(C-5), 38.647(C-6), 33.319(C-7), 23.408(C-8), 27.939(C-9), 39.625(C-10), 61.068(C-11), 144.890(C-α), 128.653(C-β,C-γ,C-β′), 145.697(C-α′)。经表征,确定化合物2b为N-氢化诺卜基吡啶碘化铵,分子式为C16H24NI。
化合物2c:褐色固体,产率60.05%,m. p. 170.2~171.4℃。MS:230.4(M+-Cl), 300.5(M++Cl), 495.4(2M+-Cl), 565.5(2M++Cl), 35.5(Cl)。IR(KBr, cm-1) :3054, 3028(m,ν—C—H), 2934, 2907, 2865(s,νC—H), 1560, 1541, 1482(m,νC—N,νC—C), 1468, 1365(m,δC—H), 1224, 1176(m,δ—C—H), 941(w,νC—N)。1H NMR(400MHz, CDCl3)δ:9.495(d,J=5.6Hz, 2H, Cα—H, Cα′—H), 8.508(t,J= 7.6Hz, 1H, Cγ—H), 8.172(t,J=6.8Hz, 2H, Cβ—H, Cβ′—H), 4.913(m, 2H, C11—H), 2.270(m, 1H, C2—H), 2.092(m, 1H, C7—H), 1.995~1.803(m, 7H, C10—H, C3—H, C5—H, C1—H,C4—H), 1.548(m, 1H, C3—H), 1.130(s, 3H, C9—H), 0.966(s, 3H, C8—H), 0.809(d,J=10Hz, 1H, C7—H)。13C NMR(100MHz, CDCl3)δ:37.969(C-1), 46.124(C-2), 21.694(C-3), 26.081(C-4), 41.024(C-5), 38.596(C-6), 33.312(C-7), 23.294(C-8), 27.913(C-9), 39.833(C-10), 60.916(C-11) , 145.199(C-α,C-α′), 128.605(C-β, C-β′),141.076(C-γ)。经表征,确定化合物2c为N-氢化诺卜基吡啶氯化铵,分子式为C16H24NCl。
化合物2d:白色固体,产率71.03%, m.p. 99.3~100.7℃。MS:273.4(M+-Br), 433.2(M++Br), 625.3(2M+-Br), 785.2(2M++Br), 81.7(Br)。IR(KBr, cm-1) :3027(m,ν—C—H), 2979, 2901, 2864(s,νC—H), 1566, 1538(m,νC—N,νC—C), 1444, 1383(m,δC—H), 1231, 1205, 1174, 1069, 1036(m,δ—C—H), 944(w,νC—N)。1H NMR(400MHz, CDCl3)δ:8.463(s,2H, Cα—H, Cα′—H), 7.117(s, 2H, Cβ—H, Cβ′—H), 4.312(m, 2H, C11—H), 3.295(s, 6H, N(CH3)2), 2.321(m, 1H, C2—H), 2.049~1.800(m, 8H, C7—H, C10—H, C3—H, C5—H, C1—H,C4—H), 1.514(m, 1H, C3—H), 1.174(s, 3H, C9—H), 0.991(s, 3H, C8—H), 0.854(d,J=8.8Hz, 1H, C7—H)。13C NMR(100MHz, CDCl3)δ:37.720(C-1), 46.078(C-2), 21.793(C-3), 26.084(C- 4), 41.040(C-5), 38.592(C-6), 33.331(C-7), 23.290(C-8), 27.933(C-9), 38.840(C-10), 56.906(C-11), 142.303(C-α,C-α′),108.546(C-β, C-β′),156.127 (C-γ), 40.566(C-γ—N)。经表征,确定化合物2d为N-氢化诺卜基-γ-二甲氨基吡啶溴化铵,分子式为C18H29N2Br。
化合物2e:淡黄色固体,产率95.87%,m.p. 171.2~171.7℃。MS:273.4(M+-I), 527.2(M++I), 673.1(2M+-I), 927.2(2M++I), 127.2(I)。IR(KBr, cm-1) :3021(m,ν—C—H), 2979, 2931, 2912, 2862(s,νC—H), 1561, 1540(m,νC—N,νC—C), 1466, 1448, 1378,1362(m,δC—H), 1235, 1202, 1179, 1068, 1038(m,δ—C—H), 947(w,νC—N)。1H NMR(400MHz, CDCl3)δ:8.400(d,J=6.4Hz, 2H, Cα—H, Cα′—H), 7.092(d,J=6Hz, 2H, Cβ—H, Cβ′—H), 4.308(m, 2H, C11—H), 3.313(s, 6H, N(CH3)2), 2.328(m, 1H, C2—H), 2.100~1.821(m, 8H, C7—H, C10—H, C3—H, C5—H, C1—H,C4—H), 1.526(m, 1H, C3—H), 1.180(s, 3H, C9—H), 1.003(s, 3H, C8—H), 0.866(d,J=9.2 Hz, 1H, C7—H)。13C NMR(100MHz, CDCl3)δ:37.683(C-1), 46.007(C-2), 21.829(C-3), 26.062(C- 4), 41.016(C-5), 38.591(C-6), 33.316(C-7), 23.327(C-8), 27.932(C-9), 38.796(C-10), 56.950(C-11), 145.221(C-α), 108.643(C-β, C-β′), 156.040(C-γ), 142.221(C-α′), 40.853(C-γ—N)。经表征,确定化合物2e为N-氢化诺卜基-γ-二甲氨基吡啶碘化铵,分子式为 C18H29N2I。
化合物2f:淡黄色固体,产率82.04%,m.p. 162.1~163.5℃。MS:244.4(M+-I), 498.0(M++I), 615.2(2M+-I), 868.9(2M++I), 127.3(I)。IR(KBr, cm-1) :3058, 3032(m,ν—C—H), 2979, 2932, 2865(s,νC—H), 1572, 1541, 1509, 1477(m,νC—N,νC—C), 1458, 1382, 1364(m,δC—H), 1290, 1165, 1145, 1045(m,δ—C—H), 955(w,νC—N)。1H NMR(400MHz, CDCl3)δ:9.410(s,1H, Cα′—H), 8.516(t,J= 7.6Hz, 1H, Cγ—H), 8.132(d,J=7.6Hz, 1H, Cβ—H), 7.939(m, 1H, Cβ′—H), 4.763(m, 2H, C11—H), 3.010(s, 3H, Cα—CH3), 2.361(m, 1H, C2—H), 2.243~1.804(m, 8H, C7—H, C10—H, C3—H, C5—H, C1—H,C4—H), 1.562(m, 1H, C3—H), 1.196(s, 3H, C9—H), 1.022(s, 3H, C8—H), 0.922(d,J=9.2Hz, 1H, C7—H)。13C NMR(100MHz, CDCl3)δ:38.332(C-1), 45.925(C-2), 22.077(C-3), 26.060(C- 4), 40.971(C-5), 38.620(C-6), 33.288(C-7), 23.445(C-8), 27.958(C-9), 38.317(C-10), 57.737(C-11), 154.116(C-α), 145.481(C-β), 126.553(C-γ), 130.789(C-β′), 145.916(C-α′), 21.127(C-α—C)。经表征,确定化合物2f为N-氢化诺卜基-α-甲基吡啶碘化铵,分子式为C17H26NI。
化合物2g:白色固体,产率71.27%,m.p. 44.6~45.6℃。MS:244.3(M+-Br), 404.1(M++Br), 569.2(2M+-Br) , 727.1(2M+-Br), 81.5(Br)。IR(KBr, cm-1) :3047, 3027(m,ν—C—H), 2982, 2939, 2901, 2864(s,νC—H), 1575, 1558, 1518, 1473(m,νC—N,νC—C), 1435, 1383, 1362(m,δC—H), 1174, 1034(m,δ—C—H), 952(w,νC—N)。1H NMR(400MHz, CDCl3)δ:9.222(s, 2H, Cα—H, Cα′—H), 7.866(s, 2H, Cβ—H, Cβ′—H), 4.722(m, 2H, C11—H), 3.011(m, 1H, C2—H), 2.573(s, 3H, Cγ—CH3), 2.193(m, 1H, C7—H), 1.997~1.758(m, 7H, C10—H, C3—H, C5—H, C1—H,C4—H), 1.478(m, 1H, C3—H), 1.046(s, 3H, C9—H3), 0.882(s, 3H, C8—H3), 0.733(d,J=8.8Hz, 1H, C7—H)。13C NMR(100MHz, CDCl3)δ:37.851(C-1), 46.065(C-2), 22.221(C-3), 26.051(C- 4), 41.008(C-5), 38.556(C-6), 33.272(C-7), 23.263(C-8), 27.885(C-9), 39.550(C-10), 59.991(C-11), 144.162 (C-α, C-α′), 128.997(C-β, C-β′), 158.176 (C-γ), 21.696(C-γ—C)。经表征,确定化合物2g为N-氢化诺卜基-γ-甲基吡啶溴化铵,分子式为C17H26NBr。
7种化合物的红外光谱图上具有吡啶环上的C—N,C—C吸收峰,且核磁共振数据分析也都表征了分子中各碳原子和氢原子的存在。
从以上谱图数据可以看出化合物2a~2g的结构与理论目标化合物结构相吻合。
2.3 化合物的抑菌活性
在500 mg/L的质量浓度下,7个化合物对5种供试病原菌的抑制率数据列于表1。

表1 化合物对5种植物病原菌的抑制率(500 mg/L)
从表1数据可以看出, 7个化合物对5种供试病原菌均具有一定的抑制效果,其中2d和2e对柑橘茎点霉菌和猕猴桃拟盘多毛孢菌的抑制率均达100%, 2d对葡萄座腔菌的抑制率达100%,等同于对照样多菌灵,活性级别均为A级。除此之外,化合物2e对葡萄座腔菌的抑制率为92.28%,化合物2f对猕猴桃拟盘多毛孢菌的抑制率为90.23%,化合物2e对枣拟茎点霉菌的抑制率为97.54%,活性级别均为A级。化合物2g对柑橘茎点霉菌的抑制率为76.36%(活性级别为B级)。而化合物2c对枣拟茎点霉菌具有稍微的促进作用,抑制率为-1.28%。
3 结 语
3.1 由氢化诺卜基卤代物分别和吡啶及其同系物反应,共合成了7个N-氢化诺卜基吡啶类卤化铵,采用MS,1H NMR,13C NMR及FT-IR表征了它们的结构,确定这7种化合物为目标化合物。
3.2 采用菌丝生长速率法测试了7个化合物对葡萄座腔菌、柑橘茎点霉菌、柑橘炭疽刺盘孢菌、猕猴桃拟盘多毛孢菌和枣拟茎点霉菌的抑制效果,从抑菌活性数据可知:在质量浓度为500 mg/L下, 化合物2c(R=H,X=Cl)对枣拟茎点霉菌具有促进作用,且对其他4种真菌的抑制率也不高,活性级别均在D级以下,作为抗菌剂的应用价值较低,其他化合物对5种真菌具有一定抑制效果,其中化合物2d(R=4-N(CH3)2,X=Br),2e(R=4-N(CH3)2,X=I)对柑橘茎点霉菌和猕猴桃拟盘多毛孢菌的抑制率都为100%,均高于多菌灵对这两种病原菌的抑制率,化合物2f(R=2-CH3,X=I)对柑橘茎点霉菌以及猕猴桃拟盘多毛孢菌的抑制率分别为63.23%、 90.23%,均高于多菌灵对这两种菌的抑制效果(抑制率分别为51.40%,89.26%),活性级别均在C以上,有些化合物的活性级别已达到A级,因此,具有良好的抑制效果,值得进一步研究。
[1]商士斌,宋湛谦. 我国林产化学品“十一五”发展思路[J]. 精细与专用化学品, 2006, 14(8): 1-5. SHANG S B, SONG Z Q. Development ideals for China′s forestry chemicals during the period of eleventh five-year plan[J]. Fine and Specialty Chemicals, 2006, 14(8): 1-5.
[2]张东峰. 植物精油的研究开发新进展[J]. 河北化工, 2008, 31(2): 10-12. ZHANG D F. Advances in the research and the development of plant essential oils[J]. Hebei Chemical Engineering and Industry, 2008,31(2):10-12.
[3]王宗德,宋湛谦. 松节油合成香料的研究现状(一)[J]. 精细与专用化学品, 2003, 11(12): 3-5. WANG Z D, SONG Z Q. Research status of turpentine yynthetic fragrance (1) [J]. Fine and Specialty Chemicals, 2003, 11(12): 3-5.
[4]赵振东,刘先章. 松节油的精细化学利用(Ⅰ)——松节油及精细化学利用基础[J]. 林产化工通讯, 2001, 35(1): 42-47. ZHAO Z D, LIU X Z. Fine chemical utilization of turpentine oil (Ⅰ):Basis of turpentine and fine chemical utilization[J]. Journal of Chemical Industry of Forest Products, 2001, 35(1):42-47.
[5]赵玲华,肖转泉,陈金珠,等. 氢化诺卜醇及其卤代物的合成与结构分析[J]. 林产化学与工业, 2012, 32(1): 39-42. ZHAO L H, XIAO Z Q, CHEN J Z, et al.Synthesis and structural analysis of hydronopol and its halides[J]. Chemistry and Industry of Forest Products, 2012, 32(1): 39-42.
[6]赵玲华,刘显亮,肖转泉,等. 氢化诺卜醇及其羧酸酯的合成与结构分析[J]. 江西师范大学学报:自然科学版, 2012, 36(1): 12-15. ZHAO L H, LIU X L, XIAO Z Q, et al. The synthesis and structural analysis for hydronopol and its carboxylic ethers[J]. Journal of Jiangxi Normal University:Natural Science, 2012, 36(1):12-15.
[7]赵玲华,肖转泉,陈金珠,等. 氢化诺卜酸及其酰胺的合成[J]. 化学研究与应用, 2013, 25(2): 245-248. ZHAO L H, XIAO Z Q, CHEN J Z, et al. Synthesis of hydronopic acid and its acidamide[J]. Chemical Research and Application, 2013, 25(2): 245-248.
[8]赵玲华,肖转泉,陈金珠,等. 氢化诺卜醇及其烷基醚的合成与表征[J]. 化学研究与应用, 2012, 24(1): 123-126. ZHAO L H, XIAO Z Q, CHEN J Z, et al. Synthesis and identification of hydronopol and its alkyl ethers[J]. Chemical Research and Application, 2012, 24(1): 123-126.
[9]刘艳,肖转泉,卢平英,等. 氢化诺卜基甲酰胺类化合物的合成与结构表征[J]. 江西师范大学学报:自然科学版, 2013, 37(5): 515-518. LIU Y, XIAO Z Q, LU P Y, et al. The synthesis and structural characterization of hydronopylformamide compounds[J]. Journal of Jiangxi Normal University:Natural Science, 2013, 37(5): 515-518.
[10]刘艳,肖转泉,卢平英,等. 氢化诺卜基甲酸及其酯的合成与结构分析[J]. 林产化学与工业, 2013, 33(4): 57-61. LIU Y, XIAO Z Q, LU P Y, et al. Synthesis and structural analysis of hydronopyl formic acid and its ester[J]. Chemistry and Industry of Forest Products, 2013, 33(4): 57-61.
[11]徐丽锋,肖转泉,王鹏,等. 氢化诺卜醛环状缩醛类化合物的合成及其抑菌活性[J]. 江西师范大学学报:自然科学版, 2014, 38(5): 472-475. XU L F, XIAO Z Q, WANG P, et al. The synthesis and antifungal activity of cyclic acetal hydronopic aldehyde derivatives[J]. Journal of Jiangxi Normal University:Natural Science, 2014, 38(5): 472-475.
[12]金霖霖,肖转泉,陈金珠,等. 氢化诺卜基3同烷基卤化铵的合成与结构分析[J]. 江西师范大学学报: 自然科学版, 2015, 39(5): 484-487. JIN L L, XIAO Z Q, CHEN J Z, et al. The synthesis and structural analysis for hydronopyl tri-alkyl ammonium halides[J]. Journal of Jiangxi Normal University:Natural Science, 2015, 39(5):484-487.
[13]WANG Z, SONG J, HAN Z, et al. Quantitative structure:Activity relationship of terpenoid aphid antifeedants[J]. Journal of Agricultural and Food Chemistry, 2008, 56(23): 11361-11366.
[14]黄铎云,段文贵,林桂汕,等.2-取代酰氨基-5-(α-龙脑烯醛基)-1,3,4-噻二唑化合物的合成及抑菌活性[J]. 林产化学与工业, 2016, 36(1): 61-69. HUANG D Y, DUAN W G, LIN G S, et al. Synthesis and antifungal activities of 2-sustituted acylamino-5-(α-campholenic aldehyde)-based-1,3,4-thiadiazole compounds[J]. Chemistry and Industry of Forest Products, 2016,36(1):61-69.
大型精密仪器 准确分析结果
中国林业科学研究院林产化学工业研究所仪器分析中心
中国林业科学研究院林产化学工业研究所仪器分析中心是江苏省大型仪器协作共用及维修网成员单位。以开展分析测试服务、分析测试技术与方法研究为主要任务。提供无机化合物分析、有机化合物的定性和结构分析、有机化合物组成定量分析、固体粉末或乳液中颗粒的粒度分布测定、微孔物质的比表面积和孔隙度测定等分析测试服务,承接所内外的样品测试任务。
美国 Agilent 公司7200GCQTOF气质联用仪
美国 Agilent 公司7890A/5975C气质联用仪
美国 Agilent 公司LC/MSD Trap SL液质联用仪
美国PE公司OPTIMA 7000DV电感耦合等离子体发射光谱仪
美国 PE公司Diamond DSC 差示扫描量热仪
美国PE公司PE-2400元素分析仪
美国Waters公司1515凝胶色谱仪
美国麦克仪器公司ASAP 2020M自动比表面积及物理吸附分析仪
美国TA公司Q800动态热机械分析仪美国赛默飞世尔公司MARS旋转流变仪
美国赛默飞世尔公司iS10 红外光谱仪
美国赛默飞世尔公司Delta V advantage同位素质谱仪
美国赛默飞世尔公司TherMax 500高压热重分析仪
日本 Shimadzu公司LC-20A液相色谱仪
日本日立公司S3400N-Ⅰ型扫描电子显微镜
日本岛津公司LCMS-IT-TOF液质联用仪
日本岛津公司SPM-9600 原子力显微镜
德国耐驰公司QMS403热质联用仪
德国耐驰公司ARC244绝热加速量热仪
德国Kruss公司DSA100 接触角测量仪
德国布鲁克公司D8 X射线粉末多晶衍射仪
英国FTT公司FTT2000 锥形量热仪
英国马尔文公司Nano ZS 纳米粒度、 Zeta电位和绝对分子量分析仪
英国 马尔文公司Mastersizer 2000激光粒度仪
法定检验机构 第三方公正评价
国家林业局林化产品质量检验检测中心(南京)
该中心是国家林业局授权的法定检测机构,具有第三方公正地位,挂靠中国林业科学研究院林产化学工业研究所。是国内唯一一家通过国家计量认证的林化产品专业检测机构。可对下列产品进行质量监督和产品质量检验:
脂松香及再加工产品
松节油及再加工产品
栲胶原料、栲胶产品
活性炭产品
单宁酸原料、工业单宁酸、工业没食子酸、 络合剂等
纤维原料、纸浆和纸产品
其他归口的林化产品
欢迎来人来函联系产品分析和产品质量检验
联系电话: 025-85482448 85482449 联系地址: 南京市锁金五村16号 林化所内
传 真: 025-85482448 联系人: 谭卫红
Synthesis and Antifungal Activity of Series of N-Hydronopol Pyridine Ammonium Halide
JIN Linlin1, XIAO Zhuanquan2, FAN Guorong1, CHEN Jinzhu3, WANG Peng1, WANG Zongde1, CHEN Shangxing1
(1.College of Forestry,Jiangxi Agricultural University, Nanchang 330045, China; 2.College of Chemistry, Jiangxi Normal University, Nanchang 330027, China; 3.College of Science, Jiangxi Agricultural University, Nanchang 330045, China)
Seven N-hydronopol pyridine quaternary ammonium salts,which named which named N-hydronopyl pyridine ammonium bromide(2a), N-hydronopyl pyridine ammonium iodide(2b), N-hydronopyl pyridine ammonium chloride(2c), N-hydronopyl-γ-dimethylamino pyridine ammonium bromide(2d), N-hydronopyl-γ-dimethylamino pyridine ammonium iodide(2e), N-hydronopyl-α-methyl pyridine ammonium iodide(2f), N-hydronopyl-γ-methyl pyridine ammonium bromide(2g), were prepared from the quaternization reaction of pyridine or pyridine homologues(α-methylpyridine, 4-dimethylaminopyridine, 4-methylpyridine) with hydronopol halides chloride, hydronopol halides bromide, hydronopol halides iodide, respectively. The identification and structural analysis were done by using MS, NMR(1H NMR,13C NMR) and FT-IR methods. And the antifungal activities of all compounds againstBotryosphaeriadothidea,Phomacitricarpa,Colletotrichumglecosporioides,PestalotiopsisactinidiaandPhomopsismauritianawere studied by using the mycelial growth rate method. The antifugal activity test showed that at the mass concentration of 500 mg/L, the compounds had certain antifungal activity against five tested phytopathogens. Among all compounds, the inhibition rates of 2d and 2e againstP.citricarpa,P.actinidiawere 100% and higher than the inhibitory effect of carbendazim. And the inhibition rate of 2d againstB.dothideawere 100% and equal to the inhibitory effect of carbendazim.
hydronopol; pyridine; quaternary ammonium salts; synthesis; structural analysis; antifungal activity
10.3969/j.issn.0253-2417.2017.03.017
2016- 10-31
国家自然科学基金资助项目(31360163);江西省林业科技创新专项(201502)
金霖霖(1992— ),女,江西萍乡人,硕士生,从事植物资源化学利用研究
*通讯作者:范国荣,副研究员,硕士,从事林产化工教学与科研工作;E-mail: fgr008@126.com。
TQ35;Q621.3
A
0253-2417(2017)03- 0122-07
金霖霖,肖转泉,范国荣,等.N-氢化诺卜基吡啶类卤化铵的合成及抑菌活性研究[J].林产化学与工业,2017,37(3):122-128.

