莱菔硫烷对帕金森病大鼠脑内多巴胺能神经元的保护作用及机制
先锋 郭斌 秦寿泽 吴艳芬
·论著·
莱菔硫烷对帕金森病大鼠脑内多巴胺能神经元的保护作用及机制
先锋 郭斌 秦寿泽 吴艳芬
目的 观察莱菔硫烷(sulforaphane,SF)对帕金森(PD)病大鼠模型脑内黑质多巴胺能神经元的保护作用。方法 健康成年雄性Wistar大鼠背部皮下注射鱼藤酮制备PD大鼠模型,药物治疗组同时给予大鼠腹腔注射EGCG。采用分光光度法检测大鼠脑内丙二醛(MDA)和还原型谷胱甘肽(GSH),免疫细胞化学和免疫印记检测大鼠中脑黑质及纹状体中络氨酸羟化酶(TH)的表达变化。结果 Western blot结果显示试验组大鼠脑内中脑和纹状体中TH蛋白表达都比对照组有明显降低(P<0.05);莱菔硫烷药物干预后TH蛋白在中脑和纹状体比试验组明显增高(P<0.05),但是较对照组仍有明显减少(P<0.05)。实验组大鼠在给予鱼藤酮背部皮下注射后导致大鼠脑内纹状体中脂质代谢产物MDA含量比对照组明显增加(P<0.01)。莱菔硫烷药物干预组大鼠脑内纹状体中MDA明显减少(P<0.05),但较对照组仍明显增加(P<0.05)。同时我们发现鱼藤酮背部皮下注射可以导致实验组大鼠脑内纹状体中GSH的含量比对照组明显减少(P<0.01);莱菔硫烷药物干预后大鼠脑内纹状体中GSH含量较实验组明显增加(P<0.05),但较对照组仍明显减少(P<0.05)。结论 氧化应激在PD发病中起着非常重要的作用,抗氧化治疗能有效减轻大鼠脑内多巴胺能神经元损伤情况,同时改善PD样症状,为PD的治疗提供了新的靶点。
帕金森病;多巴胺;莱菔硫烷;酪氨酸羟化酶;谷胱甘肽; 丙二醛
帕金森病(Parkinson’s disease)是一种中老年人常见的神经退行性疾病,其病因尚不明确,临床表现为静止性震颤、运动迟缓和肌张力增高等症状[1]。患者病情呈进行性加重,患者为其生活不能自理,完全需要家属照料,给家庭和社会带来了沉重的经济负担。帕金森病的主要病理改变为中脑黑质多巴胺能神经元变性坏死,胞体内嗜酸性包涵体形成,从而导致患者脑内多巴胺能神经递质含量减少,患者表现为以运动障碍为主症的神经系统疾病。近年研究显示,遗传因素、环境因素、年龄老化、氧化应激等均可能参与帕金森病患者脑内多巴胺能神经元的变性死亡过程[2]。研究发现PD患者脑内黑质中存在复合物Ⅰ活性和还原性谷胱甘肽的含量明显降低,从而导致脑内发生氧化应激反应产生过多的氧自由基,氧自由基进一步损伤脑内黑质多巴胺能神经元,形成恶性循环,导致疾病进一步加重[3]。鉴于以上的理论依据,抗氧化应激及清除氧自由基很可能成为治疗PD的新靶点。莱菔硫烷(Sulforaphane,SF)又名萝卜硫素,是在十字花科植物中广泛存在的异硫氰酸盐,其在西兰花中含量最高,具有抗氧化、抗肿瘤和免疫调节等多种生物学特性。莱菔硫烷能特异靶向激活Nrf2/Keap1信号通路,强力激活人体II相抗氧化和代谢解毒酶,作为化学预防药物已引起广大研究者的关注[4]。本研究观察莱菔硫烷对鱼藤酮背部皮下注射制备PD动物模型脑内多巴胺能神经元的保护作用,为治疗PD药物的选择提供一个新的方向。
1 材料与方法
1.1 实验动物 12周龄雄性Witstar 大鼠60只,体重(300±20)g,由河北医科大学实验动物中心提供(合格证号:SCXK冀2008-1-003)。将实验大鼠随机分为对照组(20只)、试验组(20只)和药物干预组(20只)。所有大鼠在同一实验室按照清洁级标准饲养,期间所有大鼠自由进食进水,房间保持稳定的温度(24℃)和湿度(40%)。
1.2 动物模型的制备及药物干预 对照组大鼠给予背部皮下注射葵花油1 ml/kg,试验组和药物干预组大鼠按照2.0 mg·kg-1·d-1背部皮下注射鱼藤酮(鱼藤酮溶解在葵花籽油中,充分震荡混匀后 4℃避光保存),其中药物干预组大鼠在鱼藤酮注射前半小时给予SF 5 mg·kg-1·d-1腹腔注射,共30 d。
1.3 实验动物的取材及组织匀浆制备 最后一次药物注射后24 h,每组各取8只大鼠断头处死,置于冰板上选取中脑和纹状体,迅速投入液氮中,-80℃保存备用。取每只大鼠的纹状体和中脑称重,剪碎,放入匀浆器,按1∶9(组织重量与裂解液体积比)比例加入冷RIPA裂解液,匀浆器放在冰浴中,以2 000 r/min转速上下匀浆20次,然后吸至10 ml离心管中。冰浴放置30分钟。4℃ 10 000 r/min,离心30 min。小心吸出上清,按实验需要分装放入EP管中,-80℃储存备用。
1.4 蛋白浓度的测定(BCA 法) 取各组大鼠的脑组织匀浆样本10 μl加入酶标板各孔中,并加入 200 μl BCA 工作液,震荡混匀1 min,恒温37℃孵育30 min,然后在酶标仪562 nm吸光值下比色测定,以蛋白含量为横坐标,吸光度值为纵坐标,绘制标准曲线。并根据所测样品的吸光值,在标准曲线上即可查到相应蛋白含量(μg),除以样品稀释液总体积(10 μl),乘以样品稀释倍数即为样品实际浓度(μg/μl)。
1.5 Western blot检测TH蛋白的含量 取各组实验大鼠脑组织匀浆样品50 μg总蛋白常规变性后自然冷却,经10% SDS-PAGE凝胶电泳分离,电泳转移至NC膜上,用5%脱脂奶粉室温封闭2 h后,加入抗体稀释液稀释的兔TH单克隆抗体(1∶5 000,Sigma公司), 4℃过夜。NC膜以TTBS洗3次,羊抗兔IgG 荧光抗体(1∶2 000,Rocland 公司)室温避光1h,TTBS漂洗5 次,远红外荧光扫描成像系统(Odyssey公司)扫描并测定目标蛋白光密度值,所得值与Actin (1∶5 000,Santa Cruz)蛋白的光密度值比值后,做统计学分析。
1.6 分光光度法检测脑内纹状体中丙二醛(MDA)和谷胱甘肽(GSH)的含量 取大鼠纹状体脑组织,在4℃RIPA裂解液匀浆, 低温离心10 000 g 30 min,取上清,BCA法测定蛋白浓度。具体检测MDA和GSH的实验方法按所购试剂盒说明书进行。
2 结果
2.1 一般状况 所有鱼藤酮注射大鼠第2~5天开始有捕捉时反抗动作减少的现象,并逐渐出现主动活动减少、行走时多向一侧旋转、动作迟缓、弓背状姿势等PD样特征;大鼠毛色逐渐发黄、变脏及竖毛现象。试验组大鼠在第9、11、13、22天是各死亡1只,药物干预组大鼠腹腔注射SF后上述症状有明显改善,在第15、16天时各死亡1只。此外,我们观察到大鼠急性死亡者出现体重减轻、眼、鼻及内脏出血的表现。大鼠解剖发现胃扩张、肝萎缩及肝脏散在的出血点。
2.2 Western blot实验结果 TH在大鼠脑内中脑和纹状体中的表达改变:Western blot结果显示试验组大鼠脑内中脑和纹状体中TH蛋白表达都比对照组有明显降低(P<0.05),标明我们在给予大鼠鱼藤酮背部皮下注射后对脑内多巴胺能神经元具有明显的损伤作用;莱菔硫烷药物干预后TH蛋白在中脑和纹状体比实验组明显增高(P<0.05),但是较对照组仍有明显减少(P<0.05),表明莱菔硫烷对大鼠脑内的多巴胺能神经元具有神经保护作用。见表1,图1。
2.3 大鼠纹状体中氧化应激参数(MDA和GSH)的改变 我们的实验数据显示:试验组大鼠在给予鱼藤酮背部皮下注射后导致大鼠脑内纹状体中脂质代谢产物MDA含量比对照组明显增加(P<0.01)。莱菔硫烷药物干预组大鼠脑内纹状体中MDA明显减少(P<0.05),但较对照组仍明显增加(P<0.05)。同时我们发现鱼藤酮背部皮下注射可以导致实验组大鼠脑内纹状体中GSH的含量比对照组明显减少(P<0.01);莱菔硫烷药物干预后大鼠脑内纹状体中GSH含量较实验组明显增加(P<0.05),但较对照组仍明显减少(P<0.05)。以上的实验表明莱菔硫烷能够有效改善鱼藤酮导致的氧化应激状态,从而起到脑保护作用。见表1。
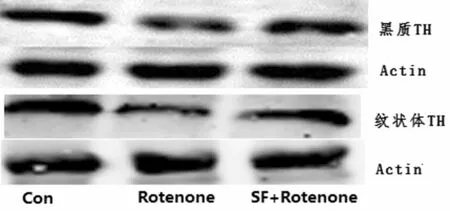
图1 TH蛋白在3组大鼠黑质和纹状体组织中的表达

组别黑质TH/β⁃actin纹状体TH/β⁃actin纹状体MDA(nmol/mgprot)纹状体GSH(mg/gprot)对照组0.84±0.370.72±0.216.43±1.6753.23±4.51试验组0.52±0.15∗0.43±0.32∗18.34±2.35∗29.42±2.62∗药物干预组0.64±0.11∗#0.58±0.13∗#11.44±3.31∗#36.39±3.91∗#
注:与对照组比较,*P<0.05;与试验组比较,#P<0.05
3 讨论
帕金森病是老年人常见的一种神经系统变性疾病,目前病因和发病机制还不清楚,患者表现为静止性震颤、运动减少和肌强直等运动障碍症状[5]。帕金森病发病后病情进展迅速,到疾病的晚期患者的生活不能自理,完全需要家人护理和照顾,给家庭和社会带来了沉重的经济负担。随着中国人口老龄化的到来,帕金森病的发病率也逐年增加,目前还没有特效药物能治疗该病,临床上的药物多为暂时缓解患者的症状,但是不能有效逆转中脑黑质多巴胺能神经元的损伤,随着患者病情加重,药物还会引起患者出现异动症和症状波动等不良反应,随着治疗时间的延长,患者对药物的疗效会越来越差[6,7]。所以,阐明帕金森病的病因和发病机制,筛选有效的治疗药物是摆在广大科研工作者面前的重大难题。
关于帕金森病的病因和发病机制在神经科学界近年开展了大量的科学研究,研究发现,帕金森病的主要病因为家族遗传因素和外界环境毒素的接触,其中环境因素在帕金森病发病过程中的作用越来越受到医学科研工作者的重视[8,9]。鱼藤酮为脂溶性,可透过血脑屏障进入中枢神经系统,其进入神经系统后可以神经元内的线粒体电子传递脱氢酶结合并使其失去活性,导致神经元对氧的利用障碍和能量产生不足,最终导致神经元的凋亡和坏死[10]。近年研究证实,鱼藤酮进入脑内能特异性的和黑质多巴胺能神经元结合并发挥神经毒性作用[11,12]。实验大鼠长期慢性接触鱼藤酮后可以出现类帕金森病样症状,表现为活动减少、行走时向一侧旋转等症状。我们通过给予大鼠背部皮下注射鱼藤酮后发现,该药物可以导致大鼠出现运动减少和行走时向一侧旋转等类帕金森样症状,表明鱼藤酮是制备帕金森病动物模型有效药物,这与以往的研究结果一致。目前用于制备帕金森病动物模型的两种毒性物质六羟多巴(6-OHDA)和MPTP 均需多巴胺转运体将其摄取,选择性地损伤脑内的多巴胺能神经元,从而制备动物模型。但实验动物多巴胺能神经元内始终没有嗜酸性包涵体的出现。然而,长期慢性给予实验动物鱼藤酮可以损伤其脑内的黑质多巴胺能神经元,同时可以形成嗜酸性包涵小体,该动物模型对左旋多巴药物治疗较为敏感[13]。上述研究表明,鱼藤酮干预形成的帕金森病动物模型与疾病的自然发生相近,为探讨帕金森病的发病机制和治疗药物的筛选提供了较为适宜的动物模型。
氧化应激是指机体抗氧化能力减弱,产生大量氧自由基和氮自由基,过量的自由基可以对DNA和脂质等产生不可逆性损伤,从而导致机体疾病发生。科学研究发现,氧化应激被认为是导致衰老和疾病的一个重要因素,其在体内过度蓄积可引起脑内黑质多巴胺能神经元损伤。因此抗氧化损伤,减少脑内氧自由基的蓄积应是延缓疾病进展的一条重要途径[14]。
GSH是一种肽类化合物,由谷氨酸、半胱氨酸和甘氨酸三种氨基酸共价键结合而成,它是对机体保护的主要肽类物质之一,能有效地和体内的过氧化物及某些重金属离子结合而降低其毒性,经过机体的代谢将其排出体外,维持体内的还原状态,是体内重要的抗氧化剂和自由基清除剂[15]。因此机体内GSH含量是衡量抗氧化能力的重要指标。本实验中,鱼藤酮背部皮下注射的大鼠脑内纹状体中GSH 含量显著低于对照组,我们的结果表明,帕金森病大鼠脑内出现了氧化应激状态,产生了大量的氧自由基,而自身的抗氧化能力下降,导致氧自由基堆积,造成神经元的损伤。MDA是机体内脂质发生过氧化反应的终产物,具有较强的细胞毒性,能引起机体蛋白质、DNA等交联聚合,对机体产生不可逆性损伤。由于MDA 为氧化代谢产物,其再体内的含量可以直接反映体内脂质过氧化程度和引起脂质过氧化的自由基的水平[16]。本实验中,帕金森病动物模型脑内MDA 含量明显升高,提示在帕金森病大鼠脑内氧代谢产物过量产生,发生了氧化应激反应。MDA为体内脂质过氧化产生的代谢产物,可导致神经元变性坏死,进而对脑组织产生损伤。帕金森病患者脑内发生了氧化应激反应,可以损伤脑内的多巴胺能神经元[17],这一我们的研究结果一致。
莱菔硫烷是一种异硫氰酸盐,广泛分布于自然界的十字花科蔬菜中。近年莱菔硫烷作为一种有抗肿瘤活性的药理作用逐渐引起科研工作者的重视,研究发现莱菔硫烷能抑制机体内部的致癌物质活化,抑制肿瘤细胞增殖,诱导肿瘤细胞发生凋亡坏死[18]。随着科学及技术的发展和对莱菔硫烷药物作用的深入研究,人们发现其对神经系统的损伤具有较好的保护作用[19],如缺血缺氧性脑病、癫痫、老年痴呆、肌萎缩侧索硬化等再给与莱菔硫烷治疗后具有改善脑内氧化应激状态、清除氧自由基和炎性因子的作用,从而延缓疾病进展和改善病理状态[20]。我们前期的研究证实,帕金森病动物模型脑内发生的病理损伤和氧化应激密切相关,但目前未见抗氧化剂莱菔硫烷的神经保护作用。我们的研究结果显示,鱼藤酮可以导致大鼠出现活动减少、弓背屈曲和行走时向一侧旋转等类帕金森病症状,同时研究发现大鼠脑内多巴胺神经递质行程中的关键酶TH含量明显减少和氧化应激损伤。给予大鼠莱菔硫烷能有效改善大鼠脑内氧化应激,保护多巴胺能神经元,从而改善大鼠帕金森病样症状。我们的实验表明,莱菔硫烷能有效改善帕金森大鼠脑内的氧化应激状态,减少氧自由基的蓄积,同时可以提高脑内的抗氧化能力,从而起到神经保护作用。
我们的研究证实,莱菔硫烷能能有效降低帕金森病动物模型脑内的氧自由基含量,提高机体抗氧化因子的产生,从而对脑内多巴胺能神经元起到神经保护作用,该研究为阐明帕金森病的病理生理改变提供了实验依据,同时也为帕金森病的药物治疗提供了新的选择。
1 Sveinbjornsdottir S.The clinical symptoms of Parkinson’s disease.J Neurochem,2016,11:572-578.
2 Hirsch EC.Future drug targets for Parkinson’s disease.Bull Acad Natl Med,2012,196:1369-1377.
3 Smid SD,Maag JL,Musgrave IF.Dietary polyphenol-derived protection against neurotoxic β-amyloid protein:from molecular to clinical.Food Funct,2012,3:1242-1250.
4 Surmeier DJ,Sulzer D.The pathology roadmap in Parkinson disease.Prion,2013,7:85-91.
5 Tolleson CM,Fang JY.Advances in the mechanisms of Parkinson's disease.Discov Med,2013,15:61-66.
6 Bisaglia M,Greggio E,Beltramini M,et al.Dysfunction of dopamine homeostasis:clues in the hunt for novel Parkinson’s disease therapies.FASEB J,2013,27:2101-2110.
7 Cannon JR,Tapias V,Na HM,et al.A highly reproducible rotenone model of Parkinson's disease.Neurobiol Dis,2009,34:279-290.
8 Shorter J.Designer protein disaggregases to counter neurodegenerative disease.Curr Opin Genet Dev,2017,44:1-8.
9 Titova N,Padmakumar C,Lewis SJ,Chaudhuri KR.Parkinson’s:a syndrome rather than a disease? Neural Transm (Vienna),2016,27:361-366.
10 Jiang T,Sun Q,Chen S.Oxidative stress:A major pathogenesis and potential therapeutic target of antioxidative agents in Parkinson’s disease and Alzheimer’s disease.Prog Neurobiol,2016,147:1-19.
11 Nandipati S,Litvan I.Environmental Exposures and Parkinson’s Disease.Int J Environ Res Public Health,2016,13:129-133.
12 Johnson ME,Bobrovskaya L.An update on the rotenone models of Parkinson’s disease:their ability to reproduce the features of clinical disease and model gene-environment interactions.Neurotoxicology,2015,46:101-116.
13 Xiong N,Long X,Xiong J,et al.Mitochondrial complex I inhibitor rotenone-induced toxicity and its potential mechanisms in Parkinson's disease models.Crit Rev Toxicol,2012,42:613-632.
14 Sita G,Hrelia P,Tarozzi A,et al.Isothiocyanates Are Promising Compounds against Oxidative Stress,Neuroinflammation and Cell Death that May Benefit Neurodegeneration in Parkinson’s Disease.Int J Mol Sci,2016,17:491-497.
15 Segura-Aguilar J,Paris I,Muňoz P,et al.Protective and toxic roles of dopamine in Parkinson's disease.J Neurochem,2014,129:898-915.
16 Rekaik H,Blaudin de Thé FX,Prochiantz A,et al.Dissecting the role of Engrailed in adult dopaminergic neurons--Insights into Parkinson disease pathogenesis.FEBS Lett,2015,589:3786-3794.
17 Hall J,Prabhakar S,Balaj L,et al.Delivery of Therapeutic Proteins via Extracellular Vesicles:Review and Potential Treatments for Parkinson’s Disease,Glioma,and Schwannoma.Cell Mol Neurobiol,2016,36:417-427.
18 Sestili P,Fimognari C.Cytotoxic and Antitumor Activity of Sulforaphane:The Role of Reactive Oxygen Species.Biomed Res Int,2015,19:402386.
19 de Figueiredo SM,Filho SA,Nogueira-Machado JA,et al.The anti-oxidant properties of isothiocyanates:a review.Recent Pat Endocr Metab Immune Drug Discov,2013,7:213-225.
20 Tarozzi A,Angeloni C,Malaguti M,et al.Sulforaphane as a potential protective phytochemical against neurodegenerative diseases.Oxid Med Cell Longev,2013,21:415078.
The protective effects of sulforaphane on dopaminergic neurons in brain substantia nigra of rats with Parkinson’s disease and its action mechanism
XIANFeng,GUOBin,QINShouze,etal.
DepartmentofAnesthesia,TheThirdHospitalofShijiazhuangCity,Shijiazhuang056001,China
Objective To investigate the protective effects of sulforaphane (SF) on dopaminergic neurons in brain substantia nigra of rats with Parkinson’s disease (PD) induced by rotenone, and to explore its action mechanism.Methods The animal models with PD were established by back subcutaneous injection with rotenone in healthy adult male Wistar rats,at the same time, the rats in drug intervention group were given EGCG by intraperitoneal injection.Then the levels of malondialdehyde (MDA) and reduced glutathione (GSH) were detected by spectrophotometry,and the changes of levels of tyrosine hydroxylase (TH) in brain substantia nigra and striatum of rats were detected by immunocytochemistry and Westen Blot.Results The results by Western Blot showed that the expression levels of TH in midbrain and striatum of rats in experimental group were significantly decreased,as compared with those in control group (P<0.05),and which in drug intervention group were significantly higher than those in trial group (P<0.05),however, which were significantly lower than those in control group (P<0.05).The levels of MDA in trial group were obviously increased,as compared with those in control group (P<0.0),however,which in drug intervention group were significantly decreased,but which were still higher than those in control group (P<0.05),as compared with those in control group (P<0.05).Moreover the levels of GSH in brain striatum of rats in trial group were significantly lower than those in control group (P<0.01),which in drug intervention group were significantly increased,as compared with those in experimental group, but which were still lower than those in control group (P<0.05).Conclusion The oxidative stress plays an important role in the pathogenesis of PD,and anti-oxidation treatment can effectively relieve the injury of dopaminergic neurons in brain of rat,improve the symptoms of PD simultaneously,which provides an new target for treatment of PD.
Parkinson’s disease; dopamine; sulforaphane; tyrosine hydroxylase;glutathione; malondialdehyde
10.3969/j.issn.1002-7386.2017.16.009
050011 河北省石家庄市第三医院麻醉科(先锋、郭斌、秦寿泽);河北省邯郸市第一医院内分泌科(吴艳芬)
R 741
A
1002-7386(2017)16-2440-04
2017-05-09)

