MTA1基因沉默对宫颈癌细胞增殖及转移能力的影响
顾青 赵艳 陈华
(上海市宝山区中西医结合医院妇产科 上海201999)
论著
MTA1基因沉默对宫颈癌细胞增殖及转移能力的影响
顾青 赵艳 陈华
(上海市宝山区中西医结合医院妇产科 上海201999)
目的:探讨MTA1基因沉默对宫颈癌细胞转移增殖的影响。方法:用慢病毒转染法稳定转染Siha细胞,转染同时进行实验分组。用RT-PCR技术和蛋白印迹法测定宫颈癌Siha、Hela细胞中MTA1 mRNA和蛋白的表达。Transwell体外侵袭实验检测转染后Siha细胞的迁移能力,MTT检测法和克隆形成实验法检测转染后Siha细胞的细胞增殖能力,FACS细胞凋亡法检测转染后Siha细胞的细胞凋亡率,PI-FACS细胞周期法检测转染后Siha细胞的各个生长周期的细胞数。结果:(1)Transwell体外侵袭实验:相比NC组,KD组Transwell转移率经T-Test分析P=2.61E-08<0.05。(2)MTT检测结果表明:相比NC组,KD组细胞增殖减缓。(3)克隆形成实验结果显示:相比NC组,KD组克隆数经T-Test分析P值=0.000 6<0.05。(4)FACS细胞凋亡:相比两个对照组,KD组凋亡率经T-Test分析P<0.05。结论:MTA1基因促进宫颈癌细胞的转移和增殖,沉默MTA1基因表达能使宫颈癌细胞增殖及迁移能力下降,加速宫颈癌细胞的凋亡,为抑制肿瘤转移奠定实验基础,最后为宫颈癌的新型药物性靶向治疗提供有力的实验依据。
宫颈癌;肿瘤转移;MTA1基因
转移是恶性肿瘤的主要特征之一,其间涉及多种机制,包括癌细胞离开原有部位,通过血管和淋巴管浸润,在内皮细胞和基质中滞留,诱导新的血管形成,逃避机体的肿瘤免疫监视而形成新的转移灶。宫颈癌是威胁全球妇女生命的第二常见肿瘤,转移仍然是致死的主要原因。近年来,随着肿瘤机制的深入研究,肿瘤形成和转移的信号通路中的关键调控因子被一一发现,肿瘤的靶向治疗发展迅速,可能为宫颈治疗带来突破。大量研究表明,某些蛋白在肿瘤的转移过程中起着重要的作用,其中转移相关基因1(Metastasis Associated Gene 1,MTA1)是近年来发现的与肿瘤发生、发展及转移有密切关系的蛋白之一。本实验通过慢病毒感染技术沉默宫颈癌细胞中MTA1的表达,检测宫颈癌细胞生物学行为的改变,为深入研究MTA1基因在宫颈癌浸润转移中的作用奠定基础。现介绍如下:
1 材料与方法
1.1 材料来源 人宫颈癌细胞系Siha(HPV16阳性的宫颈癌细胞)、Hela(HPV18阳性的宫颈癌细胞)由上海吉凯基因公司提供保存,Siha、Hela细胞采用含10%胎牛血清的DMEM培养基培养。
1.2 方法
1.2.1 高表达MTA1 mRNA和蛋白的宫颈癌细胞系的筛选 (1)逆转录(RT)-PCR技术检测Siha、Hela细胞中MTA1 mRNA的表达:分别提取Siha、Hela细胞总RNA,逆转录成cDNA,PCR方法扩增MTA1。MTA1基因的上游引物序列:AAGAAGGCGAGGAGGATGG,下游引物序列:ATCTGCTTGTCTGTGAGTGG,扩增片段长85 bp。循环参数:94 ℃预变性5 min,94 ℃,40 s,60 ℃,40 s,72 ℃,40 s,27个循环,72 ℃延伸7 min。以β-actin为内参基因,扩增片段长210 bp,1.5%琼脂糖凝胶电泳。(2)Western Blot的方法检测Siha、Hela细胞中目的基因的蛋白表达量。分别提取Siha、Hela细胞总蛋白,以β-actin为内参照,进行SDS聚丙烯酰胺凝胶电泳,转膜后与1:1 000稀释的MTA1单克隆抗体(美国CST公司),4 ℃孵育过夜后,加入rabbit IgG二抗(美国Santa Cruz公司)孵育1.5 h,曝光显影。选择相对高表达MTA1 mRNA和蛋白的宫颈癌细胞系进行后续的基因沉默实验。
1.2.2 Siha细胞的转染及分组 将Siha细胞胰酶消化,完全培养基制成(3~5)×104个/ml细胞悬液,按照预实验结果,更换感染培养基,加入最适病毒量进行感染。选择感染后8~12 h更换为常规培养基继续培养,细胞感染效率达到80%以上。于感染48~72 h后,换用含抗生素(5 μg/ml puromycin)的培养基筛选细胞。转染同时进行实验分组:(1)Mock组:正常Siha细胞、未加病毒感染的细胞组;(2)NC组:正常Siha细胞、加阴性对照病毒CON077感染的细胞组;(3)KD组:正常Siha细胞、加MTA1基因shRNA病毒感染的细胞组。
1.2.3 转染后Siha细胞的迁移能力检测 Transwell体外侵袭实验法:将Transwell小室置于24孔板中,每个孔上室加入100 μl细胞悬液,下室内加入600 μl 30% FBS培养基,每组设3个重复孔,常规培养12 h。取出Transwell小室,95%乙醇固定,用棉拭子轻轻移去小室内非转移细胞,Giemsa染色液进行细胞染色。显微镜下观察并照相。以200 X的照片来计数,进行数据分析。
1.2.4 转染后Siha细胞的细胞增殖能力检测 (1)MTT检测法:将各实验组细胞分别接种于96孔板中,进行细胞培养。分别在种植细胞后1、2、3、4、5 d收集细胞,置酶标仪检测OD490值(反映了具有活力的细胞数量)。每组设5个平行孔,实验重复3次。(2)克隆形成实验法:将各实验组细胞胰酶消化,于6孔板培养板中进行细胞接种,继续培养到14 d,中途每隔3 d进行换液并观察细胞状态。实验终止前荧光显微镜下对细胞克隆进行拍照,PBS洗涤细胞1次。每孔加入1 ml 4%多聚甲醛,固定细胞30~60 min,PBS洗涤细胞1次。GIEMSA细胞染色,显微镜下进行克隆计数(镜下每50个细胞算1个克隆)并照相。
1.2.5 转染后Siha细胞的细胞凋亡率检测 Siha细胞经相应处理后,胰酶消化,收集细胞,预冷的D-Hanks洗涤细胞。200 μl结合缓冲液重悬细胞,加入10 μl Annexin V-APC染色,室温避光10~15 min。根据细胞量,补加400~800 μl结合缓冲液,上机检测。
1.2.6 转染后Siha细胞的生长周期检测 Siha细胞经相应处理后,进行胰酶消化,收集细胞,预冷的D-Hanks洗涤细胞沉淀1次。1 300 rmp、5 min离心,4 ℃预冷的75%乙醇固定细胞至少1 h,进行细胞染色,上流式细胞仪进行检测。
1.3 统计学处理 数据处理采用SPSS13.0统计学软件,计数资料间的比较用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 高表达MTA1 mRNA和蛋白的宫颈癌细胞系的筛选结果 RT-PCR技术和蛋白印迹法检测显示,Siha细胞中MTA1 mRNA及蛋白的表达强度明显高于Hela细胞。因此,本研究选择相对高表达MTA1 mRNA和MTA1蛋白的Siha细胞进行后续的基因沉默实验。见图1,图2。

图1 RT-PCR测定两种细胞中MTA1 mRNA的表达

图2 WB测定两种细胞中MTA1 mRNA的表达
2.2 转染后Siha细胞生物学行为的改变
2.2.1 转染后Siha细胞的迁移能力检测 每孔的迁移细胞数(Migratory Cells Per Field)Mock组(209±3.82),NC组(222±1.87),KD组(78±0.78)。Migration Fold Change(细 胞 迁 移 的 变 化 率)Mock组(0.94±0.02),NC组(1.00±0.01),KD组(0.35±0.01)。Mock组 与NC组 对 比,P值=0.06。Mock与KD对比,P值=5.262E-07。KD与NC组对比,P值=2.61E-08。相比NC组,KD组Transwell转移率经T-Test分析P<0.05。见图3~5。

图3 各实验组在transwell小室内孵育24 h后的转移细胞数对比

图4 各实验组在transwell小室内孵育24 h后的转移细胞数与NC的变化值对比

图5 Mock x 200 NC x 200 KD x 200
2.2.2 转染后Siha细胞的细胞增殖能力检测 (1)MTT检测法:第5天的Mock组的OD490为(0.647± 0.003 9),NC组(0.637±0.003 6),KD组(0.363±0.005 7)。Mock组与NC组对比,P值= 0.022 9。Mock组与KD组对比,P值=3.77E-07。KD组与NC组对比,P值=2.5E-07。MTT检测结果表明:相比NC组,KD组细胞增殖减缓。见图6,图7。

图6 各实验组在酶标仪对波长490 nm的光的吸收率随时间变化的对比

图7 各实验组在酶标仪对波长490 nm的光的吸收率变化倍数的对比
(2)克隆形成实验法:Mock组的克隆数(30±5),NC组(26±1),KD组(9±2)。Mock组与NC组对比,P值=0.309。Mock组与KD组对比,P值=0.002 5。KD组与NC组对比,P值=0.000 6。克隆形成实验结果显示:相比NC组,KD组克隆数经T-Test分析P<0.05。见图8,图9。
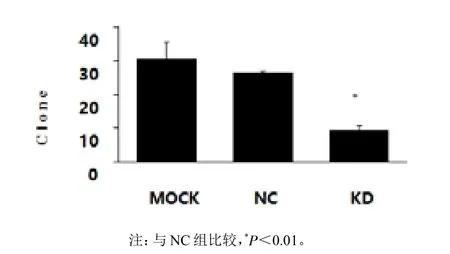
图8 各实验组形成克隆数量的对比

图9 Mock x 100 NC x 100 KD x 100
(3)转染后Siha细胞的FACS细胞凋亡检测:Mock组的凋亡率(1.65±0.064 3)%,NC组(4.66±0.058 7)%,KD组(8.63±0.271 9)%。Mock组与KD组对比,P值=1.7E-06。KD组与NC组对比,P值= 1.6E-05。相比两个对照组,KD组凋亡率经T-Test分析P<0.05。见图10。

图10 MOCK、NC、KD组凋亡率对比
(4)转染后Siha细胞的PI-FACS细胞周期检测:Mock组在G1期(DNA合成前期)的细胞百分比为(55.15±1.0376)%,S期(DNA合 成 期)(18.8± 1.8143)%,G2/M期(DNA复 制 结 束)(26.06± 1.1647)%,NC组在G1期的细胞百分比为(57.34± 0.4159)%,S期(20.45±1.055)%,G2/M期(22.22± 0.5645)%。KD组与NC组对比,G1期的P值= 0.716,S期P值=0.908,G2/M期P值=0.0656,相比NC组,KD组处于S期、G1期和G2/M期的细胞数T-test分析P>0.05。见图11。

图11 各实验组处在G1、S以及G2/M期的细胞占细胞总数的比例对比
3 讨论
MTA1基因是MTA家族成员之一,参与细胞核小体重组和组氨酸去乙酰化复合物NuRD的形成,与组蛋白的去乙酰化呈正相关,是转录过程中的一个辅助抑制因子。MTA1最初是Pencil等[1]于1990年首次应用差异cDNA杂交技术从13762 NF大鼠乳腺癌转移系统筛选克隆出,继后在人类高转移乳腺癌细胞株中发现其对应的人类同源物MTA1。因该基因的表达与乳腺肿瘤转移能力成正相关,故被命名为转移相关基因1[2]。人的MTA1基因位于染色体14q32.3,编码1个含715个氨基酸残基的蛋白,分子量为82 kD。MTA1蛋白具有明显的亲水性,不具有跨膜或膜相关的区域,表明它并非细胞表面蛋白或分泌蛋白。因此,MTA1可通过此种功能直接或者间接作用于某些抑制肿瘤浸润转移的基因,下调其转录。有研究表明,MTA1在人类喉癌[3]、口腔鳞癌[4]、食管鳞癌[5]、鼻咽癌[6]及骨肉瘤[7]、子宫内膜癌[8]、膀胱癌[9]等多种恶性肿瘤组织中均有不同程度的高表达,并与肿瘤的浸润和淋巴转移相关。Rao等[10]发现Siha细胞株所表达的MTA1蛋白明显高于HeLa细胞株,且与这两株细胞的迁移及侵袭能力呈正比,用MTA1-siRNA转染Siha细胞株减少MTA1蛋白表达后,癌细胞的迁移、侵袭、黏附能力也明显下降,而细胞的凋亡、增殖及细胞周期未受到影响。他们发现,MTA1-siRNA转染的肿瘤细胞中的P53蛋白表达明显增多,β-catenin蛋白表达明显减少。β-catenin在细胞内有E-cadherin/β-catenin复合物与游离β-catenin两种存在形式,其黏附功能主要是与E-cadherin的C末端直接作用,将其连接到细胞骨架的肌动蛋白上,形成细胞间稳定连接。
在本研究中选用了RT-PCR技术和蛋白印迹法测定了宫颈癌Siha、Hela细胞中MTA1 mRNA和蛋白的表达,选择了相对高表达MTA1 mRNA和蛋白的Siha细胞进行后续的基因沉默实验。用慢病毒转染法稳定转染Siha细胞,转染同时进行了实验分组:(1)Mock组:正常Siha细胞、未加病毒感染的细胞组;(2)NC组:正常Siha细胞、加阴性对照病毒CON0 77感染的细胞组;(3)KD组:正常Siha细胞、加MTA1基因shRNA病毒感染的细胞组。经研究发现:在Transwell体外侵袭实验中:KD组相比NC组,Transwell转移率经T-Test分析P= 2.61E-08<0.05,结果表明沉默MTA1基因表达能使宫颈癌细胞迁移能力下降。在MTT检测及克隆形成实验中显示,MTA1基因促进宫颈癌细胞的增殖,沉默MTA1基因表达能使宫颈癌细胞增殖能力下降。对转染后Siha细胞的PI-FACS细胞周期检测发现:KD组处于S期、G1期和G2/M期的细胞数与NC组相比,P>0.05,无明显差异性。在本研究中,对转染后Siha细胞的FACS细胞凋亡进行检测,Mock组的凋亡率(1.65±0.064 3)%,NC组(4.66±0.058 7)%,KD组(8.63±0.271 9)%,相比两个对照组,KD组凋亡率经T-Test分析P<0.05,从而证明了沉默MTA1基因表达能加速宫颈癌细胞的凋亡,这与韩肖燕等[11]在以往这方面的研究发现有所不同。
总之,本研究结果表明,MTA1基因可以促进宫颈癌细胞的转移和增殖,沉默MTA1基因表达能使宫颈癌细胞增殖及迁移能力下降,加速宫颈癌细胞的凋亡,为抑制肿瘤转移奠定实验基础,最后为宫颈癌的新型药物性靶向治疗提供有力的实验依据。相信在不久的将来,我们将一步步揭开MTA1的完整作用机制,MTA1基因也有望成为肿瘤诊断与治疗的重要参考指标。
[1] Pencil SD,Toh Y,Nicolson GL.Candidate metastasis-associated genes of the rat 13762 NF mammary adenocarcinoma[J].Breast Cancer Research and Treament,1993,25(2):165-174
[2] Toh Y,Pencil SD,Nicolson GL.Analysis of the complete sequence of the novel metastasis-associated candidate gene,mtal,differentiallyexpressed in mammary adenocarcinoma and breast cancer cell lines[J].Gene,1995,159(1):97-104
[3] 黄春蓓,胡国华,董蒲江,等.喉癌中MTA1分布特点及其与MMP-9、VEGF-C蛋白表达的相关性分析[J].重庆医学,2014,43(26):3418-3421
[4] 王永霞,裴华,刘珊,等.MTA1基因表达在口腔鳞癌发生、发展中作用的研究[J].重庆医学,2012,41(28):2905-2906
[5] 郑文凤,李颖霞,陈奎生,等.USP22、MTA1及Ki-67蛋白在食管鳞癌中的表达及相关性[J].世界华人消化杂志,2013,21(28):2915-2921
[6] 周敬淳,刘明,张伟,等.Ezrin与MTA1在鼻咽癌组织中的表达研究[J].白求恩医学杂志,2015,13(3):296-297
[7] 朱江,陈福来,迟月明,等.CD44v6和MTA1在骨肉瘤组织中的表达及意义[J].哈尔滨医科大学学报,2014,48(3):186-190
[8] 张山岭,郝权,孙和熙,等.MTA1表达与子宫内膜癌相关性研究[J].中国肿瘤临床,2012,39(4):208-211
[9] 侯二文,王禾,马建军,等.MTA1在膀胱癌的表达及其与预后的相关性[J].现代泌尿外科杂志,2014,19(4):263-266
[10] Rao Y,Wang H,Fan L,et al.Silencing MTA1 by RNAi reverses adhesion,migration and invasiveness of cervical cancer cells(SiHa) via altered expression of p53,and E-cadherin/β-catenin complex[J].J Huazhong Univ Sci Technolog Med Sci,2011,31(1):1-9
[11] 韩肖燕,杨隽钧,向阳,等.基因沉默MTA1对宫颈癌细胞生物学效应的影响[J].现代妇产科进展,2011,20(8):593-596
Effects of MTA1 Gene Silencing on the Metastatic and Proliferation of Cervical Cancer Cell
GU Qing, ZHAO Yan, CHEN Hua
(Department of Obstetrics and Gynecology, Shanghai Baoshan Hospital of Integrated Traditional Chinese and Western Medicine, Shanghai201999)
Objective: To investigate the effects of MTA1 gene silencing on the metastatic and proliferation ability of cervical cancer cell. Methods: The experiment was divided into three groups when the Siha cells were infected by lentivirus. Reverse transcription (RT)-PCR and western blot were used to detect MTA1 mRNA and protein expressions in Siha cell and Hela cell of cervical cancer. Transwell assay detected the migration ability of transfected Siha cells. The proliferation ability of transfected Siha cells were determined by methyl thiazolyl tetrazolium (MTT) and clone formation experiment. FACS cell apoptosis method detected apoptosis rate of transfected Siha cell. Flow cytometry detected transfected Siha cells at different growth periods. Results: (1) Transwell assay: Compared with NC group, the transfer rate in the KD group were analyzed by T Test (P=2.61<0.05). (2)MTT test: Compared with NC group, the proliferation index of cells was signifcantly decreased in KD group. (3)Clone formation experiment: Compared with NC group, the numbers of cloning were signifcantly less than KD group (P=0.0006<0.05). (4)FACS: Compared with NC group and Mock group,the apoptosis rate was signifcantly lower than KD group (P<0.05). Conclusions: MTA1 gene may premote the metastasis and proliferation ability of cervical cancer cell.MTA1 gene silencing may decrease the proliferation and migration of cervical cancer cell, while accelerating the apoptosis of cervical cancer cell. It provides experiental basis for the inhibition of neoplasm metastasis, and powerful new experimental basis for cervical cancer drug targeted therapy fnally.
Cervical cancer; MTA1 gene; Neoplasm metastasis
R737.33
B
10.13638/j.issn.1671-4040.2017.06.001
2017-05-04)

