吡咯生物碱相关肝窦阻塞综合征诊断和治疗专家共识意见(2017年,南京)
中华医学会消化病学分会肝胆疾病协作组
吡咯生物碱相关肝窦阻塞综合征诊断和治疗专家共识意见(2017年,南京)
中华医学会消化病学分会肝胆疾病协作组
肝静脉闭塞性疾病; 诊断; 治疗; 共识
肝窦阻塞综合征(hepatic sinusoidal obstruction syndrome,HSOS),又称肝小静脉闭塞病(hepatic veno-occlusive disease,HVOD),是由各种原因导致的肝血窦、肝小静脉和小叶间静脉内皮细胞水肿、坏死、脱落进而形成微血栓,引起肝内淤血、肝损伤和门静脉高压的一种肝脏血管性疾病[1-4]。2002年,DeLeve等[5]基于实验和病理研究发现,建议以HSOS代替HVOD。在近年发表的文献中上述两种名称均有使用。因此,在本共识中我们认同HSOS和HVOD可以相互替换[6]。
HSOS/HVOD(以下简称HSOS)临床表现为腹胀、肝区疼痛、腹水、黄疸、肝脏肿大等,常被误诊为巴德-吉亚利综合征(Budd-Chiari syndrome,BCS)、失代偿期肝硬化或急性重型肝炎等疾病,影响对其及时诊断和治疗。HSOS病因较多,但国内外明显不同。欧美报道的HSOS大多发生在骨髓造血干细胞移植(hematopoietic stem cell transplantation,HSCT)预处理后,国内报道以服用含吡咯生物碱(pyrrolidine alkaloid,PA)的植物居多,其中以土三七(或称菊三七)最多[7-9]。
目前,国外有关HSOS的诊治共识指南有2013年英国血液及骨髓移植学会HSCT后HVOD(HSOS)诊断和处理指南[10],以及2015年欧洲骨髓移植协作组HSOS/HVOD现状和展望立场声明[11]。此外,在2009年美国肝病学会和胃肠病学会肝脏血管疾病指南[12]、2011年意大利肝病学会肝脏血管疾病推荐意见[13]和2016年欧洲肝病学会肝脏血管性疾病指南[14]中,均有提及HSOS诊治的内容。但国内尚无相关共识。
近些年来,国内报道的因服用含PA植物罹患HSOS病例数量呈现上升趋势,其中相当一部分患者没有得到及时诊断和恰当的治疗,导致预后不佳。为此,中华医学会消化病学分会肝胆疾病协作组于2016年7月讨论决定,基于现有国内外研究,制定我国PA相关肝窦阻塞综合征(pyrrolidine alkaloid-related hepatic sinusoidal obstruction syndrome,PA-HSOS)的诊断和治疗专家共识;经1年起草,期间1次在武汉、2次在南京组织专家对共识草案反复讨论修改,最终定稿。
本共识采用推荐分级的评估、制订和评价(GRADE)系统对循证医学证据的质量(表1)和推荐意见的级别(表2)进行评估。在形成推荐意见时,不仅考虑到证据的质量,还要权衡干预的利弊与负担、患者意愿和价值观的多样性,以及资源的合理利用、推荐措施的公平性与可实施性等。
1 历史、病因和流行病学
HSOS首先于1953年由牙买加医生Hill等[15]报道,作者分析患者病理改变后认为该病是由于肝内毛细血管阻塞所致,随着疾病的进展最终发展成淤血性肝纤维化,推测病因可能是营养不良或摄入蛋白质少,故称为浆液性肝病。1年后,同为牙买加的医师Bras等[16]报道了5例儿童因食用狗舌草而导致肝大、腹水、黄疸等急性门静脉高压表现的临床病例,并发现了与Hill等研究相同的病理改变,遂采用“HVOD”对该病进行命名,此后HVOD被世界各地的医师广为接受。1999年DeLeve等[17]用野百合碱给大鼠灌胃后发现,该病肝损伤的最早期表现是肝窦内皮细胞损伤、脱落(红细胞进入狄氏间隙),后续才出现一系列的继发性损伤。鉴于这些发现,DeLeve等于2002年提出以“HSOS”替代HVOD作为该病的诊断名称[5]。

表1 GRADE系统的证据质量及其定义

表2 GRADE系统的推荐强度等级
我国中草药一直被广泛使用。一些含PA的植物,如菊科的土三七、千里光,豆科的猪屎豆,紫草科的天芥菜等,因同样具有止血、止痛等功效,容易与主要产自云南的五加科三七(亦称参三七)相混淆,服用后可能导致严重的HSOS。其中以土三七最常见,五加科三七不含PA,不会引起HSOS。
通过检索300余篇以英文发表的HSOS相关文献,发现西方国家的HSOS患者绝大多数发生在HSCT后,与大剂量化学治疗药物预处理等因素有关;其次也有实体瘤化学治疗、肝移植术后应用免疫抑制剂相关的HSOS报道。我国鲜有骨髓造血干细胞移植相关肝窦阻塞综合征(hematopoietic stem cell transplantation-hepatic sinusoidal obstruction syndrome,HSCT-HSOS)的报道。国内以PA-HSOS为主,其中因服用土三七导致的HSOS占50.0%~88.6%[7-8,18-22]。推荐意见(1):我国HSOS以PA-HSOS为主,PA-HSOS病因以服用土三七最常见(A1)。
2 病理和发病机制
PA-HSOS动物模型的病理改变研究较为详细,而人体病理资料较少。大鼠模型的病理改变包括[17,23]:最先出现肝血窦内皮细胞超微结构受损;而后肝血窦堵塞的表现逐渐明显,内皮细胞损伤,窦壁破坏;其中,肝腺泡Ⅲ区血窦淤血,肝板结构破坏,肝细胞坏死和小叶间静脉内皮细胞损伤,管壁肿胀最为显著(图1)。造模第6天,一些大鼠肝脏病变恢复接近正常,另一些大鼠肝细胞受损改善,但血窦内、窦周和小叶间静脉内仍有大量胶原蛋白沉积。人PA-HSOS的病理改变与大鼠模型表现高度相似:典型表现为以肝腺泡Ⅲ区为主的肝窦内皮细胞肿胀、损伤、脱落,肝窦显著扩张充血;肝细胞不同程度的肿胀、坏死,红细胞渗入狄氏间隙,肝内小静脉管壁增厚,管腔狭窄、闭塞,无纤维化表现或可见汇管区轻度纤维增生[8,24-27](图2)。

图1吡咯生物碱诱导大鼠HSOS(造模第3天)的病理特征(苏木精-伊红染色,高倍放大,南京大学医学院附属鼓楼医院消化内科惠赠) 靠近中央静脉的肝腺泡Ⅲ区血窦淤血,肝板结构破坏,肝细胞凝固性坏死和中央静脉内皮细胞损伤,管壁肿胀
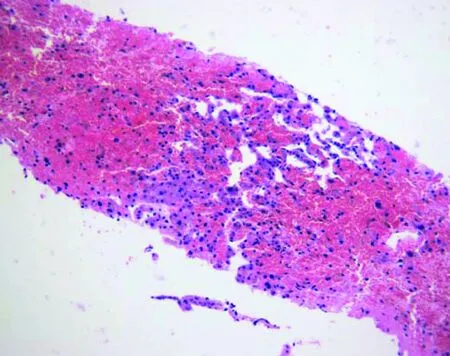
图2土三七导致人HSOS(发病后7 d)的病理特征(苏木精-伊红染色,中倍放大,南京大学医学院附属鼓楼医院病理科惠赠) 以肝腺泡Ⅲ区为主的肝窦显著扩张、充血,肝细胞不同程度的肿胀、坏死,红细胞渗入狄氏间隙,肝内小静脉管壁增厚,管腔狭窄、闭塞
目前对于PA-HSOS的发病机制尚不完全清楚。PA属于双环氨基醇衍生物,可分为饱和型和不饱和型,其中饱和型无明显毒性或具有低毒性,不饱和型则具有极强的肝毒性。此外,部分种类PA还可导致肺损害引起肺动脉高压[28-30]。不饱和型PA进入肝脏后,在细胞色素P450酶(CYP)3A的催化下,生成有反应活性的中间代谢物脱氢吡咯,再被水解为脱氢倒千里光裂碱(6,7-dihydro-7-hydroxy-1-hydroxymethyl-5H pyrrolizidine,DHR),易与蛋白结合形成吡咯蛋白加合物(pyrrole protein adducts,PPAs),从而损伤肝窦内皮细胞[31]。CYP3A的基因多态性、诱导剂和抑制剂均会影响PA的细胞毒性[30]。
肝窦内皮细胞谷胱甘肽耗竭在PA-HSOS发病中起重要作用[32]。野百合碱、脱氢吡咯和DHR对体外培养的肝窦内皮细胞均具有毒性作用,机制是下调谷胱甘肽和形成PPAs[33-34]。动物模型中肝窦内皮细胞谷胱甘肽的降低与内皮细胞死亡相关,经门静脉补充谷胱甘肽具有预防作用[35]。PA-HSOS以肝腺泡Ⅲ区病变为主,可能与该区富含CYP3A和谷胱甘肽S转移酶,而谷胱甘肽水平较低相关。另外,基质金属蛋白酶(MMP)-9和MMP-2表达上调[36-37],一氧化氮减少[38],以及凝血相关信号通路激活[32]等也参与PA-HSOS的发生。Li等[39]采用蛋白质组学的方法发现,在早期PA-HSOS大鼠体内有48种蛋白水平改变,其中CPS1和ATP5β与发病有密切关系,具体机制有待阐明。Harb等[40]的研究表明,骨髓来源的祖细胞能够替代肝窦和中央静脉内皮细胞从而修复损伤,而野百合碱能够抑制骨髓和循环中的内皮祖细胞。由此可见,PA-HSOS的发病机制应当包括两方面:(1)PA对肝窦和中央静脉内皮细胞的直接损伤;(2)PA对骨髓祖细胞损伤从而阻止内皮细胞修复[41]。
推荐意见(2):肝脏是PA损伤的主要靶器官,此外,部分种类PA还会导致肺动脉高压(A1)。
推荐意见(3):肝腺泡Ⅲ区肝窦内皮细胞肿胀、损伤、脱落,肝窦显著扩张、充血,是急性PA-HSOS的典型病理改变(A1)。
3 临床表现和实验室检查
PA-HSOS的主要临床表现包括腹胀、肝区疼痛、纳差、乏力、腹水、黄疸、肝脏肿大等[42]。患者多数在服用含PA植物后1个月内发病,也可经过较长时间后出现临床症状。体格检查有不同程度的皮肤巩膜黄染、肝区叩击痛、移动性浊音阳性,严重者合并胸水和下肢水肿。一些重度或治疗无效、病情进行性加重的患者可以并发感染(以呼吸系统为主)和(或)肝肾功能衰竭,并可导致死亡。慢性期患者可缺少部分典型表现,或仅表现为顽固性腹水和门静脉高压相关并发症。
大多数患者的血常规没有明显异常,合并感染时有白细胞升高,一些严重患者可表现为血小板进行性降低。肝功能异常主要表现为血清总胆红素升高,范围多在17.1~85.5 μmol/L,还可有ALT、AST和(或)ALP、GGT的升高,少部分重度患者或并发门静脉血栓导致肝功能恶化时,血清胆红素显著升高[42]。凝血功能大都正常或仅有PT及活化部分凝血酶原时间(activated partial tinthromboplas time,APTT)的轻度延长,但D二聚体升高较常见。腹水性质符合典型的门静脉高压性腹水表现,血清腹水白蛋白梯度(serum ascites albumin gradient,SAAG)>11 g/L。
有文献报道,PA-HSOS患者外周血均能检测到一定浓度PPAs,对临床诊断患者是否服用含PA的植物或药物特异性强。检测方法:采集250 μl血清,采用超高效液相色谱-质谱法定量检测。以脱氢野百合碱与谷胱甘肽反应合成的吡咯-GSH复合物7,9-二谷胱甘酰DHR建立标准曲线,所测得浓度是所有PPAs释放的吡咯基团的浓度[3,43-44]。
推荐意见(4):PA-HSOS的主要临床表现为腹胀、肝区疼痛、腹水、黄疸、肝脏肿大(A1)。
4 影像学检查
影像学检查是临床怀疑PA-HSOS时的必查项目。PA-HSOS二维超声的典型表现包括[45-48]:肝脏弥漫性肿大;肝实质回声增粗增密,分布不均匀,可见沿肝静脉走行的“斑片状”回声减低区;腹腔积液。彩色多普勒超声的表现是门静脉、脾静脉内径正常,血流速度减慢(<25 cm/s)[48]。超声造影的表现为动脉期呈“花斑样”不均匀增强;门静脉充盈缓慢;肝动脉-肝静脉渡越时间延长[45-46]。
典型CT表现包括[24-26,49-51]:(1)肝脏弥漫性肿大,平扫显示肝实质密度不均匀减低;(2)静脉期和平衡期肝实质呈特征性“地图状”、“花斑样”不均匀强化,门静脉周围出现的低密度水肿带称为“晕征”;(3)尾状叶、肝左外叶受累稍轻,肝静脉周围肝实质强化程度较高,呈现特征性“三叶草征”,肝静脉管腔狭窄或显示不清,下腔静脉肝段受压变细;(4)通常合并腹水、胸水、胆囊壁水肿和胃肠壁水肿等肝外征象(图3)。急性期患者较少合并脾大、食管胃静脉曲张等征象。
MRI的典型表现包括:平扫表现为肝脏体积增大和大量腹水,肝脏信号不均,3支肝静脉纤细或显示不清;T2加权成像(T2WI)表现为片状高信号,呈“云絮”状。MRI动态增强扫描表现为动静脉期不均匀强化,呈“花斑”状,延迟期强化更明显[25,52-53]。

图3土三七导致人急性HSOS的CT表现a:上腹部CT平扫示肝脏弥漫性肿大,肝实质密度均匀减低,腹腔积液;b:上腹部CT平扫示肝脏形态饱满,肝实质密度不均匀减低,腹腔大量积液;c:上腹部CT平扫示肝脏不均匀分布斑片状低密度影,脾脏形态饱满,肝周、脾周及腹腔积液;d:上腹部CT扫描动脉期示肝脏“地图状”、“花斑样”不均匀强化,肝动脉及其分支形态增粗,胃黏膜明显强化,腹腔大量积液;e:上腹部CT扫描平衡期矢状位重建图像示下腔静脉肝段受压变细,管腔通畅(南京大学医学院附属鼓楼医院放射科惠赠)
5 诊断和鉴别诊断
5.1 主要检查项目 临床上以腹胀、肝区疼痛、腹水、黄疸、肝脏肿大等表现就诊的患者,应考虑PA-HSOS的可能性,需详尽采集既往用药史,必要时反复多次询问。有明确服用含PA植物史是PA-HSOS诊断的基础。疑诊患者需完善超声检查,至少包括肝脏、脾脏、门静脉、腹腔积液等项目。超声检查对PA-HSOS的诊断有价值,但过于依赖超声医师的经验和水平。因此,超声仅作为初筛检查,所有患者都应进一步完善腹部增强CT和(或)MRI检查,发现典型征象者,即可确诊为PA-HSOS。同时,需排除其他已知病因引起相似肝损伤的疾病,如BCS、失代偿期肝硬化、感染、酒精性肝损伤及其他药物性肝损伤等。其他如超声剪切波弹性成像技术、超声造影等检查的诊断价值仍需要探索。
对于实验室和影像学检查不典型的疑诊患者,可行肝脏活组织检查获取病理支持。若患者合并大量腹水,经皮肝穿刺活组织检查风险较大。此时,有条件的单位可采取经颈静脉肝活组织检查术(transjugular liver biopsy,TJLB), 安全性较高[54]。 还可联合测
定肝静脉压力梯度(hepatic venous pressure gradient,HVPG)评估门静脉高压情况。在HSCT-HSOS的诊断中,国外报道HVPG>10 mm Hg敏感度为52%,特异度为91%[14]。HVPG也有一定的预后判断价值,HVPG越高者预后越差[13]。
对于临床怀疑PA-HSOS的患者,如无法获得明确服用含PA植物史,可行血清PPAs检测,其具有溯源性诊断价值[2-3]。Gao等[43]的前瞻性研究(包含23例PA-HSOS和17例对照组)显示,外周血PPAs检测诊断PA-HSOS的敏感度为100%,特异度94.1%(23/24),阳性预测值95.8%,阴性预测值100%;同时,PPAs水平越高,预后越差。但是目前能够开展这项检查的医院较少。
5.2 PA-HSOS的诊断标准和诊断路径 目前国际上常用的HSCT-HSOS临床诊断标准主要包括改良Seattle标准和Baltimore标准[10](表3)。但上述标准的敏感度和特异度并不明确,且只针对HSCT-HSOS,未在其他病因的HSOS诊断中得到充分验证[14]。对于PA-HSOS的诊断,目前尚无统一标准,多在一定程度上借鉴Baltimore和Seattle标准。一项总结了115例急性PA-HSOS的临床和影像特征的单中心回顾性研究发现,虽然93.91%的患者血清总胆红素浓度高于正常值上限(17.1 μmol/L),但41.74%患者血清总胆红素≤34.2 μmol/L[42]。这一结果提示,如果参照Baltimore或Seattle标准中胆红素水平诊断PA-HSOS,会有相当一部分患者不符合其诊断标准。另外,该研究还发现,高达95%以上PA-HSOS患者有典型的影像学改变:肝大、增强CT平衡期肝脏不均匀强化、肝段下腔静脉受压变细,超声检查发现门静脉和脾静脉血流速度减慢,这些影像学改变在Baltimore或改良Seattle标准中没有提及。基于以上事实和国内外文献报道,参照改良Seattle标准和Baltimore标准,本共识推荐PA-HSOS诊断的“南京标准”(表3)。PA-HSOS的诊断路径见图4。
在确立PA-HSOS诊断的同时,需考虑病程分期和严重程度分级,因为不同病程时期的临床表现和治疗不尽相同,不同严重程度的患者预后差别巨大。然而,目前对PA-HSOS的病程和严重程度知之甚少,更无简单易用的分层工具。以下参照HSCT-HSOS的标准,是否完全适用还需要进一步研究。根据PA-HSOS病程和临床表现的不同特点, 大体上可将其分为急性期/亚急性期、慢期。急性期/亚急性期:一般指起病3 d至4周以内,患者有腹胀、肝区疼痛、腹水,肝脏迅速肿大、叩击痛,可伴有纳差、恶心、呕吐等症状,绝大部分患者可有黄疸。慢性期:病程一般在发病数月以后,以腹水和(或)食管胃静脉曲张破裂出血等门静脉高压并发症为主要表现,与失代偿期肝硬化的临床表现相似[6,17,55]。按疾病程度分为轻度、中度和重度:轻度HSOS具有自限性,不需要治疗;中度HSOS经积极的对症支持治疗尚能恢复;重度HSOS治疗100 d后仍无好转,多合并多脏器功能衰竭,可导致死亡[14]。但该分度为回顾性,对临床治疗指导意义有限。

表3 HSOS的诊断标准
注:通过病理确诊需要有典型病理表现:肝腺泡Ⅲ区肝窦内皮细胞肿胀、损伤、脱落,肝窦显著扩张、充血
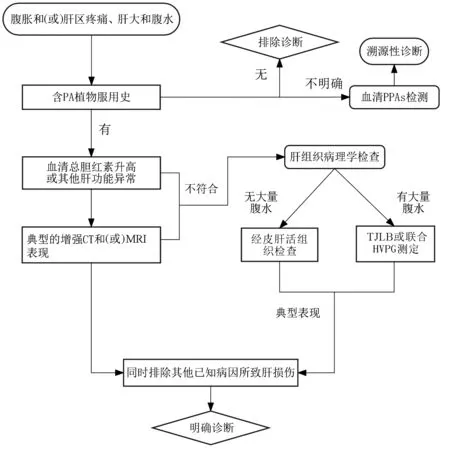
图4 PA-HSOS诊断路径图
5.3 鉴别诊断
本病主要应与BCS鉴别,尤其是单纯的肝静脉阻塞型BCS,两者容易混淆;另外,PA-HSOS也较易被误诊为肝硬化并发腹水、急性重型肝炎等。
5.3.1 布-加综合征(BCS) BCS是由各种原因的肝静脉及肝后段下腔静脉阻塞,导致肝静脉血流出受阻而继发的一类疾病。急性期患者主要表现为肝区疼痛、肝大、黄疸、顽固性腹水和(或)双下肢水肿等。临床上诊断BCS主要依赖影像学检查,超声可见下腔静脉近心端和(或)肝静脉有狭窄或闭塞,常伴有尾状叶肿大、肝静脉间交通支形成、第三肝门开放等特征性表现。病理学光学显微镜下主要表现为梗阻性淤血性改变,缺少内皮细胞的损伤、窦周和小叶间静脉纤维化和胶原蛋白沉积。PA-HSOS时,肝脏肿大压迫下腔静脉造成其狭窄,但肝静脉变细且不具备肝静脉间交通支是其与BCS的重要区别。对于一些诊断困难或者疑似病例还可以通过下腔静脉造影或者HVPG测定来进一步明确诊断。虽然BCS和PA-HSOS临床表现相似,但两类疾病的发病机制与治疗不尽相同,因此,鉴别诊断显得尤为重要。
5.3.2 失代偿期肝硬化 如果忽视了服用含PA植物的病史,急性期/亚急性期PA-HSOS易误诊为失代偿期肝硬化。慢性期HSOS会有类似肝硬化的临床表现,且治疗并无太大差别。但急性期/亚急性期HSOS的表现和治疗与肝硬化有明显不同。HSOS与失代偿期肝硬化的鉴别要点包括病史、病理和辅助检查。失代偿期肝硬化患者起病缓慢,病情迁延数年甚至数十年,患者常有明确的肝炎病毒感染史、长期大量饮酒史或自身免疫病等致肝损伤的病因。实验室检查可见转氨酶升高、低蛋白血症、凝血功能异常和脾功能亢进等。超声检查可见肝脏左右叶比例失调、体积缩小、实质回声增粗,门静脉扩张,脾大等。胃镜检查可见食管胃静脉曲张和门静脉高压性胃病等表现。PA-HSOS患者肝脏体积增大、实质回声不均匀,门静脉无扩张,脾脏一般不肿大,急性期患者食管胃静脉曲张常常不明显,但胃肠黏膜水肿常见。失代偿期肝硬化患者肝脏病理可发现假小叶形成、中央静脉缺失、纤维组织增生等典型改变。急性期PA-HSOS的典型表现是肝窦扩张伴出血及淤血,肝腺泡Ⅲ区为主的肝板结构破坏,中央静脉内膜破坏和淤血,部分慢性期PA-HSOS患者可以出现广泛的血窦内和窦周围胶原蛋白沉积等病理学改变。
5.3.3 急性重型肝炎 急性重型肝炎是指因大量肝细胞坏死而在起病数天内患者出现肝性脑病、腹水和凝血功能障碍的一种严重肝病,具有起病急、预后差、病死率高等特点。当PA-HSOS肝损伤严重时,临床表现类似,容易误诊。但急性重型肝炎多有明确病因,包括肝炎病毒感染、药物诱导、代谢和自身免疫等原因。另外,急性肝炎较少出现大量腹水,当重型肝炎出现腹水时肝脏体积多已缩小,而PA-HSOS多以腹水为突出表现。重型肝炎患者凝血功能严重障碍,而PA-HSOS患者凝血功能大多正常或轻度异常。肝组织病理检查和HVPG测定有重要鉴别诊断价值。
推荐意见(5):超声仅作为初筛检查,腹部增强CT和(或)MRI检查的典型表现对PA-HSOS的诊断和鉴别诊断具有重要价值(B1)。
推荐意见(6):对含PA植物服用史不明确的患者,血清PPAs浓度测定对临床怀疑PA-HSOS的患者具有溯源性诊断价值(B1)。
推荐意见(7):PA-HSOS的诊断推荐“南京标准”:有明确服用含PA植物史,且符合以下3项[腹胀和(或)肝区疼痛、肝大和腹水;血清总胆红素升高或其他肝功能异常;典型的增强CT或MRI表现],或通过病理确诊,同时排除其他已知病因所致肝损伤。通过病理确诊需要有典型病理表现:肝腺泡Ⅲ区肝窦内皮细胞肿胀、损伤、脱落,肝窦显著扩张、充血(B1)。
推荐意见(8):对于实验室及影像学检查不典型的疑诊患者,建议行肝穿刺活组织检查,存在大量腹水者,为降低操作相关风险,可采用TJLB,并可行HVPG测定评估门静脉压力(B1)。
推荐意见(9):PA-HSOS需注意与BCS、失代偿期肝硬化、急性重型肝炎等疾病鉴别(A1)。
6 治疗
6.1 治疗原则 所有疑诊患者均应停止服用含PA植物。对症支持治疗是PA-HSOS的基础治疗方案,包括保肝、利尿、改善微循环等,应当尽早开始。腹水严重且药物治疗无效时可考虑腹腔置管引流,当液体潴留和严重肾功能下降时,需要进行血液透析或血液滤过。合并多脏器功能衰竭的患者应当入住监护病房。急性期/亚急性期患者在排除禁忌情况下,建议给予抗凝治疗。内科治疗效果不佳者,可行经颈静脉肝内门腔分流术(TIPS)控制顽固性腹水和门静脉高压[56]。对于合并肝衰竭内科治疗不佳的患者,可考虑行肝移植术。
6.2 对症支持治疗 对症支持治疗对于急性期/亚急性期患者尤为重要。保肝治疗可以改善肝脏淤血缺氧对肝细胞造成的损伤,为肝细胞的再生及肝功能的恢复提供有利的内环境。目前临床常用的保肝药物主要有多烯磷脂酰胆碱、异甘草酸镁、谷胱甘肽等药物,合并肝内胆汁淤积或高胆红素血症时,可以选择熊去氧胆酸和(或)S-腺苷蛋氨酸治疗。利尿治疗首选口服呋塞米和螺内酯联合应用。如利尿剂无效,可以在B超定位下进行腹腔穿刺,同时配合大量白蛋白输注。对于改善微循环的药物如前列腺素E1、活血化瘀类中药等在PA-HSOS治疗中的作用尚不确切[57-58]。综合国内各大型医院相关病例报道(以PA-HSOS为主)结果显示,仅给予以对症支持治疗为主的内科治疗,PA-HSOS的病死率为12.2%~78.6%[7,20-21,59]。由于各单位报道病例数量、病情轻重程度、病程时间、具体治疗方案均不同,故病死率差异较大,但大多数报道病死率在40%以上[60-62]。对症支持治疗虽然无法从根本上逆转PA-HSOS患者的病理生理学改变,但是可能通过相关治疗减轻水钠潴留,修复受损的肝细胞,进而促进肝功能早日恢复。
6.3 糖皮质激素治疗 糖皮质激素对PA-HSOS的疗效仍存在争议。国外在HSCT-HSOS中的相关激素应用研究提示其可能有效。2013年英国指南推荐大剂量激素冲击可以用于HSCT-HSOS的治疗,但需关注感染的风险,且证据等级偏低[10]。糖皮质激素在PA-HSOS中应用的证据主要来自于国内几个单位的基础研究和小样本临床病例报道[7,20-21,63],疗效尚不能确定。
6.4 抗凝治疗 存在腹水、黄疸等表现的急性期/亚急性期患者是抗凝治疗的主要人群,并应尽早开始。禁忌证主要是合并严重出血疾病或出血倾向。抗凝药物首选低分子肝素,亦可联合或序贯口服维生素K拮抗剂(华法林)。低分子肝素安全性较普通肝素高,出血不良反应少,大多数患者使用时无需监测。建议剂量为100 IU/Kg,每12 h 1次,皮下注射,肾功能不全者慎用。华法林是长期抗凝治疗的主要口服药物,疗效评估需监测凝血酶原国际标准化比值(INR)。治疗剂量范围窄,个体差异大,药效易受多种食物和药物影响。抗凝强度:建议INR为2.0~3.0,这一强度可能既满足较佳的抗凝强度,也有较好的安全性。初始剂量:建议口服起始剂量为1.25~3 mg/d(即半片~1片,国内主要规格为2.5 mg和3 mg),高龄、肝功能严重受损等患者初始剂量可适当降低。剂量调整:口服2~3 d后开始测定INR,并定期监测,剂量调整应谨慎,如连续2次测得INR不达标,再考虑调整剂量(一般为加或减1/4片),待剂量稳定后可4周监测1次。抗凝治疗的主要不良反应是出血,包括轻微出血和严重出血。抗凝治疗2周后通过临床表现、肝功能、影像学检查结果评估效果,如治疗有效,继续抗凝至3个月以上;如治疗无效,停止抗凝,考虑其他治疗措施。其他抗凝药物缺乏经验。
国内部分单位在PA-HSOS的治疗中有使用肝素或低分子肝素抗凝的小样本报道,治愈和好转率达70%~88.9%[8,27,64-65]。王轶等[66]在一项单中心回顾性研究中总结了连续85例PA-HSOS患者不同治疗方案的中长期随访结果:22例未抗凝患者中,14例死亡(63.6%);63例采用低分子肝素联合口服华法林抗凝治疗的患者中,6例死亡(9.5%),36例治愈(57.1%),21例因抗凝2周未见改善行TIPS治疗的患者中20例症状明显改善;两组疗效差异有统计学意义。同时,所有采用抗凝治疗的患者均未发生因联合使用低分子肝素和华法林导致的并发症(如严重大出血)。基于以上结果,建议急性期/亚急性期的PA-HSOS患者应尽早给予抗凝治疗。
6.5 TIPS 目前有几篇小样本研究报道了TIPS治疗急性期HSCT-HSOS的效果,疗效各异[67-68]。一篇包括10例重度HSCT-HSOS的病例报道显示5例TIPS术后10 d内死亡,而另外5例显著好转[69]。2011年意大利推荐意见指出,行TIPS治疗的HSCT-HSOS患者存活率为20%,如果患者已经合并多脏器功能衰竭,TIPS为时已晚[13]。这可能是由于大部分HSCT-HSOS患者合并有严重的血液系统疾病,基础情况差,影响TIPS治疗的效果。但是PA-HSOS患者一般不合并致命性基础疾病。王轶等[70]报道23例PA-HSOS患者,在对症支持或联合抗凝治疗无效后行TIPS治疗,1例死于手术并发症,大部分患者在术后1周左右腹水明显消退,随访期内22例均存活,仅2例术后发生肝性脑病(9.1%),肝性脑病发生率显著低于因肝硬化行TIPS的患者。因此,TIPS对于内科治疗无效的PA-HSOS患者能够明显改善腹水及门静脉高压。但TIPS是否能够改善远期预后还需要更长的随访观察[12,56]。
6.6 肝移植术 肝移植是治疗多种终末期肝病的有效方法。目前有个别报道表明肝移植可以改善HSCT-HSOS患者预后,但限于器官供应短缺尚无足够证据支持[12]。迄今国内尚无PA-HSOS患者行肝移植的研究文献报道。对于合并肝衰竭经过内科治疗无效的患者,可考虑行肝移植。
6.7 其他治疗 去纤苷(defibrotide,DF)是唯一被证明有效的预防和治疗HSCT-HSOS的药物[10],欧洲药品管理局在2014年批准DF用于治疗重度HSCT-HSOS。但由于DF在我国未上市,故对PA-HSOS的疗效尚不清楚。一些小样本研究或个案报道采用诸如抗凝血酶原Ⅲ(AT-Ⅲ)[71]、重组人血栓调节蛋白[72]、N-乙酰半胱氨酸(NAC)[73]、重组人组织型纤溶酶原激活因子(tissue type plasminogen activator,t-PA)[74]等治疗HSCT-HSOS,但疗效尚不确定,且国内对PA-HSOS治疗缺乏经验,仍需要进一步研究。
推荐意见(10):对症支持是PA-HSOS的基础治疗(B1)。
推荐意见(11):急性期/亚急性期PA-HSOS患者排除禁忌症后应尽早给予抗凝治疗,可选择单用低分子肝素或酌情联用华法林,亦可序贯口服华法林(B1)。
推荐意见(12):糖皮质激素、前列腺素E1等治疗PA-HSOS疗效尚不确定(D1)。
推荐意见(13):对于内科治疗效果不佳者,在充分评估获益及风险后,可考虑行TIPS控制顽固性腹水和门静脉高压(B1)。
推荐意见(14):对于合并肝衰竭内科治疗无效的患者,可考虑行肝移植术(C1)。
7 展望
对于PA-HSOS,首先要加强宣传,引导人们在医师或药师指导下正规使用含PA植物,切勿私自口服。同时,应该通过基层社会管理的力量教育群众认识含PA植物的巨大危害,甄别参三七和土三七。PA-HSOS的发病机制、病情评估及治疗措施等方面还有许多不清楚的地方,有待进一步研究。
推荐意见(15):加强宣教,引导人们在医师或药师指导下正规使用含PA植物(A1)。
参加本共识撰写和讨论的专家人员名单(排名不分先后,按姓氏汉语拼音为序):白文元、陈东风、陈骏、陈立刚、冯缨、高艳景、韩浩、何健、胡锡琪、姜海行、李良平、刘杰、刘玉兰、陆伦根、马雄、宓余强、聂勇战、沈薇、沈锡中、唐涌进、田德安、王红玲、王吉耀、王江滨、王轶、谢渭芬、徐有青、徐肇敏、许国强、许建明、杨建、杨丽、杨玲、杨云生、张峰、张明、张玮、周新民、诸葛宇征、朱斌、朱萱、邹晓平
[1] WANG JY, GAO H. Tusanqi and hepatic sinusoidal obstruction syndrome[J]. J Dig Dis, 2014, 15(3): 105-107.
[2] GAO H, LI N, WANG JY, et al. Definitive diagnosis of hepatic sinusoidal obstruction syndrome induced by pyrrolizidine alkaloids[J]. J Dig Dis, 2012, 13(1): 33-39.
[3] LIN G, WANG JY, LI N, et al. Hepatic sinusoidal obstruction syndrome associated with consumption of Gynura segetum[J]. J Hepatol, 2011, 54(4): 666-673.
[4] XU ZM, ZHUGE YZ, XU TS, et al.Raise the recognition of hepatic veno-occlusive disease induced by Chrysanthemum-like Groundsel[J]. Chin J Gastroenterol, 2009, 14(10): 577-579.(in Chinese) 徐肇敏, 诸葛宇征, 徐天舒. 提高对“土三七”致肝小静脉闭塞病的认识[J]. 胃肠病学, 2009, 14(10): 577-579.
[5] DELEVE LD, SHULMAN HM, MCDONALD GB. Toxic injury to hepatic sinusoids: sinusoidal obstruction syndrome (veno-occlusive disease)[J]. Semin Liver Dis, 2002, 22(1): 27-42.
[6] FAN CQ, CRAWFORD JM. Sinusoidal obstruction syndrome (hepatic veno-occlusive disease)[J]. J Clin Exp Hepatol, 2014, 4(4): 332-346.
[7] ZHANG YT, LI S, ZHOU DH, et al.Clinical features of sinusoidal obstruction syndrome: an analysis of 35 cases and literature review[J]. J Clin Hepatol, 2013, 29(12): 936-939. (in Chinese) 张艳亭, 李爽, 周东辉, 等. 肝窦阻塞综合征35例临床分析及文献复习[J]. 临床肝胆病杂志, 2013, 29(12): 936-939.
[8] ZHU WL, CHEN SH, CHEN WX, et al. Clinical analysis of 50 cases of hepatic veno - occlusive disease[J]. Chin J Dig, 2012, 32(9): 620-624. (in Chinese) 朱晚林, 陈韶华, 陈卫星, 等. 肝小静脉闭塞病50例临床分析[J]. 中华消化杂志, 2012, 32(9): 620-624.
[9] GU C, ZOU XP, XU ZM, et al. Clinical features of hepatic veno-occlusive disease caused by Gynura segetum (Lour.) Merr.[J]. Chin J Dig, 2010, 30(10): 771-772. (in Chinese) 顾超,邹晓平,徐肇敏,等. 土三七致肝小静脉闭塞病的临床特点分析[J]. 中华消化杂志, 2010, 30(10): 771-772.
[10] DIGNAN FL, WYNN RF, HADZIC N, et al. BCSH/BSBMT guideline: diagnosis and management of veno-occlusive disease (sinusoidal obstruction syndrome) following haematopoietic stem cell transplantation[J]. Br J Haematol, 2013, 163(4): 444-457.
[11] MOHTY M, MALARD F, ABECASSIS M, et al. Sinusoidal obstruction syndrome/veno-occlusive disease: current situation and perspectives-a position statement from the European Society for Blood and Marrow Transplantation (EBMT)[J]. Bone Marrow Transplant, 2015, 50(6): 781-789.
[12] DELEVE LD, VALLA DC, GARCIA-TSAO G. Vascular disorders of the liver[J]. Hepatology, 2009, 49(5): 1729-1764.
[13] SENZOLO M, RIGGIO O, PRIMIGNANI M. Vascular disorders of the liver: recommendations from the Italian Association for the Study of the Liver (AISF) ad hoc committee[J]. Dig Liver Dis, 2011, 43(7): 503-514.
[14] European Association for the Study of the Liver. EASL clinical practice guidelines: vascular diseases of the liver[J]. J Hepatol, 2016, 64(1): 179-202.
[15] HILL KR, RHODES K, STAFFORD JL, et al. Serous hepatosis: a pathogenesis of hepatic fibrosis in Jamaican children[J]. Br Med J, 1953, 1(4802): 117-122.
[16] BRAS G, JELLIFFE DB, STUART KL. Veno-occlusive disease of liver with nonportal type of cirrhosis, occurring in Jamaica[J]. AMA Arch Pathol, 1954, 57(4): 285-300.
[17] DELEVE LD, MCCUSKEY RS, WANG X, et al. Characterization of a reproducible rat model of hepatic veno-occlusive disease[J]. Hepatology, 1999, 29(6): 1779-1791.
[18] LI Y, XU JM.Clinical analysis of 11 cases of hepatic veno-occlusive disease caused by Chinese herbal medicine[J]. J Clin Hepatol, 2011, 27(2): 140-142.(in Chinese) 李杨, 许建明. 中草药致肝小静脉闭塞病11例临床分析[J]. 临床肝胆病杂志, 2011, 27(2): 140-142.
[19] WANG Q, LU ZM, GUO T. Traditional chinese medicine containing pyrrolizidine alkaloids and hepatic veno-occlusive disease[J].Chin J Clin Gastroenterol, 2008, 20(1): 22-25. (in Chinese) 王强, 鲁重美, 郭涛. 含吡咯烷生物碱的中草药与肝小静脉闭塞病[J]. 临床消化病杂志, 2008, 20(1): 22-25.
[20] LI YJ, GU C, ZHUGE YZ.Clinical characteristics of hepatic veno-occlusive disease: an alysis of 16 cases[J]. Chin J Clin Res, 2012, 25(2): 122-124. (in Chinese) 李昱江, 顾超, 诸葛宇征. 肝小静脉闭塞病16例临床分析[J]. 中国临床研究, 2012, 25(2): 122-124.
[21] REN L, HU S, ZHU WD, et al.Hepatic veno-occlusive disease: a clinical analysis of 14 cases[J]. Clin Focus , 2015, 30(1): 100-103. (in Chinese) 任雷, 胡粟, 朱卫东, 等. 肝小静脉闭塞病14例临床分析[J]. 临床荟萃, 2015, 30(1): 100-103.
[22] XU JM. A national multicenter clinical investigation of hepatic veno-occlusive disease[C]. Collected papers from the 11th National Academic Conference on Digestive Diseases by Chinese Medical Association, 2011: 42-44. (in Chinese) 许建明. 肝小静脉闭塞病全国多中心临床调研分析[C]. 中华医学会第11次全国消化系疾病学术会议论文集, 2011: 42-44.
[23] DELEVE LD, ITO Y, BETHEA NW, et al. Embolization by sinusoidal lining cells obstructs the microcirculation in rat sinusoidal obstruction syndrome[J]. Am J Physiol Gastrointest Liver Physiol, 2003, 284(6): g1045-g1052.
[24] SHAO H, CHEN HZ, ZHU JS, et al. Computed tomography findings of hepatic veno-occlusive disease caused by Sedum aizoon with histopathological correlation[J]. Braz J Med Biol Res, 2015, 48(12): 1145-1150.
[25] ZHOU H, WANG YX, LOU HY, et al. Hepatic sinusoidal obstruction syndrome caused by herbal medicine: CT and MRI features[J]. Korean J Radiol, 2014, 15(2): 218-225.
[26] KAN X, YE J, RONG X, et al. Diagnostic performance of Contrast-enhanced CT in pyrrolizidine alkaloids-induced hepatic sinusoidal obstructive syndrome[J]. Sci Rep, 2016, 6: 37998.
[27] ZHANG LX, WU JP, XU H, et al.The diagnosis and differential diagnosis of hepatic veno-occlusive disease[J]. J Intervent Radiol, 2012, 21(12): 987-990. (in Chinese) 张璐西, 吴金平, 徐浩, 等. 肝小静脉闭塞病的诊断与鉴别诊断[J]. 介入放射学杂志, 2012, 21(12): 987-990.
[28] MATTOCKS AR. Toxicity of pyrrolizidine alkaloids[J]. Nature, 1968, 217(5130): 723-728.
[29] HUXTABLE RJ. Activation and pulmonary toxicity of pyrrolizidine alkaloids[J]. Pharmacol Ther, 1990, 47(3): 371-389.
[30] CHOJKIER M. Hepatic sinusoidal-obstruction syndrome: toxicity of pyrrolizidine alkaloids[J]. J Hepatol, 2003, 39(3): 437-446.
[31] EDGAR JA, MOLYNEUX RJ, COLEGATE SM. Pyrrolizidine alkaloids: potential role in the etiology of cancers, pulmonary hypertension, congenital anomalies, and liver disease[J]. Chem Res Toxicol, 2015, 28(1): 4-20.
[32] CHEN Z, HUO JR. Hepatic veno-occlusive disease associated with toxicity of pyrrolizidine alkaloids in herbal preparations[J]. Neth J Med, 2010, 68(6): 252-260.
[33] YANG M, RUAN J, FU PP, et al. Cytotoxicity of pyrrolizidine alkaloid in human hepatic parenchymal and sinusoidal endothelial cells: Firm evidence for the reactive metabolites mediated pyrrolizidine alkaloid-induced hepatotoxicity[J]. Chem Biol Interact, 2016, 243: 119-126.
[34] DELEVE LD, WANG X, KUHLENKAMP JF, et al. Toxicity of azathioprine and monocrotaline in murine sinusoidal endothelial cells and hepatocytes: the role of glutathione and relevance to hepatic venoocclusive disease[J]. Hepatology, 1996, 23(3): 589-599.
[35] WANG X, KANEL GC, DELEVE LD. Support of sinusoidal endothelial cell glutathione prevents hepatic veno-occlusive disease in the rat[J]. Hepatology, 2000, 31(2): 428-434.
[36] DELEVE LD, WANG X, TSAI J, et al. Sinusoidal obstruction syndrome (veno-occlusive disease) in the rat is prevented by matrix metalloproteinase inhibition[J]. Gastroenterology, 2003, 125(3): 882-890.
[37] YU XZ, JI T, BAI XL, et al. Expression of MMP-9 in hepatic sinusoidal obstruction syndrome induced by Gynura segetum[J]. J Zhejiang Univ Sci B, 2013, 14(1): 68-75.
[38] DELEVE LD, WANG X, KANEL GC, et al. Decreased hepatic nitric oxide production contributes to the development of rat sinusoidal obstruction syndrome[J]. Hepatology, 2003, 38(4): 900-908.
[39] LI YH, TAI WC, XUE JY, et al. Proteomic study of pyrrolizidine alkaloid-induced hepatic sinusoidal obstruction syndrome in rats[J]. Chem Res Toxicol, 2015, 28(9): 1715-1727.
[40] HARB R, XIE G, LUTZKO C, et al. Bone marrow progenitor cells repair rat hepatic sinusoidal endothelial cells after liver injury[J]. Gastroenterology, 2009, 137(2): 704-712.
[41] VALLA DC, CAZALS-HATEM D. Sinusoidal obstruction syndrome[J]. Clin Res Hepatol Gastroenterol, 2016, 40(4): 378-385.
[42] ZHU CK, ZHANG F, ZHUGE YZ, et al. Clinical features of sinusoidal obstruction syndrome caused by Gynura segetum (Lour.) Merr.: an analysis of 115 cases[J].Chin J Dig, 2017, 37(7): 448-452. (in Chinese) 朱成凯, 张峰, 诸葛宇征, 等. 115例土三七致肝窦阻塞综合征的临床特点分析[J]. 中华消化杂志, 2017, 37(7): 448-452.
[43] GAO H, RUAN JQ, CHEN J, et al. Blood pyrrole-protein adducts as a diagnostic and prognostic index in pyrrolizidine alkaloid-hepatic sinusoidal obstruction syndrome[J]. Drug Des Devel Ther, 2015, 9: 4861-4868.
[44] RUAN J, GAO H, LI N, et al. Blood pyrrole-protein adducts-biomarker of pyrrolizidine alkaloid-induced liver injury in humans[J]. J Environ Sci Health C Environ Carcinog Ecotoxicol Rev, 2015, 33(4): 404-421.
[45] CHEN S, LI CL, GAO YY.Application of color doppler ultrasound in diagnosing hepatic veno-occlusive disease[J]. Chin J Med Imaging, 2010, 18(2): 154-156. (in Chinese) 陈爽, 李春伶, 高永艳. 彩色多普勒超声对肝小静脉闭塞症的诊断价值[J]. 中国医学影像学杂志, 2010, 18(2): 154-156.
[46] JIAGN TA, WENG HF, AO JY, et al. Significance of ultrasonography in diagnosing hepatic sinusoidal abstructive syndrome[J]. Chin J Ultrasound Med, 2008, 24(10): 951-955. (in Chinese) 蒋天安, 翁慧芳, 敖建阳, 等. 超声影像对肝窦阻塞综合征的诊断价值[J]. 中国超声医学杂志, 2008, 24(10): 951-955.
[47] YU S, FANG ZT, BAO Q, et al.Imaging findings of sinusoidal obstruction syndrome: an analysis of 6 cases[J]. Chin J Med Imaging, 2013, 11: 861-863. (in Chinese) 俞顺, 方主亭, 包强, 等. 肝窦阻塞综合征6例影像学表现[J]. 中国医学影像学杂志, 2013, 11: 861-863.
[48] YANG J, HAN H, LI X, et al.Evaluation of acoustic radiation force impulse imaging combined with color Doppler ultrasonography in patients with hepatic veno-occlusive disease after taking Gynura segetum[J]. J Clin Ultrasound in Med, 2016, 18(9): 597-600. (in Chinese) 杨建, 韩浩, 李霞, 等. 彩色多普勒超声联合声辐射力脉冲成像诊断菊叶三七致肝小静脉闭塞病的应用价值[J]. 临床超声医学杂志, 2016, 18(9): 597-600.
[49] ZHANG GH, KONG AZ, FANG JW, et al. CT imaging of hepatic veno-occlusive disease(an analysis 14 cases)[J]. Chin J Radiol, 2006, 40(3): 250-254. (in Chinese) 张国华, 孔阿照, 方军伟, 等. 肝小静脉闭塞病的CT表现(附14例分析)[J]. 中华放射学杂志, 2006, 40(3): 250-254.
[50] SHI TT, HE J, SHI J, et al.CT features of hepatic veno-occlusive disease caused by Gynura segetum[J]. J Pract Radiol, 2016, 32(6): 875-878. (in Chinese) 施婷婷, 何健, 史炯, 等. 土三七致肝小静脉闭塞症的CT影像分析[J]. 实用放射学杂志, 2016, 32(6): 875-878.
[51] WU XW, WANG WQ, LIU B, et al. Hepatic veno-occlusive disease after taking Gynura Rhizome: the value of multidetector computed tomography in diagnosing the disease and evaluating the clinical therapeutic effect[J]. Hepatol Res, 2012, 42(3): 304-309.
[52] PEI YG, HU DY, SHEN YQ, et al.The value of MSCT and MRI in the diagnosis of hepatic veno-occlusive disease[J]. Chin J Hepatol, 2010, 18(2): 150-152. (in Chinese) 裴贻刚, 胡道予, 沈亚琪, 等. 多层螺旋CT与核磁共振成像对肝小静脉闭塞病的诊断价值[J]. 中华肝脏病杂志, 2010, 18(2): 150-152.
[53] YE TH, LIAGN HM, YE J, et al.CT and MR findings of hepatic sinusoidal obstruction syndrome caused by Gynura segetum[J/CD]. Chin J Interv Radiol: Electronic Edition, 2015, 3(1): 27-33.(in Chinese) 叶天和, 梁惠民, 叶进, 等. 土三七致肝窦阻塞综合征的CT及MRI诊断[J/CD]. 中华介入放射学电子杂志, 2015, 3(1): 27-33.
[54] ZHAGN M, ZHUGE YZ, CHEN J.A typical hepatic veno-occlusive disease confirmed by measurement of hepatic venous pressure gradient and transjugular liver biopsy: a case report[J]. Chin J Dig, 2013, 33(9): 636-637. (in Chinese) 张明, 诸葛宇征, 陈骏. 肝静脉压力梯度测定和经颈静脉肝活组织检查确诊不典型肝小静脉闭塞病一例[J]. 中华消化杂志, 2013, 33(9): 636-637.
[55] LIU YL.Sinusoidal obstruction syndrome: issues and challenges in clinical diagnosis and treatment[J]. Chin J Dig, 2015, 35(2): 73-76. (in Chinese) 刘玉兰. 肝窦阻塞综合征: 临床诊治面临的问题与挑战[J]. 中华消化杂志, 2015, 35(2): 73-76.
[56] de la RUBIA J, CARRAL A, MONTES H, et al. Successful treatment of hepatic veno-occlusive disease in a peripheral blood progenitor cell transplant patient with a transjugular intrahepatic portosystemic stent-shunt (TIPS)[J]. Haematologica, 1996, 81(6): 536-539.
[57] HOPPS SA, BORDERS EB, HAGEMANN TM. Prophylaxis and treatment recommendations for sinusoidal obstruction syndrome in adult and pediatric patients undergoing hematopoietic stem cell transplant: a review of the literature[J]. J Oncol Pharm Pract, 2016, 22(3): 496-510.
[58] YANG L, HUO JR, ZHU HY, et al.Clinical effect of Salvia miltiorrhiza in prevention and treatment of hepatic veno-occlusive disease induced by Gynura segetum (Lour.) Merr. in mice[J]. Chin Hepatol, 2013, 18(2): 105-107. (in Chinese) 杨丽, 霍继荣, 朱洪怡, 等. 丹参对土三七诱导小鼠肝小静脉闭塞病预防治疗效果的观察[J]. 肝脏, 2013, 18(2): 105-107.
[59] WANG JY, ZHAGN GY, ZHU YM, et al.Clinical features of 9 cases of sinusoidal obstruction syndrome[J]. J Capit Med Univ, 2014, 35(5): 604-607. (in Chinese) 王峻瑶, 张国艳, 朱元民, 等. 肝窦阻塞综合征9例的临床分析[J]. 首都医科大学学报, 2014, 35(5): 604-607.
[60] ZHOU HH, XU XL, GUAN X, et al.Hepatic veno-occlusive disease induced by senecio chrysanthemoides: An analysis of 13 cases and literature review[J]. J Pract Hepatol, 2015, 18(3): 304-305. (in Chinese) 周宏华, 徐晓玲, 关心, 等. 土三七致肝小静脉闭塞病13例报道及文献复习[J]. 实用肝脏病杂志, 2015, 18(3): 304-305.
[61] LING M, WU QH.Hepatic veno- occlusive disease induced by senecio chrysanthemoides( Tusanqi ) in 81 patients : analysis of literature[J]. ADRJ, 2013, 15(5): 254-257. (in Chinese) 凌美, 武谦虎. 土三七致肝小静脉闭塞症81例文献分析[J]. 药物不良反应杂志, 2013, 15(5): 254-257.
[62] WU XJ, ZHANG K, YU MY, et al. Clinical analysis of four cases of hepatic veno-occlusive disease caused by Gynura segetum (Lour.) Merr[J]. Chin J Hepatol, 2007, 15(2): 151-153. (in Chinese) 吴新军, 张魁, 俞孟勇, 等. 菊叶三七致肝小静脉闭塞病4例[J]. 中华肝脏病杂志, 2007, 15(2): 151-153.
[63] ZHU H, CHU Y, HUO J, et al. Effect of prednisone on transforming growth factor-beta1, connective tissue growth factor, nuclear factor-kappaBp65 and tumor necrosis factor-alpha expression in a murine model of hepatic sinusoidal obstruction syndrome induced by Gynura segetum[J]. Hepatol Res, 2011, 41(8): 795-803.
[64] XU XJ, CHEN HT, SHAN GD.Diagnosis and treatment of sinusoidal obstruction syndrome caused by Gynura segetum (Lour.) Merr.: an analysis of 42 cases[J/CD]. Chin J Crit Care Med: Electronic Editon, 2010, 3(3): 178-180. (in Chinese) 徐小俊, 陈洪潭, 单国栋. 土三七致肝窦阻塞综合征42例诊治分析[J/CD]. 中华危重症医学杂志: 电子版, 2010, 3(3): 178-180.
[65] SONG Y, FAN HY.Clinical features of hepatic veno-occlusive disease induced by gynura root: analysis of 102 cases[J]. J Clin Hepatol, 2011, 27(5): 496-499. (in Chinese) 宋宇, 樊艳华. 土三七所致肝小静脉闭塞病102例临床分析[J]. 临床肝胆病杂志, 2011, 27(5): 496-499.
[66] WANG Y, ZHUGE YZ, ZHAGN F, et al.Treatment for Gynura segetum caused hepatic vein occlusive disease: a single-center retrospective study[J]. Chin J Dig, 2016 , 36 (12) : 811-815.(in Chinese) 王轶, 诸葛宇征, 张峰, 等. 土三七致肝小静脉闭塞病治疗的单中心回顾性研究[J]. 中华消化杂志, 2016, 36 (12) : 811-815.
[67] ZENZ T, ROSSLE M, BERTZ H, et al. Severe veno-occlusive disease after allogeneic bone marrow or peripheral stem cell transplantation-role of transjugular intrahepatic portosystemic shunt (TIPS)[J]. Liver, 2001, 21(1): 31-36.
[68] ALVAREZ R, BANARES R, CASARIEGO J, et al. Percutaneous intrahepatic portosystemic shunting in the treatment of veno-occlusive disease of the liver after bone marrow transplantation[J]. Gastroenterol Hepatol, 2000, 23(4): 177-180.
[69] AZOULAY D, CASTAING D, LEMOINE A, et al. Transjugular intrahepatic portosystemic shunt (TIPS) for severe veno-occlusive disease of the liver following bone marrow transplantation[J]. Bone Marrow Transplant, 2000, 25(9): 987-992.
[70] WANG Y, ZHAGN F, ZHAGN M, et al. Efficacy transjugularintrahepatic portosystemic stent-shunt gynurasegetum induced hepatic veno-occlusive disease refractoryascites[J]. World Chin J Dig, 2015, 23(26): 4261-4265. (in Chinese) 王轶, 张峰, 张明, 等. 经颈静脉肝内门腔静脉分流术治疗误服土三七后肝小静脉闭塞所致顽固性腹水的疗效[J]. 世界华人消化杂志, 2015, 23(26): 4261-4265.
[71] HAUSSMANN U, FISCHER J, EBER S, et al. Hepatic veno-occlusive disease in pediatric stem cell transplantation: impact of pre-emptive antithrombin III replacement and combined antithrombin III/defibrotide therapy[J]. Haematologica, 2006, 91(6): 795-800.
[72] NAKAMURA D, YOSHIMITSU M, KAWADA H, et al. Recombinant human soluble thrombomodulin for the treatment of hepatic sinusoidal obstructive syndrome post allogeneic hematopoietic SCT[J]. Bone Marrow Transplant, 2012, 47(3): 463-464.
[73] BARKHOLT L, REMBERGER M, HASSAN Z, et al. A prospective randomized study using N-acetyl-L-cysteine for early liver toxicity after allogeneic hematopoietic stem cell transplantation[J]. Bone Marrow Transplant, 2008, 41(9): 785-790.
[74] YOON JH, MIN WS, KIM HJ, et al. Experiences of t-PA use in moderate-to-severe hepatic veno-occlusive disease after hematopoietic SCT: is it still reasonable to use t-PA?[J]. Bone Marrow Transplant, 2013, 48(12): 1562-1568.
引证本文:Cooperative Group for Hepatic and Gall Diseases, Chinese Society of Gastroenterology, Chinese Medical Association. Expert consensus on diagnosis and treatment of quinazoline alkaloids-related sinusoidal obstruction syndrome (2017, Nanjing)[J]. J Clin Hepatol, 2017, 33(9): 1627-1637. (in Chinese) 中华医学会消化病学分会肝胆疾病协作组. 吡咯生物碱相关肝窦阻塞综合征诊断和治疗专家共识意见(2017年,南京)[J]. 临床肝胆病杂志, 2017, 33(9): 1627-1637.
(本文编辑:刘晓红)
Expertconsensusondiagnosisandtreatmentofpyrrolidinealkaloids-relatedsinusoidalobstructionsyndrome(2017,Nanjing)
CooperativeGroupforHepaticandGallDiseases,ChineseSocietyofGastroenterology,ChineseMedicalAssociation
hepatic veno-occlusive disease; diagnosis; therapy; consensus
10.3969/j.issn.1001-5256.2017.09.003
2017-07-26;
:2017-07-26。
江苏省消化系统疾病及消化道肿瘤临床医学中心 (YXZXB2016002)
诸葛宇征,电子信箱:yuzheng9111963@aliyun.com。
R575
:B
:1001-5256(2017)09-1627-11

