替比夫定阻断HBV母婴传播的效果和短期安全性
潘禹辰, 王 崇, 文思敏, 王 川, 孔 菲, 牛俊奇, 姜 晶
(1 吉林大学第一医院 a.临床研究部; b.肝胆胰内科, 长春 130021;2 北京市朝阳区妇幼保健院, 北京 100026)
论著/病毒性肝炎
替比夫定阻断HBV母婴传播的效果和短期安全性
潘禹辰1a, 王 崇1b, 文思敏1a, 王 川2, 孔 菲1b, 牛俊奇1b, 姜 晶1a
(1 吉林大学第一医院 a.临床研究部; b.肝胆胰内科, 长春 130021;2 北京市朝阳区妇幼保健院, 北京 100026)
目的观察高病毒载量乙型肝炎孕妇在孕晚期服用替比夫定对HBV母婴传播的阻断效果和短期安全性。方法募集2012年7月-2015年6月在吉林大学第一医院接受母婴阻断的HBsAg和HBeAg均阳性,HBV DNA≥2×106IU/ml的孕妇;向孕妇说明目前乙型肝炎母婴传播阻断所采用的方法,根据其意愿分为主被动免疫阻断+替比夫定组(替比夫定组)和主被动免疫阻断组(免疫阻断组)。替比夫定组孕妇从妊娠32周开始,口服替比夫定(600 mg,1次/d)至分娩时停药,免疫阻断组孕妇孕期不接受任何抗病毒治疗;2组婴儿产后均接受20 μg乙型肝炎疫苗联合100单位乙型肝炎免疫球蛋白的主被动免疫;7月龄时婴儿检测HBsAg阳性者为母婴传播阻断失败。符合正态分布的计量资料组间比较采用t检验;不符合正态分布的计量资料组间比较采用Wilcoxon秩和检验。计数资料组间比较采用χ2检验或Fisher精确检验。结果符合纳入标准的孕妇447例,其中替比夫定组81例,免疫阻断组366例。替比夫定组孕妇平均年龄高于免疫阻断组[(28.8±3.3)岁vs(27.6±3.8)岁,t=-2.55,P=0.01);替比夫定组HBV DNA载量>108IU/ml的孕妇所占比例高于免疫阻断组(82.7% vs 61.5%,χ2=13.21,P<0.001);2组孕妇在ALT水平、分娩方式和喂养方式方面的差异均无统计学意义(P值均>0.05)。替比夫定组婴儿81例,在7月龄时无HBsAg阳性者;免疫阻断组婴儿370例,7月龄时HBsAg阳性者21例,2组阳性率比较差异有统计学意义(0 vs 5.7%,P=0.02)。2组孕妇均未出现子痫、胎膜早破、产后出血等现象;2组婴儿在早产率、身长、体质量、Apgar评分方面差异均无统计学意义(P值均>0.05)。结论在新生儿接受主被动免疫的基础上,如在孕晚期对高病毒载量孕妇进行抗病毒干预,可显著提高HBV母婴阻断率,达到HBV母婴零传播,且新生儿的短期安全性良好。
肝炎病毒, 乙型; 母婴传播; 替比夫定; 孕妇
母婴传播是HBV最常见的传播途径,占慢性感染者的50%~60%[1],因此阻断母婴传播对于控制HBV感染至关重要。乙型肝炎疫苗联合乙型肝炎免疫球蛋白对HBsAg阳性母亲分娩的婴儿进行主被动免疫能显著降低HBV感染率,但仍有2%~5%的婴儿免疫阻断失败[2-4],其中病毒载量>108拷贝/ml(亚太地区肝病学会慢性乙型肝炎治疗共识2008版[5]:2×103IU/ml=1×104拷贝/ml)的孕妇所生婴儿的阻断失败率甚至可以高达10%[6]。由于孕妇分娩时高病毒载量是母婴传播最主要的危险因素,因此分娩前降低病毒载量将是进一步提高母婴阻断率的有效措施[7-8]。
目前可用于妊娠期抗病毒的药物有替诺福韦、替比夫定和拉米夫定,替诺福韦和替比夫定为美国食品药物监督管理局规定妊娠分级B类药,拉米夫定为C类药,其中替比夫定因其抗病毒作用强、起效快、安全性好已成为目前国内最常用的孕期抗病毒药物。本研究募集高病毒载量(HBV DNA≥2×106IU/ml)孕妇,根据孕妇的意愿,部分孕妇在妊娠晚期接受口服替比夫定抗病毒治疗,所有新生儿均给予常规主被动免疫,观察HBV阻断成功率和母婴双方的安全性。
1 资料与方法
1.1 研究对象 募集2012年7月-2015年6月在吉林大学第一医院肝胆胰内科母婴传播阻断门诊接受母婴阻断的HBsAg和HBeAg均阳性,且HBV DNA≥2×106IU/ml的孕妇及其分娩的婴儿。孕妇的排除标准:(1)孕期接受抗病毒或者免疫调节治疗;(2)ALT≥2倍正常值上限(ULN);(3)合并其他病毒感染;(4)有任何免疫缺陷情况。向孕妇及家属交代目前临床常用的HBV母婴传播阻断方案,在婴儿接受主被动免疫基础上,HBV DNA≥2×106IU/ml的孕妇可以选择孕期抗病毒治疗,详细讲解抗病毒药物的相关事宜,按孕妇是否同意孕晚期服用替比夫定将其分为2组:婴儿接受主被动免疫阻断+孕妇孕晚期服用替比夫定组(替比夫定组),只接受婴儿主被动免疫阻断组(免疫阻断组),具体流程见图1。本研究获得吉林大学第一医院医学伦理委员会批准,患者均签署了知情同意书。

图1 研究流程图
1.2 研究方法 替比夫定组孕妇在妊娠32周开始口服替比夫定(600 mg,1次/d,口服),至分娩时停药;免疫阻断组孕妇孕期不接受任何抗病毒治疗。所有婴儿出生后2 h内不同部位同时接受重组酵母乙型肝炎疫苗(大连汉信生物制药有限公司,20 μg)和乙型肝炎免疫球蛋白(华兰生物制品有限公司,100单位)注射,1个月和6个月时各注射乙型肝炎疫苗(20 μg)1次。
1.3 实验室检查 孕妇在孕32周采集静脉血,婴儿在出生后7个月随访时采集静脉血。检测乙型肝炎血清标志物,包括HBsAg、抗-HBs、HBeAg、抗-HBe和抗-HBc(化学发光微粒子免疫分析,Abbott ARCHITECT i2000SR,购自美国雅培公司)、HBV DNA载量(罗氏Tagman HBV DNA检测,购自德国罗氏诊断公司)和肝功能(LXH20同步自动分析仪,购自美国克曼库尔特公司)。所有检测均在吉林大学第一医院检验科进行。
1.4 数据收集 通过调查问卷形式收集孕妇相关信息,问卷内容主要包括社会人口数据和既往抗病毒治疗等情况。对于在本院出生的新生儿,通过查阅病例资料获取相关信息;对于在其他医院出生的新生儿,分娩后通过4次电话随访(24 h、14 d、1个月和6个月)来获得相关信息,包括分娩方式、喂养方式、婴儿性别、婴儿体质量、胎龄、Apgar评分、乙型肝炎疫苗接种时间、剂量及疫苗注射后的安全性事件等信息,替比夫定组同时收集孕妇服药及停药时间、停药后复查情况和有无合并症等信息。在新生儿7月龄采血时再次核对母婴阻断手册上记录的乙型肝炎孕妇生产信息及新生儿出生情况和疫苗接种情况以保证数据真实可靠。
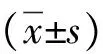
2 结果
2.1 一般资料 符合纳入标准研究对象534例,至新生儿7月龄时,免疫阻断组87例母亲及其新生儿失访,替比夫定组无人失访,失访率为16.3%;共447例纳入分析,其中替比夫定组孕妇81例,分娩新生儿81例;免疫阻断组孕妇366例,分娩新生儿370例(4例双胞胎)。替比夫定组孕妇的平均年龄高于免疫阻断组(t=-2.55,P=0.01);替比夫定组病毒载量≥108log10IU/ml的孕妇所占比例高于免疫阻断组(χ2=13.21,P<0.01)。2组孕妇在ALT水平方面差异无统计学意义(P=0.22);在采用的分娩方式和喂养方式上差异均无统计学意义(P值均>0.05);2组分娩男婴和女婴比例相近(P=0.84)(表1)。
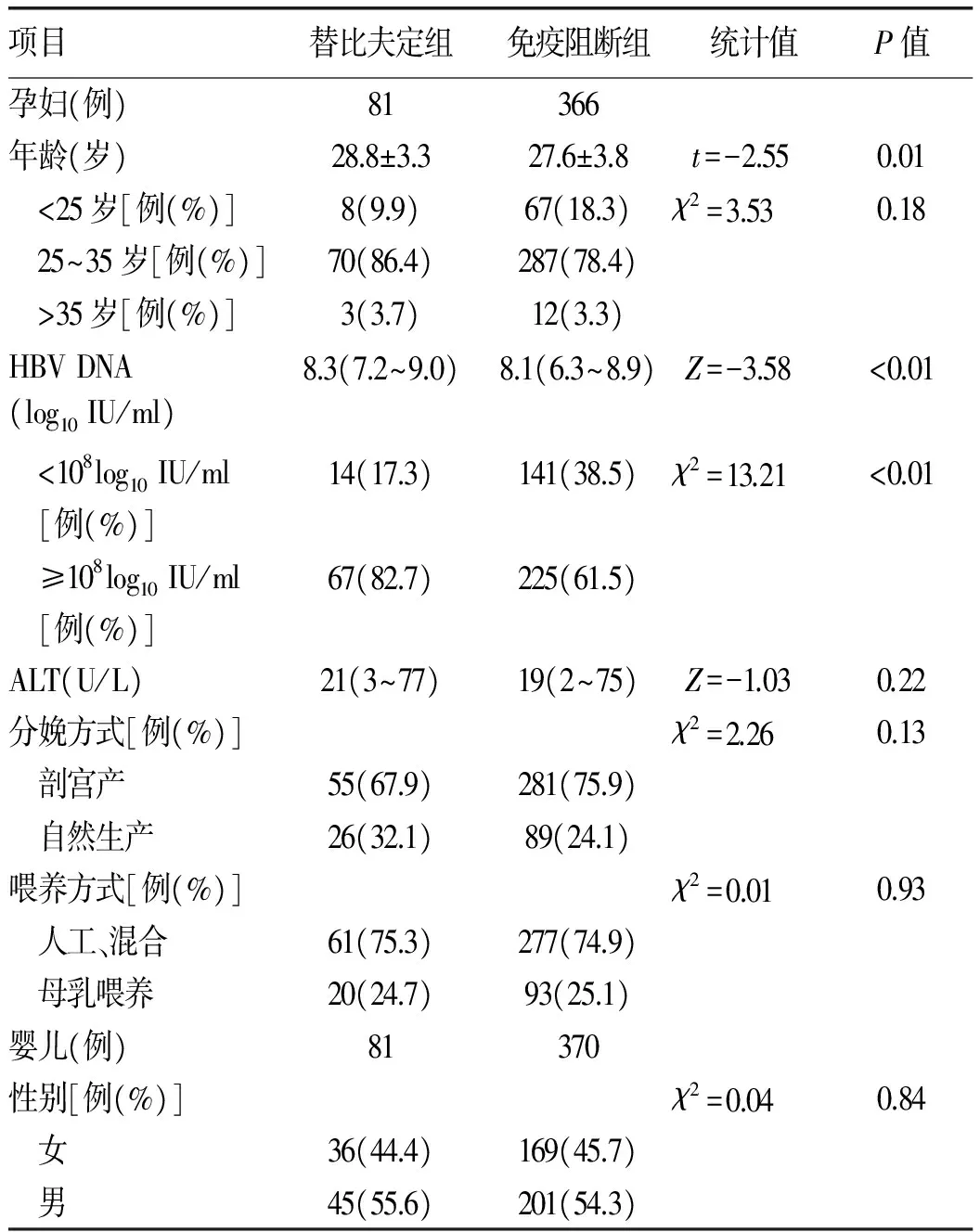
表1 2组孕妇和婴儿一般资料比较
2.2 2组婴儿7月龄时HBsAg阳性率 替比夫定组婴儿81例,在7月龄时无HBsAg阳性者;免疫阻断组婴儿370例,在7月龄时HBsAg阳性者21例,阳性率为5.7%。2组比较差异具有统计学意义(P=0.02)。免疫阻断组中,7月龄时HBsAg阳性婴儿的母亲,孕32周HBV DNA载量均>4.3×107IU/ml,HBV DNA水平高于HBsAg阴性婴儿的母亲(Z=-3.05,P=0.01)(表2)。
2.3 2组的母婴安全性比较 2组产妇均未出现子痫、胎膜早破和产后出血等现象;替比夫定组22例(27.2%)产妇在停药后遵守医嘱定期复查肝功能,其中有3例在停药后7个月出现ALT高于正常值现象,未给予治疗,1年后随访均降至正常范围内。2组婴儿身长、体质量、Apgar评分和早产率差异均无统计学意义(P值均>0.05)(表3)。
3 讨论
我国自1992年将乙型肝炎疫苗初步纳入计划免疫管理,并于2002年开始乙型肝炎疫苗免费后,1~4岁婴幼儿HBsAg流行率大幅度下降,由1992年的9.7%降至2006年的0.96%[9-10]。2006年起乙型肝炎疫苗计划免疫工作进一步推进,正式纳入免疫规划,免费接种并强化新生儿出生后24 h内及时乙型肝炎疫苗注射,至2014年,1~4岁婴幼儿HBsAg流行率降至0.32%[11]。有研究[12]显示采用20 μg重组乙型肝炎疫苗后母婴阻断率达到96.0%,高于10 μg组的93.9%。另一项研究[13]显示采用20 μg剂量的婴儿9月龄时测定平均抗-HBs几何滴度高于10 μg剂量组,至儿童6岁时,高剂量组平均抗体水平高于低剂量组。以上结果提示高剂量重组乙型肝炎疫苗组的母婴阻断率及产生的保护性抗体水平高于低剂量组,因此20 μg重组乙型肝炎疫苗对于HBeAg阳性的高危孕妇所生婴儿更具有保护作用。乙型肝炎疫苗注射对控制HBV传播发挥了极其重要的作用,但乙型肝炎疫苗联合乙型肝炎免疫球蛋白的主被动免疫并不能完全阻断乙型肝炎的母婴传播,仍有0.32%新生儿感染HBV。新生儿HBV感染均为母婴传播,其中HBV DNA水平是母婴传播最重要的危险因素。在婴儿接受主被动免疫前提下,母婴传播率随着孕妇HBV DNA水平升高而增高,母亲HBV DNA载量为106~107拷贝/ml的母婴传播率为3%,HBV DNA载量为107~108拷贝/ml的母婴传播率为7%,HBV DNA载量>108拷贝/ml的母婴传播率为8%[14]。另有研究[15]报道了HBV DNA载量<106拷贝/ml母亲分娩的新生儿在接受主被动免疫后,无1例发生HBV感染。本课题组的前期研究[16]也发现,所有母婴阻断失败案例其母亲HBV DNA载量均>4.3×107IU/ml,因此分娩前快速降低HBV DNA水平将是进一步提高母婴阻断率的有效方法。我国《慢性乙型肝炎防治指南(2015年更新版)》[11]建议HBV DNA载量>2×106IU/ml孕妇在充分沟通、知情同意的基础上可给予抗病毒治疗。因此,临床上考虑对于HBV DNA载量>2×106IU/ml的乙型肝炎孕妇应用替比夫定等药物,进行以阻断乙型肝炎母婴传播为目的的抗病毒治疗。
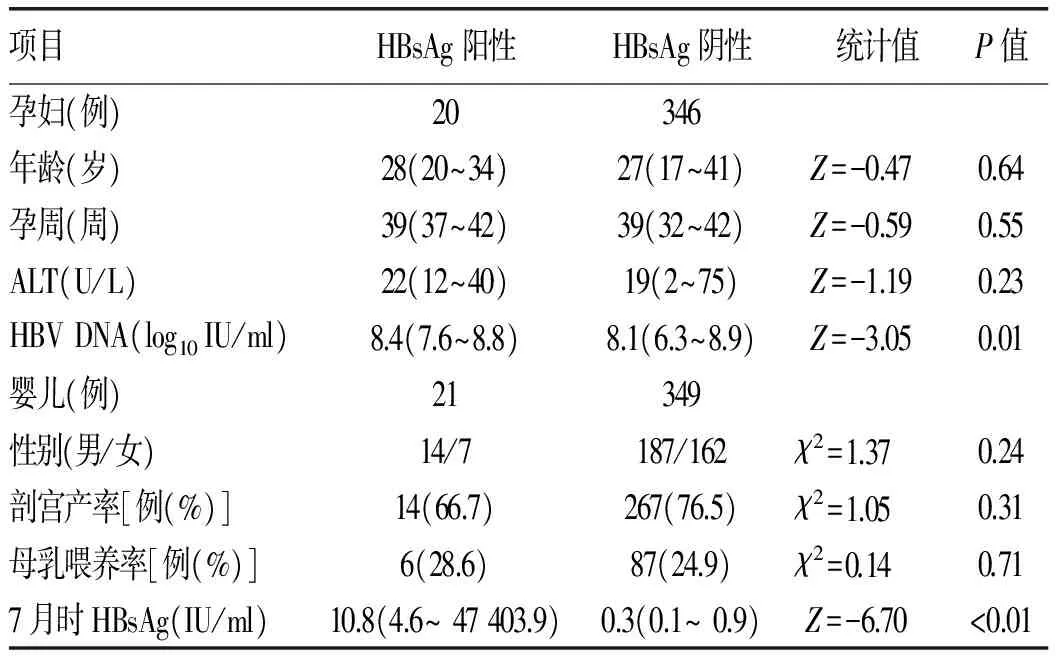
表2 免疫阻断组母亲及其婴儿基本资料

表3 2组婴儿出生数据比较
替比夫定目前是中国批准上市的治疗乙型肝炎的妊娠B级药物[17]。替比夫定的抗病毒效果强,孕晚期用药12周就可以将母亲血清HBV DNA载量平均降低3~4 log10[18-19]。我国《慢性乙型肝炎防治指南(2015年更新版)》[11]建议免疫耐受期妊娠患者24~28周开始服用抗病毒药物,虽然目前的研究尚未发现其对于胎儿的不良影响,但是胎儿暴露于药物时间越长,安全性风险必将越大,而对于服用替比夫定的孕妇停药时间,目前尚有争论。因此,本研究选择在孕晚期32周进行抗病毒治疗至分娩日停药是为确保胎儿安全的同时,评估短时间服用(8周左右)替比夫定对母婴阻断的效果,同时支持母乳喂养。在本研究中,由于未收集分娩前孕妇血液样本,不能检测分娩前孕妇HBV DNA水平,无法直接评价替比夫定的抗病毒效果。但结果显示,替比夫定组孕妇孕晚期服用替比夫定8~9周,81例婴儿均阻断成功,可以推测分娩前所有孕妇的HBV DNA载量均降至106IU/ml以下。而仅接受主被动免疫未进行抗病毒治疗组,370例婴儿中有21例(5.7%)发生感染,其母亲HBV DNA载量均在4.3×107IU/ml以上,因此孕晚期替比夫定抗病毒干预可以显著提高母婴阻断率,甚至可以达到零传播。此项结论在另外2项国内临床研究中亦获得证实,在Zhang等[18]的研究中,648例高病毒载量孕妇在孕28周到产后4周随机接受16周左右的拉米夫定、替比夫定或者安慰剂治疗,接受抗病毒治疗组婴儿阻断失败率0,安慰剂组是2.84%;在另一项研究[20]中,52例孕妇在孕中期或孕晚期(孕12~30周)开始服用替比夫定,分娩后停药,替比夫定治疗组的母婴传播率为0,安慰剂组则为8.6%。本研究中,全部接受抗病毒治疗的孕妇其HBV DNA载量均在1.72×107IU/ml以上,虽然孕妇平均抗病毒时间仅为8.5周,用药时间短于国内研究的产前用药时间(平均12周),也取得了100%的阻断成功率。说明产前短期服用替比夫定,同时联合新生儿主被动免疫后,也有望完全阻断HBV母婴传播。但本研究样本量较少,还需增加样本从而进一步验证。
在孕晚期采用替比夫定阻断母婴传播的安全性方面,主要关注对新生儿生长发育的影响以及停药对母亲的影响。在动物研究[21]中,将人类治疗剂量的6~37倍替比夫定给予兔子或大鼠时,并未发现致癌性和致畸性,证明了替比夫定对于胚胎的安全性。其他毒理学研究[22-23]也表明,替比夫定没有致癌、致畸或致突变作用,没有线粒体毒性。本研究结果显示,对于婴儿的影响方面,2组婴儿均无畸形,在早产率、身长、体质量和Apgar评分差异方面均无统计学意义,说明孕期母亲应用替比夫定对婴儿短期安全无影响。一项包括1725例应用替比夫定孕妇的荟萃分析[24]发现新生儿胚胎毒性、自发流产和出生缺陷率均未见增加。本研究由于随访时间尚短,替比夫定是否对婴儿的发育存在长期潜在的影响尚不确定。在一项为期5年的随访研究[25]中,孕期应用替比夫定的母亲生育的儿童,未发现在生长发育和智力方面受到影响。在产妇方面,替比夫定组与免疫阻断组均无子痫、胎膜早破及产后出血等现象发生;替比夫定组产妇中,22例停药后复查肝功能,其中有3例在停药后7个月出现ALT高于正常值现象,由于本研究对产后定期复查肝功能的依从性较差,仅有27.2%产妇进行复查,以致难于全面评价分娩时停药对产妇肝脏状况的影响,因此今后研究中需要加强对产妇随访的监控。
综上,高病毒载量孕妇,婴儿在给予主被动免疫的基础上,在孕晚期对孕妇进行抗病毒干预,可显著提高乙型肝炎母婴阻断率,达到母婴零传播,并且新生儿的短期安全性良好。
[1] BEASLEY RP, HWANG LY, LIN CC, et al. Hepatocellular carcinoma and hepatitis B virus. A prospective study of 22 707 men in Taiwan[J]. Lancet, 1981, 2(8256): 1129.
[2] MA L, ALLA NR, LI X, et al. Mother-to-child transmission of HBV: review of current clinical management and prevention strategies[J]. Rev Med Virol, 2014, 24(6): 396-406.
[3] ORLANDO R, FOGGIA M, MARAOLO AE. Prevention of hepatitis B virus infection: from the past to the future[J]. Eur J Clin Microbiol Infect Dis, 2015, 34(6): 1059-1070.
[4] ZHOU YH, HU YL. Achievements and challenges in the prevention of mother-to-child transmission of hepatitis B virus in China[J]. Natl Med J China, 2015, 95(1): 15-18. (in Chinese) 周乙华, 胡娅莉. 我国预防乙型肝炎病毒母婴传播的成就和挑战[J]. 中华医学杂志, 2015, 95(1): 15-18.
[5] DEL CR, GROSHEIDE PM, MAZEL JA, et al. Ten-year neonatal hepatitis B vaccination program, The Netherlands, 1982-1992: protective efficacy and long-term immunogenicity[J]. Vaccine, 1997, 15(15): 1624-1630.
[6] CHEN J, JIA JD. Guided reading of 2008 Asian-Pacific consensus statement on the management of chronic hepatitis B[J]. Infect Dis Inform, 2008, 21(4): 193-195. (in Chinese) 陈杰, 贾继东. 亚太地区肝病学会2008年《慢性乙型肝炎治疗共识》导读[J]. 传染病信息, 2008, 21(4): 193-195.
[7] CHEN HL, LIN LH, HU FC, et al. Effects of maternal screening and universal immunizationto prevent mother-to-infant transmission of HBV[J]. Gastroenterology, 2012, 142 (142): 773-781.
[8] YANG M, LIU YX. New progress of the influencefactors of mother-to-child transmission of chronic hepatitis B[J/CD]. Chin J Liver Dis: Electronic Edition, 2016, 10(3): 265-268. (in Chinese) 杨敏, 刘映霞. 慢性乙型肝炎母婴传播的影响因素新进展[J/CD]. 中华实验和临床感染病杂志: 电子版, 2016, 10(3): 265-268.
[9] LIANG X, BI S, YANG W, et al. Epidemiological serosurvey of hepatitis B in China——declining HBV prevalence due to hepatitis B vaccination[J]. Vaccine, 2009, 27(47): 6550-6557.
[10] LIANG X, BI S, YANG W, et al. Evaluation of the impact of hepatitis B vaccination amon children born during 1992-2005 in China[J]. J Infect Dis, 2009, 200(1): 39-47.
[11] Chinese Society of Hepatology and Chinese Society of Infectious Diseases,Chinese Medical Association.The guideline of prevention and treatment for chronic hepatitis B: a 2015 update [J]. J Clin Hepatol, 2015, 31(12): 1941-1960. (in Chinese) 中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2015年新版) [J]. 临床肝胆病杂志, 2015, 31(12): 1941-1960.
[12] HALLIDAY ML, KANG LY, RANKIN JG, et al. An efficacy trial of a mammalian cell-derived recombinant DNA hepatitis B vaccine in infants born to mothers positive for HBsAg, in Shanghai, China[J]. Int J Epidemiol, 1992, 21(3): 564-573.
[13] STEVENS CE, TOY PT, TAYLOR PE, et al. Prospects for control of hepatitis B virus infection: implications of childhood vaccination and long-term protection[J]. Pediatrics, 1992, 90(12): 170-173.
[14] ZOU H, CHEN Y, DUAN Z, et al. Virologic factors associated with failure to passive-active immunoprophylaxis in infants born to HBsAg-positive mothers[J]. J Viral Hepat, 2012, 19(2):18-25.
[15] GODBOLE G, IRISH D, BASARAB M, et al. Management of hepatitis B in pregnant women and infants: a multicentre audit from four London hospitals[J]. BMC Pregnancy Childbirth, 2013, 13: 222.
[16] WANG C, WANG C, JIA ZF, et al. Protective effect of an improved immunization practice of mother-to-infant transmission of hepatitis B virus and risk factors associated with immunoprophylaxis failure[J]. Medicine, 2016, 95(34): e4390.
[17] DENG Y, WU WX, ZHANG DZ, et al. The saty of telbivudine in preventing mother-to-infant transmission of hepatitis B virus in pregnant women after discontinuation[J]. Chin J Hepatol, 2015, 23(8): 586-589. (in Chinese) 邓勇, 吴维新, 张大志, 等. 替比夫定阻断乙型肝炎病毒母婴传播停药后的安全性研究[J]. 中华肝脏病杂志, 2015, 23(8): 586-589.
[18] ZHANG H, PAN CQ, PANG Q, et al. Telbivudine or lamivudine use in late pregnancy safely reduces perinatal transmission of hepatitis B virus in real-life practice[J]. Hepatology, 2014, 60(2): 468-474.
[19] HAN GR, JIANG HX, YUE X, et al. Efficacy and safety of telbivudine treatment: an open-label, prospective study in pregnant women for the prevention of perinatal transmission of hepatitis B virus infection[J]. J Viral Hepat, 2015, 22(9): 754-762.
[20] PAN CQ, HAN GR, JIANG HX, et al. Telbivudine prevents vertical transmission from HBeAg-positive women with chronic hepatitis B[J]. Clin Gastroenterol Hepatol, 2012, 10(5): 520-526.
[21] BRIDGES EG, SELDEN JR, LUO S. Nonclinical safety profile of telbivudine, a novel potent antiviral agent for treatment of hepatitis B[J]. Antimicrob Agents Chemother, 2008, 52(7): 2521-2528.
[22] DIENSTAG J, EASLEY C, KIRKPATRICK P. Telbivudine[J]. Nat Rev Drug Discov, 2007, 6(4): 267-268.
[23] RUIZ-SANCHO A, SHELDON J, SORIANO V. Telbivudine: a new option for the treatment of chronic hepatitis B[J]. Expert Opin Biol Ther, 2007, 7(5): 751-761.
[24] PIRATVISUTH T, GUO RH, POL S, et al. Comprehensive review of telbivudine in pregnant women with chronic hepatitis B[J]. World J Hepatol, 2016, 8(9): 452.
[25] ZHOU YJ, ZHENG JL, PAN HJ, et al. Long-term efficacy and safety of telbivudine in the treatment of childbearing patients with chronic hepatitis B[J]. Chin J Hepatol, 2014, 22(8): 573-576. (in Chinese) 周岳进, 郑金莉, 潘华将, 等. 替比夫定治疗妊娠慢性乙型肝炎患者生育子女远期疗效与安全性[J]. 中华肝脏病杂志, 2014, 22(8): 573-576.
引证本文:PAN YC, WANG C, WEN SM, et al. Clinical effect and short-term safety of telbivudine in blocking mother-to-child transmission of HBV[J]. J Clin Hepatol, 2017, 33(9): 1707-1712. (in Chinese) 潘禹辰, 王崇, 文思敏, 等. 替比夫定阻断HBV母婴传播的效果和短期安全性[J]. 临床肝胆病杂志, 2017, 33(9): 1707-1712.
(本文编辑:王 莹)
Clinicaleffectandshort-termsafetyoftelbivudineinblockingmother-to-childtransmissionofHBV
PANYuchen,WANGChong,WENSimin,etal.
(ResearchCenterofClinicalEpidemiology,TheFirstHospitalofJilinUniversity,Changchun130021,China)
ObjectiveTo evaluate the clinical effect and short-term safety of telbivudine administered in late pregnancy for blocking mother-to-child transmission of HBV in pregnant women with high HBV DNA load.MethodsPregnant women with positive HBsAg and HBeAg and HBV DNA ≥2×106IU/ml who underwent blockade of mother-to-child transmission in The First Hospital of Jilin University from July 2012 to June 2015 were enrolled. These patients were informed of current methods for blocking mother-to-child transmission of hepatitis B, and according to their own will, they were divided into active/passive immunization+telbivudine (telbivudine group) and active/passive immunization group (immunization group). The patients in the telbivudine group were given oral telbivudine (600 mg, once a day) from week 32 of pregnancy to delivery, and those in the immunization group were not given antiviral therapy. The infants in both groups were given 20 μg hepatitis B vaccine combined with 100 IU hepatitis B immunoglobulin after birth. Positive HBsAg in infants at an age of 7 months was defined as failed blockade of mother-to-child transmission. Thet-test was used for comparison of normally distributed continuous data between groups, and the Wilcoxon rank sun test was used for comparison of non-normally distributed continuous data between groups; the chi-square test or the Fisher′s exact test was used for comparison of categorical data between groups.ResultsA total of 447 pregnant women were enrolled, and there were 81 pregnant women in the telbivudine group and 366 women in the immunization group. Compared with the immunization group, the telbivudine group had a significantly higher mean age (28.8±3.3 years vs 27.6±3.8 years,t=-2.55,P=0.01) and a significantly higher proportion of pregnant women with HBV DNA load >108IU/ml (82.7% vs 61.5%,χ2=13.21,P<0.001). There were no significant differences in alanine aminotransferase level, delivery mode, and feeding pattern between the two groups (allP>0.05). No infants in the telbivudine group had positive HBsAg at an age of 7 months, while among the 370 infants in the immunization group, 21 had positive HBsAg; there was a significant difference in positive rate between the two groups (0 vs 5.7%,P=0.02). No women experienced eclampsia, premature rupture of membranes, or postpartum bleeding, and there were no significant differences between the two groups of infants in premature birth rate, body length, body weight, and Apgar score (allP>0.05).ConclusionIn addition to active and passive immunization for neonates, antiviral therapy for pregnant women with a high viral load in late pregnancy can significantly improve the blocking rate of mother-to-child transmission of HBV and achieve no mother-to-child transmission of hepatitis B, and the neonates have good short-term safety.
hepatitis B virus; mother-to-child transmission; telbivudine; pregnant women
10.3969/j.issn.1001-5256.2017.09.015
2017-05-12;
2017-07-13。
十二五国家科技重大专项课题子课题(2012ZX10002001-001);吉林省卫生计生科研计划(20152003);中国肝炎防治基金会-天晴肝病基金资助课题(TQGB 20140137)
潘禹辰(1992-),女,主要从事分子流行病学方面的研究;王崇(1981-),女,主治医师,主要从事肝病的临床研究。二者对本文贡献相同,同为第一作者。
牛俊奇,电子信箱:junqiniu@aliyun.com; 姜晶,电子信箱:jiangjing19702000@jlu.edu.cn。
R512.62
:A
:1001-5256(2017)09-1707-06
——以《推销员之死》对话选段为例

