miR-451a过表达对宫颈癌细胞增殖和凋亡的影响及其分子机制
张茂娜,张 弘,张 军,张 雷
(1武汉大学人民医院鄂州医院病理科,鄂州 436000;2郑州大学附属河南省人民医院病理科;*通讯作者,E-mail:zmn0306@126.com)
miR-451a过表达对宫颈癌细胞增殖和凋亡的影响及其分子机制
张茂娜1*,张 弘1,张 军1,张 雷2
(1武汉大学人民医院鄂州医院病理科,鄂州 436000;2郑州大学附属河南省人民医院病理科;*通讯作者,E-mail:zmn0306@126.com)
目的 观察过表达miR-451a对宫颈癌细胞株SiHa和C33A增殖和凋亡的影响,探讨其分子机制。 方法 以宫颈癌细胞株SiHa和C33A为研究对象,分为miR-NC组(脂质体转染miR-NC)和miR-451a组(脂质体转染miR-451a模拟物),qPCR检测转染48 h各组细胞miR-451a、巨噬细胞移动抑制因子(MIF)和钙结合蛋白39(CAB39)mRNA的表达,Western blotting检测各组细胞MIF、CAB39、p-PI3K和p-AKT蛋白的表达,流式细胞术检测细胞周期和细胞凋亡,MTT法和平板克隆实验检测细胞增殖能力。 结果 与miR-NC组相比,miR-451a组SiHa和C33A细胞中miR-451a表达均显著增加(P<0.01),MIF和CAB39 mRNA及蛋白表达显著减少,CAB39下游蛋白p-PI3K和p-AKT表达下调。miR-451a组细胞周期进展被显著抑制(P<0.05),细胞凋亡明显增加(P<0.05),细胞的增殖能力显著下降(P<0.05)。 结论 过表达miR-451a能够抑制宫颈癌细胞株的增殖,促进细胞凋亡,其机制可能与下调MIF、CAB39蛋白的表达有关。
微小RNA-451a; 宫颈癌; 细胞增殖; 细胞凋亡
宫颈癌是女性最常见的肿瘤之一,也是女性死亡率最高的肿瘤之一[1]。人乳头瘤病毒(HPV)是宫颈癌主要的危险因素,与90%以上宫颈癌的发生密切相关,但不可否认的是癌基因和抑癌基因的异常表达对宫颈癌的发生至关重要[2]。近年来宫颈癌的治疗方面有了很大的进步,仍有很多宫颈癌患者的预后并不理想。通过miRNA干扰基因表达模式的靶向治疗日益成为宫颈癌研究的新方向[3]。miR-451a是一种新发现的在结肠癌、胃癌、食管癌等多种肿瘤中具有抑癌作用的miRNA[4-6]。然而,miR-451a在宫颈癌中的研究未见报道。本研究以宫颈癌细胞株SiHa和C33A为细胞模型,探讨miR-451a对宫颈癌细胞增殖和凋亡的影响及可能的分子机制,为宫颈癌的防治提供新的治疗策略。
1 材料与方法
1.1 细胞株及主要试剂
表1qPCR引物序列
Table1TheqPCRprimersequence
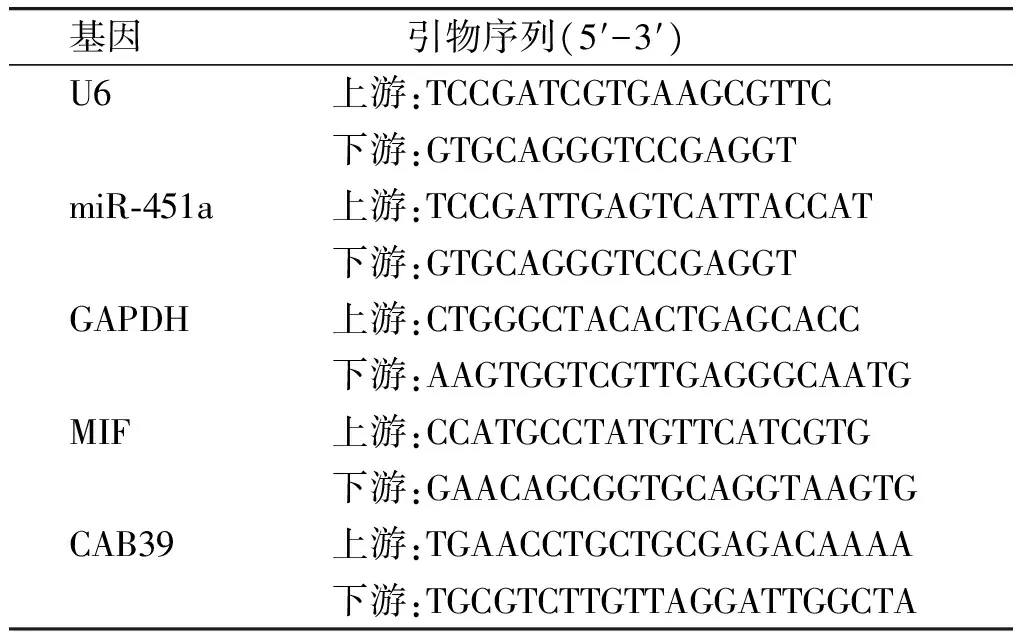
基因 引物序列(5′-3′) U6上游:TCCGATCGTGAAGCGTTC下游:GTGCAGGGTCCGAGGT miR⁃451a上游:TCCGATTGAGTCATTACCAT下游:GTGCAGGGTCCGAGGT GAPDH上游:CTGGGCTACACTGAGCACC下游:AAGTGGTCGTTGAGGGCAATG MIF上游:CCATGCCTATGTTCATCGTG下游:GAACAGCGGTGCAGGTAAGTG CAB39上游:TGAACCTGCTGCGAGACAAAA下游:TGCGTCTTGTTAGGATTGGCTA
1.2 miR-451a靶基因预测
本研究选择microRNA.org、miRecords和PicTar 3种预测网站及参考文献[7,8]预测miR-451a可能的靶基因。miR-451a与MIF mirSVR评分为-1.076 9,PhastCons评分为0.488 9;miR-451a与CAB39 mirSVR评分为-0.577 7,PhastCons评分为0.688 7;miR-451a可能的靶基因为MIF和CAB39,具体的序列互补区域(见图1)。
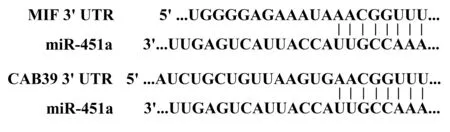
图1 miR-451a与MIF、CAB39基因序列互补区域Figure 1 Complementary regions of miR-451a with gene sequence of MIF and CAB39
1.3 细胞培养与转染
SiHa和C33A细胞株培养于含10%胎牛血清的RPMI-1640培养基中,在37 ℃、5% CO2饱和湿度培养,取对数生长期细胞,随机将细胞分为miR-NC组(转染miR-NC)和miR-451a组(转染miR-451a)。转染操作按照LipofectamineTM3000说明书进行,转染6 h更换新鲜培养基,转染48 h进行后续实验。
1.4 qPCR检测miR-451a、MIF和CAB39 mRNA相对表达量
提取各组细胞总RNA,逆转录后进行qPCR检测。miRNA检测以U6为内参,mRNA检测以GAPDH为内参。反应体系和条件参照qPCR试剂盒进行操作,Ct值均以2-ΔΔCt分析比较各组miRNA或mRNA表达差异。
微课由于可以在线或者下载到播放终端让学生自主进行观看,那么观看微课就可以不受时间和空间的限制,即不用在固定的时间或空间由教师亲自面授.微课的这个特点就使学生可以在课外的任何时间进行观看学习,这样的观看学习是学生自主进行的,没有教师和家长的督促和监督,这样的学习形式在一定程度上培养了学生自主学习的意识和能力.
1.5 Western blotting检测目的蛋白的表达
细胞转染48 h后,提取细胞总蛋白,测定蛋白浓度,分别取适量蛋白样品进行聚丙烯酰氨凝胶电泳(SDS-PAGE),电转至硝酸纤维膜上,5%脱脂牛奶室温封闭,一抗4 ℃孵育过夜,二抗室温孵育2 h,化学发光法显影。
1.6 流式细胞术检测细胞凋亡
胰酶溶液消化收集细胞,70%乙醇固定4 ℃过夜,弃上清,50 μg/ml RNAse A溶液重悬,室温下放置1 h,溴化丙啶染液4 ℃下避光孵育30 min,流式细胞仪检测细胞周期。细胞凋亡分析根据Annexin V-FITC/PI细胞凋亡检测试剂盒说明书进行操作。
1.7 MTT法检测细胞增殖
在96孔板上以3×103个/孔接种转染后的细胞,分别于第1,2,3,4,5天检测细胞增殖情况。具体操作为:在每个时间点,每孔加入20 μl MTT,继续培养4 h,弃上清,加入150 μl二甲基亚砜振荡15 min。酶标仪检测波长在490 nm处的吸光值。
1.8 平板克隆实验检测细胞增殖能力
在6孔板上以1×103个/孔接种转染后的细胞,于培养箱内培养10 d。取出后采用甲醇固定10 min,结晶紫染液染色30 min,洗去染色,倒置显微镜下随机选取6个视野计数,取平均值进行统计学分析。
1.9 统计学分析
实验数据均以均数±标准差表示,组间比较采用t检验,所有数据均在SPSS18.0统计软件中进行统计。P<0.05表示差异有统计学意义。
2 结果
2.1 miR-451a转染效率测定及各组细胞中MIF和CAB39 mRNA的表达
miR-NC组和miR-451a组SiHa细胞中miR-451a相对表达量分别为1.09±0.52和8 223.46±1 324.91(t=12.410,P<0.001),C33A细胞miR-451a相对表达量分别为1.04±0.33和10 930.67±3 302.61(t=6.619,P=0.001)。与miR-NC组相比,miR-451a组细胞中MIF和CAB39 mRNA的表达显著下降(见表2)。


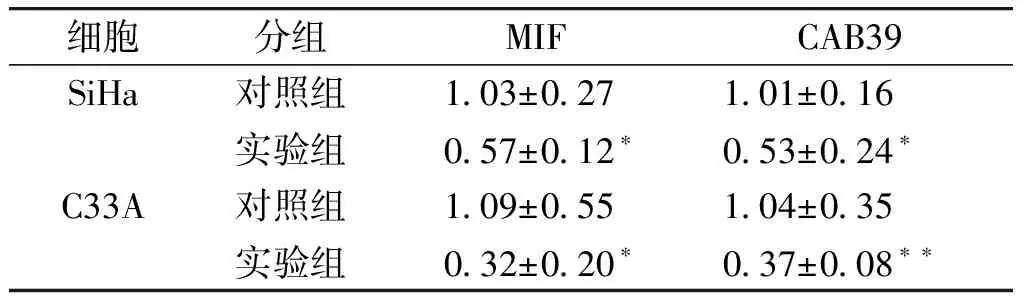
细胞分组MIFCAB39SiHa对照组 103±027 101±016实验组 057±012∗ 053±024∗C33A对照组 109±055 104±035实验组 032±020∗ 037±008∗∗
与对照组比较,*P<0.05,**P<0.01
2.2 过表达miR-451a对靶蛋白表达的影响
Western blotting结果显示,与miR-NC组相比,转染miR-451a后,MIF和CAB39蛋白的表达水平显著降低,CAB39下游蛋白p-PI3K和p-AKT表达明显下调(见图2)。
2.3 过表达miR-451a对细胞周期和细胞凋亡的影响
与miR-NC组相比,miR-451a组细胞在S期和G2/M期的比例明显下降,G0/G1期细胞的比例显著增加(P<0.05,见表3),提示细胞被阻滞在G0/G1期。miR-NC组和miR-451a组SiHa细胞凋亡率分别为6.72%±0.87%和26.07%±7.22%(t=5.327,P=0.002),C33A细胞凋亡率分别为8.13%±1.67%和17.77%±2.42%(t=6.560,P=0.001),过表达miR-451a显著促进宫颈癌细胞的凋亡。
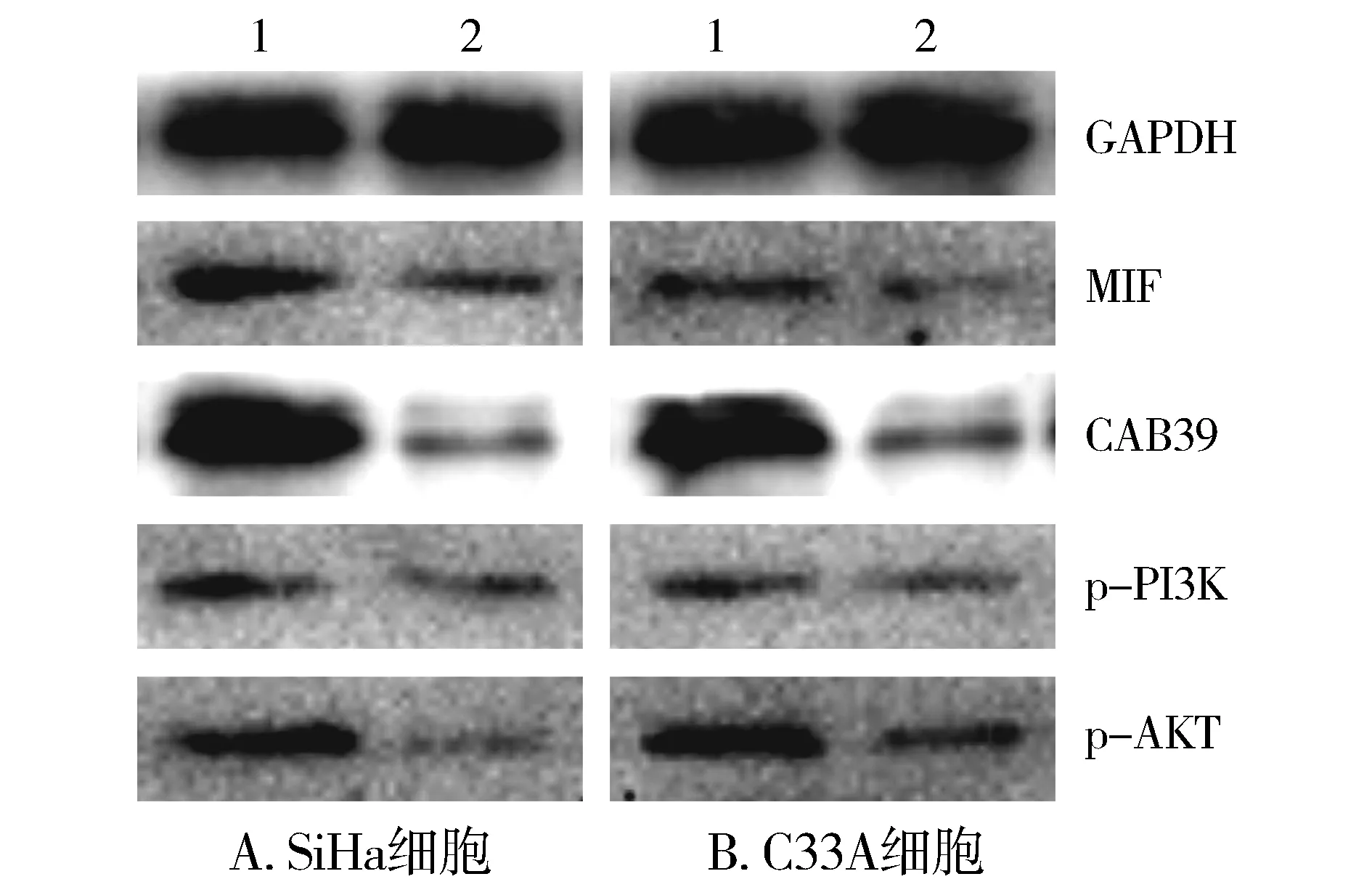
1.miR-NC组;2.miR-451a组图2 过表达miR-451a对靶蛋白及下游蛋白的影响Figure 2 Effect of miR-451a overexpression on target protein and downstream protein
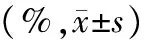

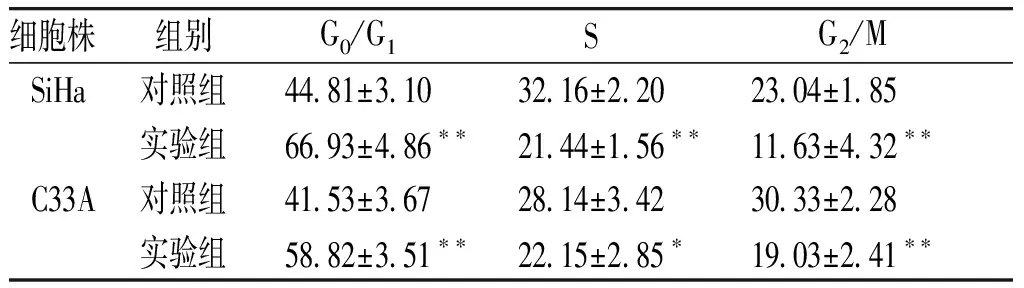
细胞株组别 G0/G1 SG2/MSiHa对照组4481±3103216±2202304±185实验组6693±486∗∗2144±156∗∗1163±432∗∗C33A对照组4153±3672814±3423033±228实验组5882±351∗∗2215±285∗1903±241∗∗
与对照组比较,*P<0.05,**P<0.01
2.4 过表达miR-451a对细胞增殖的影响
MTT检测结果显示,与对照组相比,miR-451a组的细胞增殖能力明显降低(P<0.05,见图3)。

与miR-NC组相比,*P<0.05图3 过表达miR-451a对宫颈癌细胞增殖的影响Figure 3 Effect of miR-451a over expression on the proliferation of cervical cancer cells
2.5 过表达miR-451a对细胞克隆形成的影响
miR-NC组和miR-451a组SiHa细胞形成的克隆数分别为206.08±31.25和140.17±30.4(t=3.024,P=0.023),C33A细胞形成的克隆数分别为138.77±17.24和82.75±17.86(t=4.513,P=0.004)。与对照组相比,转染miR-451a后的宫颈癌细胞形成的克隆数明显减少(P<0.05)。
3 讨论
miRNA是一类长度约为22个核苷酸的小分子非编码RNA,主要通过与靶基因mRNA的3′UTR区域特异性结合,引起mRNA翻译抑制或直接导致其降解发挥干扰作用[9]。miRNA的低表达与多种肿瘤的发生发展密切相关,近年来,通过过表达miRNA治疗肿瘤的研究逐渐成为热点[10]。miR-451a是近年来研究较多的miRNA之一,已被证实与多种肿瘤的生物学行为密切相关,miR-451a可通过干扰Ywhaz基因的表达,调节FoxO3蛋白在胞核内的聚集,抑制结肠癌细胞的生长[4];miR-451a可作为胃癌潜在的预后标志物和肿瘤抑制因子[5];miR-451a可通过靶向作用于CDKN2D和MAP3K1,抑制食管癌细胞的增殖[6];miR-451a也可抑制肺癌细胞的增殖、迁移和侵袭[11];miR-451a亦可通过靶向干扰Bcl-2基因的表达,影响caspase3蛋白的表达,加速乳腺癌细胞的凋亡,改善乳腺癌细胞对紫杉醇的耐药性[12];miR-451a的表达水平与骨肉瘤的预后密切相关,通过靶向干扰CXCL16基因的表达,抑制骨肉瘤细胞的生长和侵袭[13]。miR-451a对宫颈癌生长的作用至今仍未明确。
巨噬细胞移动抑制因子(MIF)最早发现于活化的T淋巴细胞,MIF通过促进肿瘤细胞的增殖、分化、抑制p53依赖性的细胞凋亡,参与肿瘤的发生发展[14]。钙结合蛋白39(CAB39)参与PI3K/AKT信号通路的活化,最终导致PI3K和AKT的磷酸化,促进细胞周期的进展,抑制细胞凋亡[15]。CAB39在宫颈癌细胞中的研究尚未见文献报道。本研究显示,过表达miR-451a后,宫颈癌细胞中MIF和CAB39蛋白的表达水平显著下降,CAB39下游蛋白p-PI3K和p-AKT表达下调,引起宫颈癌细胞周期G1的阻滞和细胞凋亡的显著增加,导致宫颈癌细胞的增殖能力显著下降。以上现象提示miR-451a可能通过靶向干扰MIF和CAB39基因的表达,抑制宫颈癌细胞的增殖,促进细胞凋亡。MIF和CAB39基因与肿瘤细胞迁移和侵袭能力的获得密切相关[7,16],本研究下一步将重点关注miR-451a干扰MIF和CAB39基因表达后对宫颈癌细胞上皮间充质转化(EMT)过程的影响,探讨其可能的分子机制。同时,本研究也将通过收集临床宫颈癌组织表达,检测miR-451a的表达,研究其在诊疗及预后的生物标志物价值。
综上所述,过表达miR-451a后,宫颈癌细胞增殖能力显著下降,细胞凋亡明显增加,其可能的分子机制为miR-451a干扰MIF和CAB39蛋白的表达,这为临床治疗宫颈癌提供了新靶点。
[1] Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017[J]. CA Cancer J Clin,2017,67(1):7-30.
[2] Patadji S, Li Z, Pradhan D,etal. Significance of high-risk HPV detection in women with atypical glandular cells on Pap testing: Analysis of 1857 cases from an academic institution[J]. Cancer,2016, 125(3):205-211.
[3] Gonzalez-Quintana V, Palma-Berre L, Campos-Parra AD,etal. MicroRNAs are involved in cervical cancer development, progression, clinical outcome and improvement treatment response (Review)[J]. Oncol Rep,2016,35(1):3-12.
[4] Li Y, Wang J, Dai X,etal. miR-451 regulates FoxO3 nuclear accumulation through Ywhaz in human colorectal cancer[J]. Am J Transl Res,2015,7(12):2775-2785.
[5] Su Z, Zhao J, Rong Z,etal. MiR-451, a potential prognostic biomarker and tumor suppressor for gastric cancer[J]. Int J Clin Exp Pathol,2015,8(8):9154-9160.
[6] Zang WQ, Yang X, Wang T,etal. MiR-451 inhibits proliferation of esophageal carcinoma cell line EC9706 by targeting CDKN2D and MAP3K1[J]. World J Gastroenterol,2015,21(19):5867-5876.
[7] Guo R, Gu J, Zhang Z,etal. MiR-451 promotes cell proliferation and metastasis in pancreatic cancer through targeting CAB39[J]. Biomed Res Int,2017,2017:2381482.
[8] Liu W, Liu SY, He YB,etal. MiR-451 suppresses proliferation, migration and promotes apoptosis of the human osteosarcoma by targeting macrophage migration inhibitory factor[J]. Biomed Pharmacother,2017,87:621-627.
[9] Chitkara D, Mittal A, Mahato RI. miRNAs in pancreatic cancer: therapeutic potential, delivery challenges and strategies[J]. Adv Drug Deliv Rev,2015,81:34-52.
[10] Zhang LF, Jiang S, Liu MF. MicroRNA regulation and analytical methods in cancer cell metabolism[J]. Cell Mol Life Sci,2017, 74(16):2929-2941.
[11] Yin P, Peng R, Peng H,etal. MiR-451 suppresses cell proliferation and metastasis in A549 lung cancer cells[J]. Mol Biotechnol,2015,57(1):1-11.
[12] Gu X, Li JY, Guo J,etal. Influence of mir-451 on drug resistances of paclitaxel-resistant breast cancer cell line[J]. Med Sci Monit,2015,21:3291-3297.
[13] Zhang F, Huang W, Sheng M,etal. MiR-451 inhibits cell growth and invasion by targeting CXCL16 and is associated with prognosis of osteosarcoma patients[J]. Tumour Biol,2015,36(3):2041-2048.
[14] O’Reilly C, Doroudian M, Mawhinney L,etal. Targeting MIF in cancer: therapeutic strategies, current developments, and future opportunities[J]. Med Res Rev,2016,36(3):440-460.
[15] Tian Y, Nan Y, Han L,etal. MicroRNA miR-451 downregulates the PI3K/AKT pathway through CAB39 in human glioma[J]. Int J Oncol,2012,40(4):1105-1112.
[16] Richard V, Kindt N, Saussez S. Macrophage migration inhibitory factor involvement in breast cancer [J]. Int J Oncol,2015,47(5):1627-1633.
EffectofmiR-451aoverexpressiononproliferationandapoptosisofcervicalcancercellsanditsmolecularmechanism
ZHANG Maona1*,ZHANG Hong1,ZHANG Jun1,ZHANG Lei2
(1DepartmentofPathology,EzhouHospital,People’sHospital,WuhanUniversity,Ezhou436000,China;2DepartmentofPathology,People’sHospitalofHenanProvince,ZhengzhouUniversity;*Correspondingauthor,E-mail:zmn0306@126.com)
ObjectiveTo explore the effect of miR-451a overexpression on the proliferation and apoptosis of cervical cancer cell lines SiHa and C33A and its possible molecular mechanisms.MethodsThe cervical cancer cell lines were divided into miR-NC group(transfected with miR-NC) and miR-451a group(transfected with miR-451a mimics). The expression of miR-451a, macrophage migration inhibitory factor(MIF) and calcium binding protein 39(CAB39) mRNA was detected by qPCR. The expression of MIF, CAB39, p-PI3K and p-AKT protein was analyzed by Western blotting. Cell cycle and apoptosis were detected by flow cytometry. MTT assay and plate cloning experiment were used to detect the cell proliferation ability.ResultsCompared with miR-NC group, the expression of miR-451a was significantly increased in miR-451a group(P<0.01), while the expression of MIF and CAB39 mRNA was significantly decreased(P<0.05), and the expression of MIF, CAB39, p-PI3K and p-AKT protein were significantly decreased. The cell cycle progression was significantly inhibited in miR-451a group(P<0.05), the apoptosis rate was significantly increased(P<0.05), and the cell proliferation ability was significantly decreased(P<0.05).ConclusionOverexpression of miR-451a can inhibit the proliferation of cervical cancer cells and promote the apoptosis, which may be related to down-regulation of MIF and CAB39 protein.
microRNA-451a; cervical cancer; cell proliferation; cell apoptosis
张茂娜,女,1987-03生,硕士研究生,E-mail:zmn0306@126.com
2017-07-29
R737.33
A
1007-6611(2017)11-1145-04
10.13753/j.issn.1007-6611.2017.11.012

