过表达SecS对H2O2诱导大鼠H9c2心肌细胞氧化损伤的保护性作用①
吕思勉,栾卓诚,孙晗嫣,孙晗然,葛堂栋
(佳木斯大学基础医学院,黑龙江 佳木斯 154007)
过表达SecS对H2O2诱导大鼠H9c2心肌细胞氧化损伤的保护性作用①
吕思勉,栾卓诚,孙晗嫣,孙晗然,葛堂栋
(佳木斯大学基础医学院,黑龙江 佳木斯 154007)
目的:探讨SecS在H2O2诱导大鼠H9c2心肌细胞氧化损伤中的保护性作用。方法:根据转染及H2O2处理情况将H9c2心肌细胞分为4组:正常对照组,SecS过表达组,H2O2处理组和SecS过表达+H2O2处理组。MTT法检测各组细胞存活率,酶标仪检测SOD活性和MDA水平。结果:与正常对照组比, H2O2处理组细胞存活率明显下降(P<0.01),SOD活性明显降低(P<0.05),MDA水平明显升高(P<0.01);与H2O2处理组相比,SecS+H2O2组细胞存活率明显上升(P<0.05),SOD活性明显上升(P<0.05),MDA水平显著降低(P<0.05)。结论:过表达SecS能够对抗H2O2引起的心肌细胞损伤,提高大鼠H9c2心肌细胞抗氧化能力,对心肌细胞氧化损伤有一定的保护作用。
SecS;氧化应激;心肌细胞
氧化应激与缺氧再灌注损伤等引起的心肌损伤密切相关,伴随应激产生的活性氧或氧自由基是导致心肌细胞凋亡的重要原因[1]。硒是人体和动物维持生命所必需的微量元素之一,在机体内主要发挥抗氧化作用[2]。研究发现,缺硒能够引起心肌细胞氧化损伤和凋亡,但致病机制仍不清楚。硒在体内主要以硒代半胱氨酸的形式进入硒蛋白而发挥作用。目前,人体内已发现25种硒蛋白。这些硒蛋白主要包括谷胱甘肽过氧化物酶(Glutathione peroxidases,GPxs)类、硫氧还蛋白还原酶类(thioredoxin reductases,Txnrds)以及脱碘酶类(iodothyronine deiodinases,Dios)[3]。在人体内,硒代半胱氨酸的合成需要三个步骤,其中最后一步反应由SecS酶(O-phosphoseryl-tRNA:selenocysteinyl-tRNA synthase,SecS)催化[4]。SecS又称为SEPSECS,以磷酸吡多醛为辅酶,主要存在于肝脏、肺、肾脏以及心脏等部位,其它组织中也有少量表达。研究发现,SecS编码基因突变能够导致进行性脑萎缩(Progressive cerebellocerebral atrophy,PCCA)或克罗恩病(Crohn’s Disease,CD)显示SecS基因变异可能与脑部及肠道炎性疾病关系密切[5, 6]。但是,SecS酶是否在心肌细胞中发挥重要作用尚无报道。本研究通过在大鼠H9c2细胞中过表达SecS并检测各组细胞存活率、抗氧化能力以及脂质过氧化水平,以观察其对H2O2诱导的心肌细胞氧化损伤的保护性作用。
1 材料与方法
1.1 主要材料与试剂
大鼠H9C2 细胞株购于中国科学院上海细胞库。SecS过表达载及LipofectamineTM 2000转染试剂体购自Invitrogen公司,SecS抗体购于Proteintech公司,MTT检测试剂盒购自江苏碧云天生物技术有限公司,SOD和MDA检测试剂盒购自南京建成生物工程研究所。
1.2 方法
1.2.1 细胞培养
大鼠H9c2细胞接种于含有适量DMEM培养液的培养皿中,置于37℃,含5% CO2培养箱内贴壁培养,每隔2d以1:3比例传代。
1.2.2 转染与分组
提前一天将细胞以5×105的接种量接种于六孔板,培养24h后,利用LipofectamineTM 2000将pCDNA3.1-SecS及pCDNA3.1空载体转染到H9c2细胞,培养48h后,加入400μmol/L的H2O2继续培养12h。根据转染及H2O2处理情况将H9c2细胞分为4组:正常对照组(NC),SecS过表达组(SecS),H2O2处理组(NC+H2O2),SecS过表达+H2O2处理组(SecS+H2O2)。
1.2.3 Western blot印迹检测
提取H2O2处理后的各组细胞总蛋白,BCA法进行蛋白定量,取蛋白样品40μg,SDS-PAGE电泳后,转PVDF膜,脱脂奶粉封闭2h,SecS抗体(1:1000稀释)4 ℃孵育过夜,TBST洗膜3次,辣根过氧化物酶标记的二抗(1:10000稀释)室温孵育2 h,凝胶成像系统成像。以GAPDH为内参,分析目的蛋白表达水平。
1.2.4 MTT法检测H9c2细胞存活率
将各组细胞接种于96孔板,经H2O2处理12h后,加入20μL MTT(终浓度为5 mg/mL),继续培养4h后,弃掉上清液,加入150μL二甲基亚砜,震荡溶解结晶物,用酶标仪检测560 nm处的吸光度值。
1.2.5 SOD和MDA检测
SOD活性和MDA水平检测按照试剂盒说明书进行。其中,SOD测定采用黄嘌呤氧化酶法,MDA水平检测以硫代巴比妥酸为底物,酶标仪分别检测532nm和450nm处吸光度值。
1.3 统计学方法
采用SPSS17.0软件进行统计学分析,采用方差分析,各组两两比较用LSD检验。P<0.05为差异显著有统计学意义。
2 结果
2.1 转染前后H9c2心肌细胞SecS蛋白表达水平检测
将pCDNA3.1- SecS过表达载体转染H9c2心肌细胞,同时转染空载体最为对照。结果显示,与空白对照组(NC)以及空载体组(vector)相比,转染pCDNA3.1- SecS组SecS蛋白表达水平明显升高(P<0.05),显示载体构建成功。见图1。
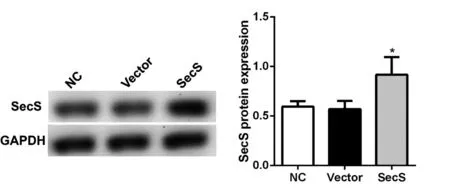
图1 转染前后H9c2心肌细胞SecS蛋白表达水平*P<0.01
2.2 过表达SecS对H9c2心肌细胞存活率的影响
与正常对照组相比,过表达SecS后心肌细胞存活率无明显变化;加入400μmol/L的H2O2作用12h后,细胞存活率明显下降(P<0.01);与H2O2处理组相比,过表达SecS组细胞存活率由58.30%±0.56%上升至77.23%±0.63%(P<0.05),显示过表达SecS能够显著提高氧化损伤后的H9c2心肌细胞存活率。见图2。
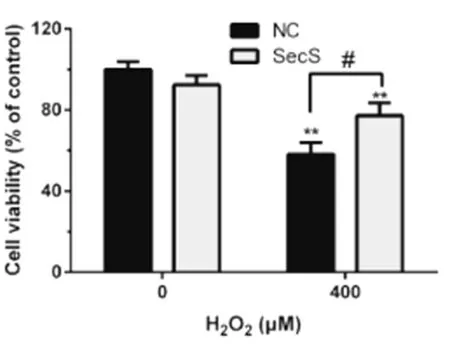
图2 过表达SecS对H9c2心肌细胞存活率的影响
**P<0.01;#P<0.05。
2.3 过表达SecS对H9c2心肌细胞SOD活性的影响
与正常对照组相比,过表达SecS后心肌细胞SOD活性无明显变化;经400μmol/L的H2O2处理12h后,SOD水平降至空白对照组的55.57%(P<0.05);与H2O2处理组相比,过表达SecS组心肌细胞SOD活性明显(P<0.05)。结果显示,过表达SecS能够明显提高H9c2心肌细胞主要抗氧化酶活性,增强细胞抗氧化能力。见图3。

图3 过表达SecS对H9c2心肌细胞SOD活性的影响
*P<0.05;#P<0.05。
2.4 过表达SecS对H9c2心肌细胞MDA水平的影响
与正常对照组相比,过表达SecS后H9c2心肌细胞MDA水平无明显变化;经400μmol/L的H2O2处理12h后,MDA水平升高3.39倍(P<0.01);与H2O2处理组相比,过表达SecS组H9c2心肌细胞MDA水平显著下降(P< 0.05)。结果显示,过表达SecS能够降低氧化损伤后心肌细胞应激水平。见图4。

图4 过表达SecS对H9c2心肌细胞MDA水平的影响
**P<0.01;#P<0.05。
3 讨论
研究发现,过量氧自由基或活性氧(reactive oxygen species,ROS)导致的氧化应激水平升高与很多心血管疾病发生发展过程关系密切,如心肌肥大、心衰、心梗以及缺血再灌注损伤[7]。氧自由基主要由线粒体产生,就心脏而言,线粒体约占30%,因此心脏极易产生氧化损伤。氧化应激极易导致脂质过氧化的发生,随着脂质过氧化反应加剧,氧化产物丙二醛(Malondialdehyde,MDA)水平随之增高[8]。MDA含量是脂质过氧化的一个常用指标,能够反映细胞膜脂过氧化的程度。为降低氧化损伤程度,线粒体内进化出一套完整的抗氧化体统,包括超氧化物歧化酶(superoxide dismutase,SOD)、NADH、谷胱甘肽过氧化物酶等。SOD活力能够间接反应细胞清除活性氧的能力,是判断细胞抗氧化能力的一个常用指标。
硒是人体所必需的微量元素之一,通常以硒代半胱氨酸的形式进入硒蛋白而发挥作用,其中以谷胱甘肽过氧化物酶抗氧化作用最为明显。目前,硒对心肌细胞的保护性机制仍不清楚。本研究通过过表达硒蛋白合成路线上游的关键酶SecS,观察其在H2O2诱导的大鼠H9c2心肌细胞氧化损伤中的保护性作用。结果显示,过表达SecS能够增加H2O2引起的H9c2心肌细胞存活率,提高以SOD为代表的抗氧化酶活性,降低细胞脂质过氧化水平,显示SecS酶在心肌细胞氧化损伤时发挥重要作用。因此,进一步研究硒蛋白合成过程中的关键因子与心脏功能的关系,阐明硒缺乏引起心肌细胞氧化损伤的分子机制,仍是我们亟待解决的问题。
[1]Wojtovich AP, Foster TH. Optogenetic control of ROS production[J]. Redox Biol,2014, 3(2): 368-376
[2]Brown KM, Arthur JR. Selenium, selenoproteins and human health[J]. Public Health Nutr,2001, 4(2): 593-599
[3]Frederick P, BELLINGER I, Arjun V, et al. BERRY Regulation and function of selenoproteins in human disease[J]. Biochem J,2009, 422(1):11-22
[4]Turanov AA, Xu XM, Carlson BA, et al. Biosynthesis of selenocysteine, the 21st amino acid in the genetic code, and a novel pathway for cysteine biosynthesis[J]. Adv Nutr,2011, 2(2):122-128
[5]Agamy O, Ben Zeev B, Lev D,et al. Mutations disrupting selenocysteine formation cause progressive cerebello-cerebral atrophy[J]. Am J Hum Genet,2010, 87(4): 538-544
[6]Anttonen AK, Hilander T, Linnankivi T,et al. Selenoprotein biosynthesis defect causes progressive encephalopathy with elevated lactate[J]. Neurology,2015, 85(4):306-315
[7]Madamanchi NR, Runge MS. Redox signaling in cardiovascular health and disease[J]. Free Radic Biol Med,2013, 61:473-501
[8]蔡纲, 黄平, 李绍民. 翻白草对CCl4所致慢性肝损伤大鼠肝组织中SOD、MDA、GSH水平的影响[J]. 黑龙江医药科学, 2016, 39(1):33-36
黑龙江省大学生创新创业训练计划项目,编号:201610222032。
吕思勉(1996 ~)女,黑龙江佳木斯人,在读本科生。
葛堂栋(1979 ~)男,黑龙江佳木斯人,硕士,讲师。E-mail: getangdong@163.com。
R322.1+1
A
1008-0104(2017)06-0114-02
2017-09-13)

