醇铜生产装置甲酸废水制甲酸钙
郭宇楠 张晓娟 赵 云 田 伟 杨 楠 修 旭
(沈阳工业大学石油化工学院,辽宁 辽阳 111003)
辽阳石化公司尼龙厂醇酮装置,在以环己烷为原料采用贫氧无催化氧化工艺生产环己醇和环己酮过程中,经蒸发-冷凝处理,每年产生的甲酸含量约7%的酸性废水中甲酸含量超过400 t,该酸性废水的COD值高达10~16万mg/L[1]。若将此类废水直接排放则污染环境,浓度超过2%则能对生化处理系统造成严重伤害,同时,也造成资源浪费[2]。为此,人们采取不同方法处理该类废水,处理途径主要分为将废水中的甲酸回收利用[3,4]、将废水中甲酸分解掉[5,6]及将废水中甲酸转换为其他有用物质的处理方法[7,8]。甲酸钙是国内外新开发的一种用途广泛的试剂,可用于燃料气脱硫、饲料添加剂、食品工业添加剂、石油工业钻探助剂、植物生长调节剂等[9]。为此,采用氢氧化钙和碳酸钙与废水中的甲酸反应,再经蒸馏后排放,废水中的甲酸量会得到有效控制,达到排放标准,而且还可以得到有价值的甲酸钙产品。
1 实验部分
1.1 实验试剂
实验中酸性废水取自辽阳石化分公司尼龙厂,氢氧化钙为工业级,其他试剂均为分析纯。
1.2 实验原理
采用氢氧化钙和碳酸钙与甲酸废水中的甲酸发生中和反应生成甲酸钙。利用甲酸钙微溶于水的性质将其回收。
1.3 废水处理流程
本研究对醇酮装置产生的甲酸废水采用两种方法进行处理,即氢氧化钙法和碳酸钙法。两种方法的实验研究过程见图1。
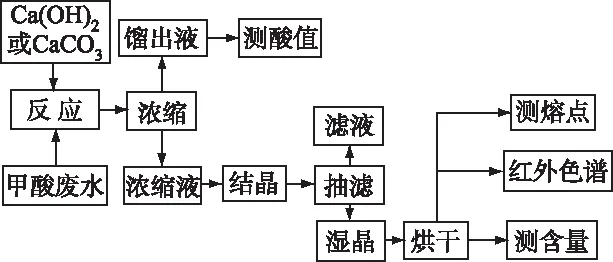
图1 实验操作流程图Fig 1 Experimental operation flow chart
1.4 分析方法与计算
试验中对废水和馏出液中甲酸含量进行[H+]的测定,对产品甲酸钙进行熔点的测定和产品含量的测定。计算[H+]去除率与产品的产率。采用高锰酸钾-草酸氧化-还原法测定产品甲酸钙含量,反应方程式为:
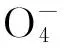
甲酸钙含量(X%)的计算为:
式中:m—未知含量甲酸钙的质量g; X——甲酸钙的含量%;V1——空白样消耗高锰酸钾的体积mL;V2——样品消耗高锰酸钾的体积mL;C——高锰酸钾浓度mol/L。
2 结果与讨论
用含甲酸废水生产甲酸钙,由于甲酸钙在0 ℃时的溶解度为16.4 g/100 g水,不能直接结晶析出,故应对反应液浓缩。采用氢氧化钙法和碳酸钙法处理甲酸废水制甲酸钙。由于氢氧化钙和碳酸钙法与甲酸反应属于酸碱中和反应,但氢氧化钙碱性大于碳酸钙,比较容易与甲酸反应,故实验研究中固定氢氧化钙与甲酸废水的反应温度为40 ℃,同时,为了使所得甲酸钙产品中尽可能不残留氢氧化钙,且保证废水中甲酸的充分利用,将氢氧化钙与甲酸废水反应的投料比按理论量进行;因碳酸钙与甲酸废水反应过程中产生CO2气体,造成甲酸的损失,反应过程中,需要考查投料比的影响。
2.1 氢氧化钙法
2.1.1浓缩方式的确定
在反应时间3 h,投料比2∶1,反应温度40℃,考查常压浓缩和减压浓缩对蒸出废水的甲酸去除率的影响。根据常压蒸馏和减压蒸馏的甲酸的去除率和浓缩比绘制折线图,考查结果见图2。图2为不同浓缩方式的甲酸去除率和浓缩比的折线图。
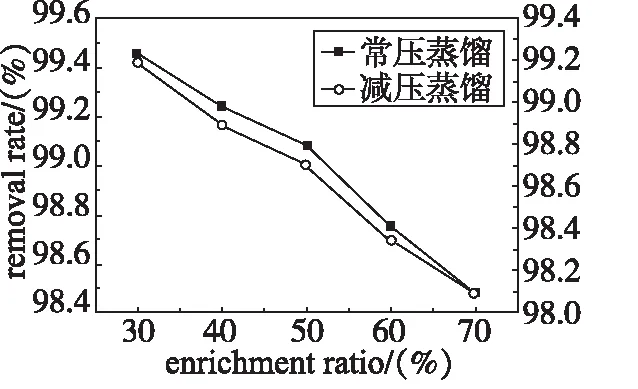
图2 不同浓缩方式实验结果图Fig 2 Experimental results ofdifferent enrichment methods
由图2可以看出:在实验条件下,随着浓缩比的升高,常压蒸馏的甲酸去除率明显高于减压蒸馏,其原因可能是甲酸在负压情况下的挥发速度比常压挥发速度快,使蒸出水中甲酸的浓度增大,而且由于常压操作温度高于减压,加速反应,减少与水蒸出的甲酸量。甲酸的随水蒸出会降低产品产率。故从甲酸去除率和产品收率分析都是常压蒸馏好于减压蒸馏,故选择常压蒸馏。
2.1.2反应时间的确定
在常压下,投料比2∶1,反应温度40 ℃,浓缩比为70%,考查不同反应时间对甲酸废水中甲酸去除率及产品产率的影响。实验结果见图3。
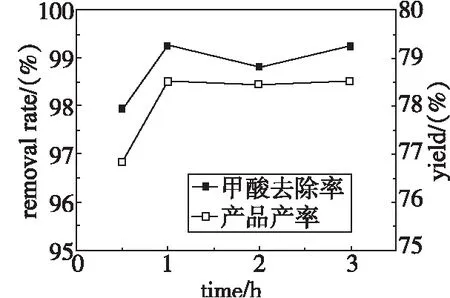
图3 不同反应时间实验结果图Fig 3 Experimental resultsof different reaction times
由图3可以看出,在实验条件下,从甲酸去除率看,当反应时间由0.5h上升到1h时,甲酸去除率明显升高,从1h至3h时,甲酸去除率变化不明显。从产品产率看,反应时间长短的影响不大。工业生产都是要以最短的时间达到最大的经济效益。故选择1h为最佳反应时间。
2.1.3浓缩比例的确定
固定其他条件,考查不同浓缩比对甲酸废水中甲酸去除率及产品产率的影响。实验结果见图4。
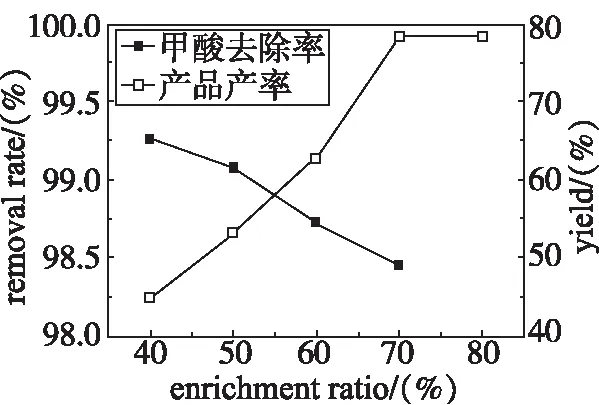
图4 不同浓缩比例的实验结果图Fig 4 Experimental results of differentenrichment ratios
由图4看出,在实验条件下,浓缩比例从40%逐步上升到80%,甲酸去除率增加并不大,产品产率却有明显的增加。当浓缩比小时,浓缩液量多,因溶解的甲酸钙量增多导致产率太低,而浓缩比上升到80%时,实验中产生爆沸,这已经造成了一定的安全隐患。70%的浓缩比例有很好的产品产率,且蒸出废水的酸含量还在废水的排放标准以内,故选择70%为最佳反应的浓缩比。
2.1.4考察结晶时间
按照上述确定的优化条件进行实验,浓缩液在室温下(25 ℃)进行冷却结晶,考查不同结晶时间对产品收率的影响,实验结果见表1。
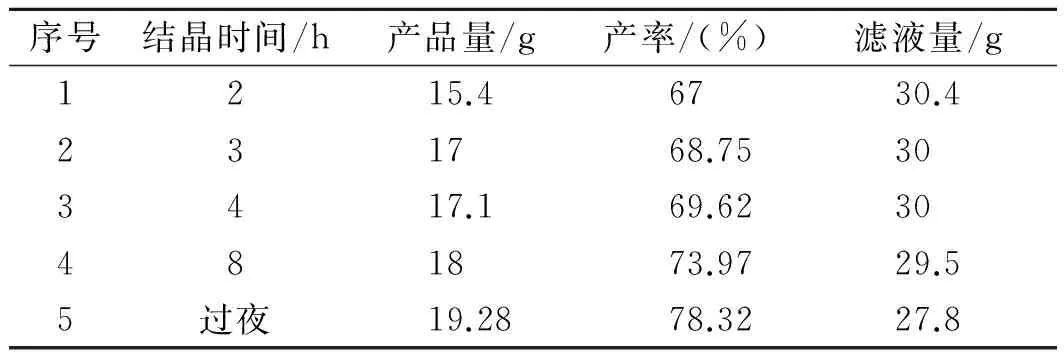
表1 结晶时间对实验结果的影响Table 1 Effect of crystallization time on experimental results
由表1得出,随结晶时间的延长,产品的产率会不断增加,要想得到最多的结晶,就应该无限的延长结晶时间,但是相对时间的结晶量会逐步下降,以过夜为最佳结晶时间。
2.1.5验证实验
综合上述实验,初步确定适宜的条件为:投料比2∶1,反应温度40 ℃,反应时间1 h,浓缩比为70%,过夜结晶。
为了验证该条件的正确性和稳定性,安排3次平行实验进行验证,实验结果见表2。
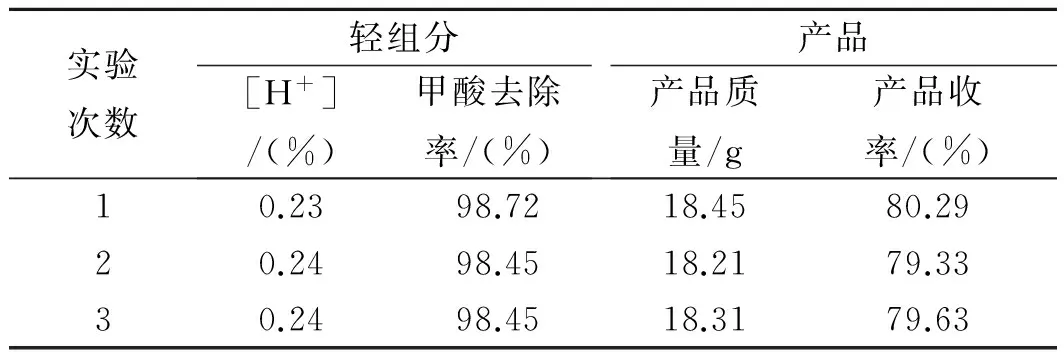
表2 验证实验结果Table 2 Verify the experimental results
根据表2中数据可以看出,在确定的实验条件下,3次实验结果甲酸的去除率和产品收率基本平稳且较优,由此可以说明实验确定的适宜条件是正确的。
2.1.6滤液循环次数的考察
由于甲酸钙在水中有一定的溶解度,滤液中残留部分产品,为了提高产品收率,对滤液进行循环使用,循环到与前一次收率平行时,这才是每一次反应后甲酸钙的真正产量。按照2.1.5确定的实验条件,对抽滤得到滤液循环,实验结果见表3。

表3 滤液循环实验结果Table 3 Filtrate cycle test results
表3的数据说明当滤液循环到3次数时,实验结果开始稳定,这时的产率才是每次反应后的真正产率,即在上述实验条件下,甲酸钙的产率和废水中甲酸去除率均达到97%以上。
2.2 碳酸钙法
2.2.1投料比考查
在常压下,60 ℃反应2 h,浓缩比为70%,考查不同投料比对甲酸废水中甲酸去除率和产品收率的影响。实验结果见图5。
根据图5可知,从甲酸去除率和甲酸钙产品收率来看,二者均是呈先上升后降低的趋势,投料比均是2.05:1时效果最好,故确定碳酸钙法合适的投料比为2.05∶1。
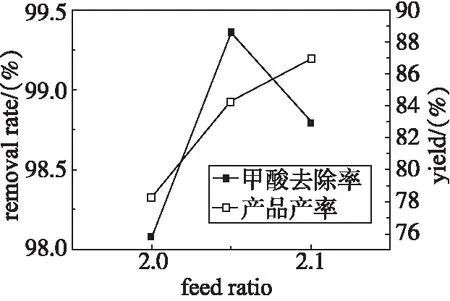
图5 不同投料比的实验结果图Fig 5 Experimental results of different feed ratio
2.2.2反应时间考察
固定上述已知条件,改变反应时间,考查不同反应时间对由废水制备甲酸钙产品产率和甲酸废水中甲酸去除率的影响。实验结果见图6。
通过图6可以看出,随着反应时间的延长,甲酸的去除率和产品产率均呈现增高后降低的趋势。反应时间不够,还有部分甲酸没能反应。反应时间太长,反应液中的甲酸在60 ℃下损失太多,故选择最佳反应时间为2 h。
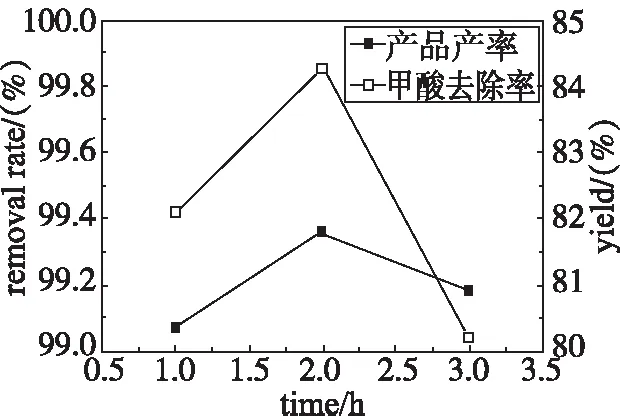
图6 不同反应时间的实验结果图Fig 6 Experimental results fordifferent reaction times
2.2.3反应温度考查
固定上述已知条件,改变反应温度,考查不同反应温度对实验结果的影响。 不同反应温度对由废水制备甲酸钙产品产率和甲酸废水中甲酸去除率的影响结果见图7。
从图7中可以看出,反应温度从50 ℃与70 ℃,50 ℃的甲酸的去除率和产品的的收率呈现先增高后降低的趋势。反应温度较低时,反应液中有较多的甲酸没能反应。反应温度太高时,甲酸挥发,回流液中的甲酸较多,未能与瓶底的碳酸钙反应,故选择60℃为最佳反应温度。

图7 不同反应温度的实验结果图Fig 7 Experimental results for differentreaction temperatures
2.2.4验证实验
综合上述实验结果初步确定碳酸钙法处理甲酸废水的最佳条件为:投料比2.05∶1,反应温度60 ℃,反应时间2 h,浓缩比为70%,过夜结晶。安排3次平行实验对该实验条件进行验证,实验结果见表4。

表4 验证实验结果Table 4 Verify the experimental results
表4数据表明,在上述实验确定的最佳反应条件下的实验结果重复性好,产品产量和甲酸去除率结果都是最好的,说明这些反应条件是可行的。
2.2.5滤液循环实验
基于2.1.6同样的原因,对碳酸钙法处理甲酸废水的滤液进行循环实验。根据2.2.4所确定的最佳实验条件安排实验,实验结果见表5。
根据表5这种的结果,当滤液循环到第二次时,甲酸的去除率和产品产率都开始保持在一个范围内波动,此时的一次产品质量已经接近理论产量,这时的产率才是每次反应后的真正产率。即碳酸钙法处理甲酸废水,废水中甲酸去除率达到98%以上,产品收率在94%以上。
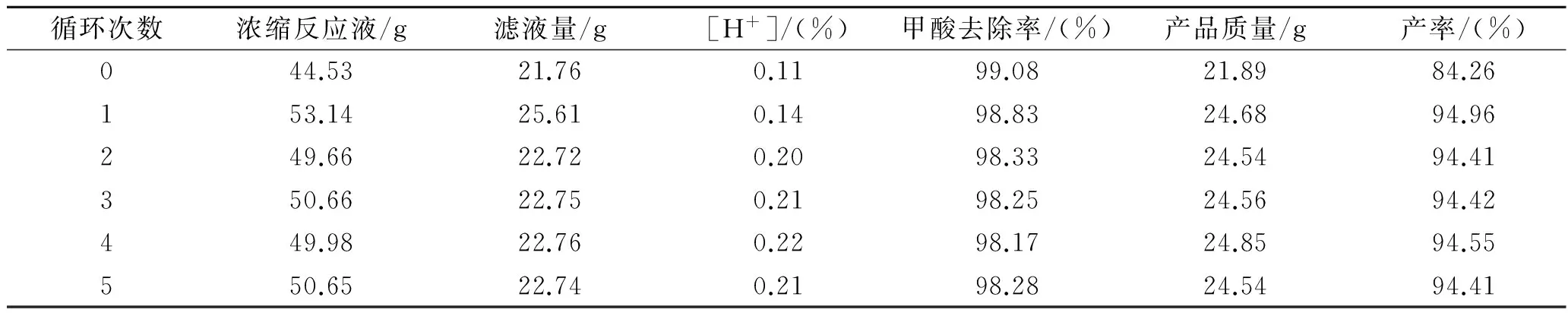
表5 滤液循环实验结果Table 5 Filtrate cycle test results
无论是哪种方法制取甲酸钙后,产品中都还有一定的氢氧化钙或碳酸钙残留,这就需要对产品的纯度测定。
2.3 实验产品与市售产品的分析对比
2.3.1产品熔点的分析
用熔点仪分别对实验产品好市售产品的熔点进行了测定,由于WRS-3显微熔点测定仪的最大测量范围为320 ℃,故测量了40~320 ℃的甲酸钙在熔点仪中的现象。氢氧化钙法产品甲酸钙晶体在60℃时,有部分晶体发生了转动,说明有晶体中有少量的结晶水,这部分晶体发生了溶解。剩余的晶体在持续升温过程中,晶体并没有发生熔融,待温度上升到319 ℃时,关闭了熔点测定仪。碳酸钙产品测定时,在温度升高到319 ℃的过程中,产品晶体未能发生熔化。市售产品在熔点测定时,温度由40 ℃上升到319 ℃的过程中,甲酸钙晶体熔化。甲酸钙产品的理论熔点为300 ℃,通过实验产品来源,可以确定产品是甲酸钙。至于产品在300 ℃不熔,实验条件有限,原因无法知道。
2.3.2产品含量的分析结果对比
通过分析市售产品与氢氧化钙法和碳酸钙法得到的产品经高锰酸钾法滴定消耗KMnO4和甲酸根的百分含量的对比结果见表6。
通过表6中数据可以看出,两种方法得到的产品质量相当,均达到市售产品标准。

表6 合成产品与市售产品含量分析结果Table 6 Analysis of synthetic product andcommercially available product content
4 结 论
以甲酸废水为原料,用氢氧化钙法和碳酸钙法制取了甲酸钙,确定了生产的最佳工艺条件。
(1)氢氧化钙法的最佳反应条件是常压蒸馏、反应时间1 h、70%的浓缩比例、过夜的结晶时间,最佳反应条件综合得到的甲酸去除率在98.5%左右,产品收率在97.9%左右,产品含量为95.1%,与市售产品相当。
(2)碳酸钙法的最佳反应条件是投料摩尔比是2.05∶1、反应时间2 h、反应温度60 ℃,最佳反应条件综合得到的甲酸去除率在99.25%左右,产品产率在94.41%左右,产品含量为95.22%,与市售产品相当。
(3两种方法的甲酸的去除率大于98.5%,甲酸钙的产率大于94%。
[1] 张晓娟,唐丽华,陈恩之,等.一种从有机酸废水中获取甲酸的方法[J].环境污染与防治,2006,28(4):302~305.
[2] 杨清香,贾振杰,潘峰 等.酵母菌在废水处理中的应用[J].环境污染治理技术与设备,2005,6(2):1~5.
[3] 张敏卿,叶丽莉.EDI 用于处理含甲酸废水[J].化工进展,2013,32(4):936~941.
[4] 王晓兵,胡国强.溶剂萃取法对甲酸废水的处理研究[J].辽宁石油化工大学学报,2009,29(3):15~18.
[5] G.S.Luo, S. Pan,J.G.Liu. Use of the electrodialysis process to concentrate a formic acid solution [J].Desalination,2000,150:227~234.
[6] 方向红,张寅秋,王琪 等. Pd/AC催化剂催化分解甲酸反应条件的研究[J].无机盐工业,2010,42(2):43~45.
[7] 赖凌雁,叶活动,陈建洪 等.环氧化生产中废甲酸水的回收利用探讨[J].广东化工,2013,40(19):114~115.
[8] 张晓娟,陈旭,唐丽华 等.从环己醇和环己酮甲酸废水中回收甲酸酯[J].沈阳工业大学学报,2008,60(6):716~720.
[9] 侯志源,吕静,李振花.氢氧化钙羰基合成甲酸钙反应动力学[J].化学工业与工程,2016,33(2):23~29

