黄芪总皂苷对体外培养大鼠神经干细胞增殖的影响*
金华倩 丁文倩 储利胜 李琳
浙江中医药大学浙江杭州310053
神经干细胞(NSCs)是一类位于中枢神经系统,具有自我更新和多项分化潜能的细胞。成体神经干细胞主要在侧脑室下区(SVZ)和海马齿状回颗粒下区(SGZ)。缺血性脑损伤诱导内源性神经干细胞增殖、迁移和分化。增强内源性神经发生或神经干细胞移植可以促进脑损伤后神经修复和功能恢复[1]。黄芪是常用的补气中药,能促进脑损伤后神经系统修复再生[2]。黄芪总皂苷(TSA)是中药黄芪的主要有效成分之一,具有抗炎、抗氧化、抗凋亡、扩张血管等作用[3-4]。本实验研究TSA对体外培养神经干细胞的增殖作用。
1 材料与方法
1.1 实验动物:孕13~14天SD(Sprague-Dawley)大鼠,购自上海西普尔-必凯实验动物有限公司,动物质量合格证号:SCXK(沪)2013-0016。
1.2 药品:黄芪总皂苷,200mg(UV≥98%),购于上海源叶生物科技有限公司,批号:J20F7T9819。
1.3 主要试剂与仪器:DMEM/F12培养基、0.25%胰酶、青-链霉素溶液、PBS、Hanks缓冲液(杭州吉诺生物技术有限公司),胎牛血清(美国Gemini公司),EGF、B27(美国Gibco公司),碱性成纤维细胞生长因子(bFGF)(美国PeproTech公司),细胞消化液Accutase、MTT、BrdU粉末、BrdU小鼠单克隆抗体(美国Sigma公司),多聚赖氨酸(Poly-L-Lysine)、FITC标记山羊抗小鼠二抗、DAPI(北京中杉金桥生物技术有限公司),Cy3标记山羊抗小鼠二抗(杭州达文生物有限公司),nestin小鼠单克隆抗体(美国Santa Cruz公司)。超净工作台(苏州安泰空气技术有限公司),CO2培养箱(日本SANYO公司),酶标仪(美国Bio-Tek公司),倒置荧光显微镜(德国Leica公司)。
1.4 神经干细胞培养和传代:取孕13~14天的SD大鼠,10%水合氯醛麻醉后,75%乙醇溶液浸泡消毒灭菌,取出胎鼠,将胎鼠置于4℃无菌Hanks溶液中,分离出胎鼠大脑全脑组织,剥除脑膜和血管,将脑组织切成小块移至离心管内,加入适量0.25%胰酶,放入37℃细胞培养箱中消化15min后取出,胶头滴管轻轻吹打混匀细胞至不见组织碎片,再加入10%FBS溶液终止消化,经200目高压灭菌的金属筛网过滤,滤液于1000rpm离心5min,弃上清液,加入适量的NSCs培养基(DMEM/F12+2%B27+20ng/ml EGF+20ng/ml bFGF+1%青-链霉素溶液),接种于25cm2培养瓶中,置于37℃、5%CO2培养箱中培养,原代培养的前3天每天更换培养液,当细胞聚集形成细胞球后2~3天半量换液。原代培养7天第1次传代,以后5~7天传代1次。细胞传代操作:收集细胞液于离心管内,1000rpm离心5min,弃上清液,加入1ml Accutase吹打数次致悬,放入37℃细胞培养箱中消化5min,室温1000rpm离心5min,吸弃Accutase,加入1ml培养基重悬,制成单细胞悬液,细胞计数,以1×106个/瓶接种到新的培养瓶内。第3~5代细胞用于后续实验。
1.5 神经干细胞鉴定:取第3代神经球和NSCs单细胞悬液,加入至经多聚赖氨酸处理的24孔板中,每孔加0.5ml的细胞悬液,放入培养箱4h后取出,吸弃培养基,4%多聚甲醛固定30min后,0.1%Triton X-100处理细胞15min,5%山羊血清37℃湿盒中孵育1h,加一抗体nestin(1∶100),4℃孵育一夜后,加入FITC标记的二抗(1∶100)于37℃黑暗湿盒中孵育1h后,滴加DAPI,荧光显微镜下观察并拍照。
1.6 MTT检测细胞活性:取消化传代的NSCs,调整细胞浓度为2×104个/孔,接种于96孔板。加入不同浓度的TSA后分别孵育24、48、72h,共设8组(0、0.1、0.2、0.5、1、2、5和10μg/ml TSA组),每组5个复孔,每孔加入20µlMTT溶液(5mg/ml),继续培养4h,96孔板离心后吸弃上清液,每孔加入二甲基亚砜(DMSO)150μl,置于摇床震荡10min,用酶标仪在490nm波长处测定吸光度值。
1.7 BrdU/Nestin免疫荧光双标检测神经干细胞增殖:取消化传代的NSCs,调整细胞浓度为1×105个/孔,接种于有预先包被0.01%多聚赖氨酸的盖玻片的24孔板内培养,TSA(0、1、2μg/ml)同时加入BrdU(10 μmol/L)处理48h后,弃去培养液,4%多聚甲醛室温固定30min,0.25%Triton X-100破膜20min,加2mol/L的HCl室温下变性30min,加入0.1mol/L的硼酸钠(pH 8.5)中和反应10min,3%过氧化氢灭活内源性过氧化物酶室温下孵育20min,加羊血清工作液封闭于37℃1h,加一抗BrdU(1∶100)于4℃孵育过夜,次日加Cy3标记的山羊抗小鼠荧光二抗(1∶100),于37℃避光孵育1h,再加羊血清工作液封闭于37℃孵育1h,加一抗nestin(1∶100)工作液4℃孵育过夜,次日加FITC标记的山羊抗小鼠荧光二抗(1∶100),于37℃避光孵育1h,再滴加DAPI,于荧光显微镜下观察。每组随机计数6个视野下BrdU阳性细胞数,计算细胞增殖率/%=BrdU阳性细胞总数/Nestin阳性细胞总数×100%。
1.8 统计学方法:应用SPSS 17.0软件进行统计分析,所有数据以±s表示。采用单因素方差分析(ANOVA)并SNK进行组间比较,P<0.05为差异有统计学意义。
2 结果
2.1 神经干细胞的细胞形态:原代培养第2天镜下可见部分细胞贴壁,部分细胞悬浮呈球状,第3代细胞聚集呈细胞球,折光性好。见图1。
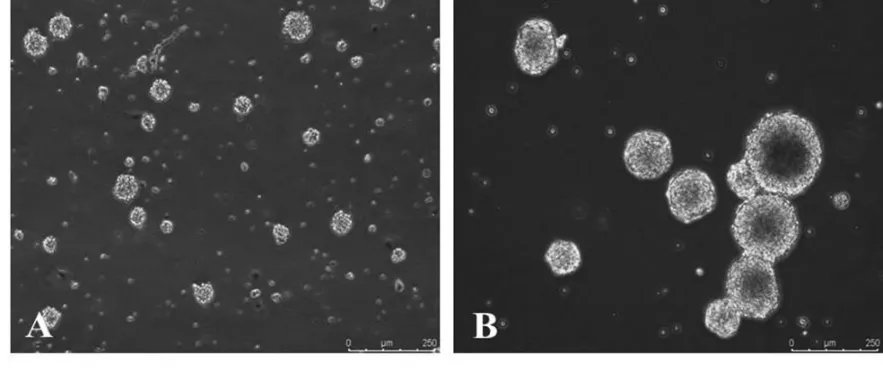
图1 NSCs形态
2.2 神经干细胞的鉴定:免疫荧光结果显示,神经球表面基本完全呈nestin阳性表达,单个NSCs近92%呈nestin阳性表达。见图2。
2.3 黄芪总皂苷对神经干细胞的增殖作用:MTT实验结果显示,不同浓度TSA孵育NSCs 24、48、72h后,同一时间点,与0μg/ml TSA组比,1、2μg/ml TSA组的细胞存活率差异显著(P<0.05),其作用于48h效果最显著(P<0.01)。见图3。
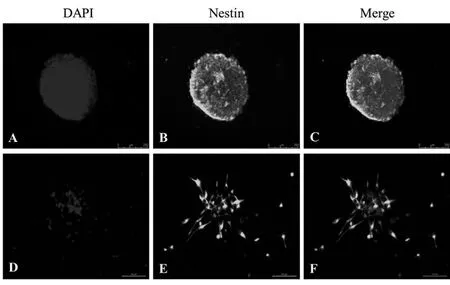
图2 NSCs鉴定
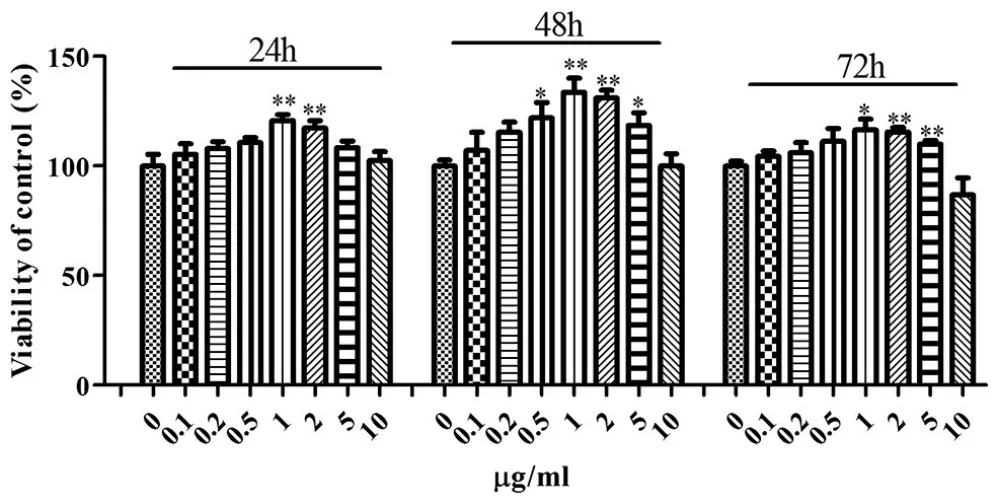
图3 不同浓度TSA作用不同时间对NSCs增殖的影响(n=5)
2.4 BrdU/Nestin免疫荧光双标检测神经干细胞增殖结果:BrdU/Nestin免疫荧光双标结果显示1、2μg/ml TSA孵育NSCs 48h后,BrdU阳性细胞比例均较对照组(0μg/ml TSA)显著增多(P<0.01)。见图4。
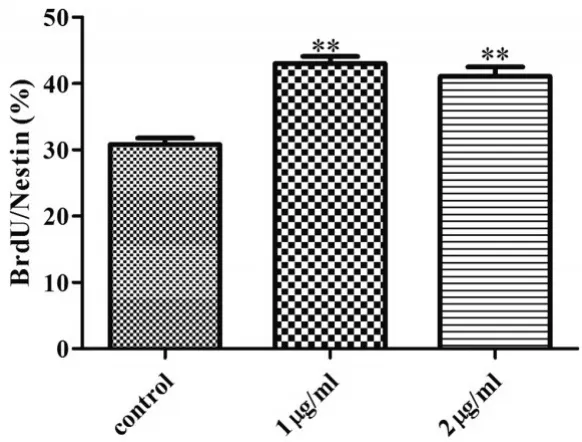
图4 TSA作用48h对NSCs增殖的影响(n=6)
3 讨论
神经干细胞具有自我更新能力,并能分化为神经元、星形胶质细胞和少突胶质细胞。Nestin又名巢蛋白,是一种中间丝蛋白,主要在NSCs内一过性表达,当NSCs向终末细胞分化后,Nestin表达停止。所以巢蛋白常被用来标记NSCs。我们采用Nestin标记神经球和单个NSCs,均证实我们培养的NSCs纯度达到90%以上。
脑卒中能诱导NSCs增殖、迁移和分化,促进损伤的脑组织修复和神经功能恢复。但在无任何干预的情况下,脑缺血后死亡的神经元中仅有0.2%被新生神经元替换,不足以改善缺损的神经功能[5]。近年来研究发现,药物治疗可以促进脑缺血后NSCs增殖、迁移和分化。研究表明,一些中药及其活性成分不仅可以保护神经细胞,而且能促进NSCs的增殖并诱导其定向分化为神经元,达到治疗神经功能缺损疾病的目的[6]。中药黄芪具有免疫调节、抗炎、抗氧化、改善脑血流等作用[7]。本实验室前期研究发现黄芪能促进脑缺血后NSCs增殖分化[8]。韦云飞等[9]研究也发现黄芪注射液能促进脑缺血后NSCs增殖和分化。黄芪皂苷是黄芪的主要有效成分之一,具有神经保护和抗缺血性脑损伤作用[10-11]。本研究首先采用MTT法检测发现TSA促进NSCs增殖具有剂量和时间依赖性,其中1、2μg/ml TSA处理48h的作用最显著,采用BrdU标记NSCs进一步证实TSA促进NSCs增殖。
总之,黄芪总皂苷促进体外培养的NSCs增殖,但是否促进脑缺血后神经干细胞增殖,以及促进增殖的机制还有待进一步研究。
[1]Zhang R,Zhang Z,Chopp M.Function of neural stem cells in ischemic brain repair processes[J].J Cereb Blood Flow Metab,2016,36(12):2034-2043.
[2]张力,杨石照,张辉.黄芪促进中枢神经系统再生与修复的研究进展[J].医学综述,2014,20(3):398-400.
[3]刘爽.黄芪药理作用的研究进展[J].北方药学,2015,12(12):95-96.
[4]LiL,HouX,XuR,etal.Researchreviewonthe pharmacological effects of astragaloside IV[J].Fundam Clin Pharmacol,2017,31(1):17-36.
[5]Arvidsson A,Collin T,Kirik D,et al.Neuronal replacement from endogenous precursors in the adult brain after stroke[J].Nat Med,2002,8(9):963-970.
[6]6]Si YC,Li Q,Xie C,et al. Chinese herbs and their active ingredients for activating xue (blood) promote the proliferation and differentiation of neural stem cells and mesenchymal stem cells[J].Chinese Medicine,2014,9(1):13.
[7]Fu J,Wang ZH,Huang LF,et al.Review of the botanical characteristics, phytochemistry, and pharmacology of astragalus membranaceus (Huangqi) [J].Phytotherapy Research,2014,28(9):1275-1283.
[8]曲铁兵,俞天虹,刘志婷,等.补阳还五汤及其拆方对大鼠脑缺血后神经发生的影响[J].中国中西医结合杂志,2014,34(3):342-347.
[9]韦云飞,赵伟佳,郝永楠,等.黄芪注射液对缺血后脑组织神经干细胞增殖和分化的影响[J].临床神经病学杂志,2012,25(3):192-195.
[10]朱敏姿,徐彬,梁顺利,等.黄芪注射液对脑缺血再灌注损伤大鼠MMP-9和IL-1β的影响[J].浙江中医杂志,2011,46(3):207-208.
[11]尹艳艳,李卫平,李维祖,等.黄芪总苷对大鼠局灶性脑缺血/再灌注损伤后BDNF、TrkB和p75NTR mRNA表达的影响[J].中国药理学通报,2009,25(5):672-676.

