XB130在胃癌组织中的表达及临床意义
谷军保,鲍学斌,马 钊
(河南省人民医院胃肠外科,河南 郑州 450003)
胃癌是常见的恶性肿瘤,病死率居恶性肿瘤第2位[1]。胃癌的分子标志物是国内外研究的热点,寻找与胃癌发病相关的新型靶向基因对其预后评估及综合治疗有重要意义。XB130是一种新被识别的蛋白,在脾脏和甲状腺中表达较高,而在脑、肾、肺和胰腺中表达较低[2];XB130是一种肿瘤启动子,但在甲状腺癌和人肺癌细胞系中XB130表达下调[2]。XB130不仅参与细胞增殖、存活,还参与信号传递,本身会受到Rac和细胞骨架的调控,参与c-Src通路的激活和磷脂酰肌醇3-激酶/蛋白激酶B信号通路活化,而这些通路在胃癌的发生、发展中起到关键作用,提示XB130在胃癌的发生、发展中也起到一定作用[3-5]。本研究旨在探讨XB130在胃癌组织中的表达及其与胃癌分化程度、淋巴结转移及患者生存期的关系,以期为胃癌的发病机制提供基础数据,为胃癌的临床治疗提供新思路。
1 资料与方法
1.1标本来源收集2011年6月至2012年6月河南省人民医院保存的胃癌组织标本及相应的癌旁组织(距离癌组织>5 cm处)标本各72例,男53例,女19例;年龄42~73岁,平均(58.3±6.2)岁;均经组织病理学检查确诊为胃癌,术前均未进行放射治疗和化学治疗。
1.2仪器与试剂总RNA分离试剂盒(美国Promega公司),TaqDNA聚合酶(美国Thermo公司),聚合酶链反应(polymerase chain reaction,PCR)引物(上海生工生物工程股份有限公司);组织破碎仪(德国Retsch公司),低温超速离心机(德国Hettich公司),PCR扩增仪(美国Biorad公司)。
1.3方法
1.3.1免疫组织化学法检测胃癌及癌旁组织中XB130蛋白表达将石蜡切片置于二甲苯I、二甲苯II中各浸泡15 min;无水乙醇I、无水乙醇II及体积分数90%、80%乙醇中各浸泡10 min;于100 ℃柠檬酸盐溶液中抗原修复15 min;0.01 mol·L-1磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.4~7.6)冲洗3次,每次5 min;体积分数3%过氧化氢-甲醇溶液中封闭内源性过氧化物酶10~15 min;蒸馏水冲洗,PBS清洗3次,每次5 min;血清封闭液室温封闭30 min;吸去封闭液,滴加一抗,4 ℃ 过夜;取出后室温放置复温20 min,PBS冲洗3次,每次5 min;滴加二抗,37 ℃温箱孵育45 min,PBS清洗3次,每次5 min;滴加50~100 μL二氨基联苯胺显色工作液显色5~10 min;置于PBS中终止显色;苏木精复染,脱水,中性树胶封片,显微镜下观察,拍照。随机抽查5个高倍视野,计数100个细胞,以阳性细胞数和着色深度进行判定。染色强度评分标准:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞百分率评分标准:细胞未染色为0分,<10%为1分,10%~49%为2分,50%~80%为3分,>80%为4分。将每张切片着色程度得分和阳性细胞百分率得分相乘即为最后得分,0~1分为阴性(-),2~4分为弱阳性(+),5~7分为阳性(++),8~12分为强阳性(+++);将“-”定为阴性表达,“+”、“++”、“+++”定为阳性表达。
1.3.2总RNA提取与纯化取30 mg胃癌组织和癌旁组织研碎,放入装有175 μL RNA裂解液的离心管中,充分混合后加入350 μL RNA 稀释缓冲液,颠倒3~4次后在70 ℃下孵育3 min;室温下13 000×g离心10 min;取澄清裂解液加入200 μL体积分数95%乙醇,混合后转移到离心柱装配体中,13 000 ×g离心1 min;在离心柱中加600 μL RNA 清洗液后13 000×g离心1 min;随后将50 μL新鲜制备的脱氧核糖核酸酶孵育混合物直接加到离心柱内的膜上;25 ℃下孵育15 min,加入终止液,13 000×g离心1 min;RNA 洗液洗涤2次后用100 μL无核酸酶水洗脱、收集。
1.3.3cDNA的合成取1 μg总RNA、4 μL MgCl2、2 μL 25 mmol·L-1反转录10×缓冲液、2 μL 脱氧核糖核苷三磷酸混合液、0.5 μL 10 mmol·L-1重组核糖核酸酶抑制剂、0.5 μL通用引物、1 μL 禽成髓细胞瘤病毒反转录酶,加无核酸酶超纯水使反转录体系至20 μL,对其进行的反转录程序,混匀快速离心1次,反应程序:42 ℃ 15 min、95 ℃ 5 min、4 ℃ 5 min。反转录的cDNA置于-40 ℃冰箱保存,备用。
1.3.4实时定量荧光PCR法检测胃癌及癌旁组织中XB130mRNA水平PCR体系包括8.2 μL无核水、10 μL PCR反应混合物(含荧光染料)、1 μL cDNA和0.8 μL引物,整个体系为20 μL,95 ℃热启动3 min;95 ℃变性3 s、60 ℃退火、延伸30 s,共40个循环。XB130 RNA引物序列:上游为5′-AGGAAACCCTACTGAAATGCAC-3′,下游为5′-GCACT-CCTCG-TCAATTTCCT-3′。甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)RNA 引物序列:上游为5′-CATGGAGAAGGCTGG-GG-3′,下游为5′-AAAGTTGTCATGGATGA-CC-3′。采用Image-pro plus软件(美国Media Cybernetics公司)对XB130 mRNA表达水平进行分析。
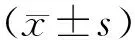
2 结果
2.1胃癌和癌旁组织中XB130蛋白表达比较结果见图1。72例胃癌组织标本中,XB130蛋白阳性表达26例,阴性表达46例,阳性表达率36.1%(26/72);72例癌旁组织标本中,XB130蛋白阳性表达52例,阴性表达20例,阳性表达率72.2%(52/72);胃癌组织中XB130蛋白阳性表达率显著低于癌旁组织(χ2=16.200,P<0.05)。
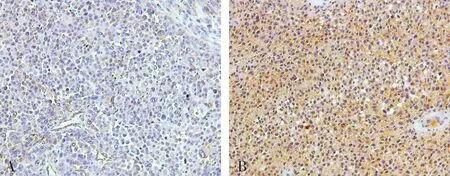
A:胃癌组织;B:癌旁组织。
图1胃癌和癌旁组织中XB130蛋白表达(免疫组织化学,×200)
Fig.1ExpressionofXB130proteiningastriccancertissuesandparacanceroustissues(immunohistochemistry,×200)
2.2XB130蛋白表达与胃癌分化程度、淋巴结转移的关系结果见表1。低、中分化胃癌组织中XB130蛋白阳性表达率显著低于高分化胃癌癌组织(χ2=5.786,P<0.05),有淋巴结转移者胃癌组织中XB130蛋白阳性表达率显著低于无淋巴结转移者(χ2=4.281,P<0.05)。
表1XB130蛋白表达与胃癌分化程度、淋巴结转移的关系
Tab.1RelationshipbetweentheexpressionofXB130proteinandthedifferentiationandlymphnodemetastasisofgastriccancer

病理特征nXB130-/例(%)+/例(%)χ2P分化程度 低、中分化3024(80.0)6(20.0)5.7860.016 高分化4222(52.3)20(47.6)淋巴结转移 有2822(78.6)6(21.4)4.2810.038 无4424(54.5)20(45.5)
2.3胃癌和癌旁组织中XB130mRNA表达比较结果见图2。胃癌组织和癌旁组织中XB130 mRNA相对表达量分别为1.52±0.46、3.28±0.51,胃癌组织中XB130 mRNA表达显著低于癌旁组织(t=-21.744,P<0.05)。
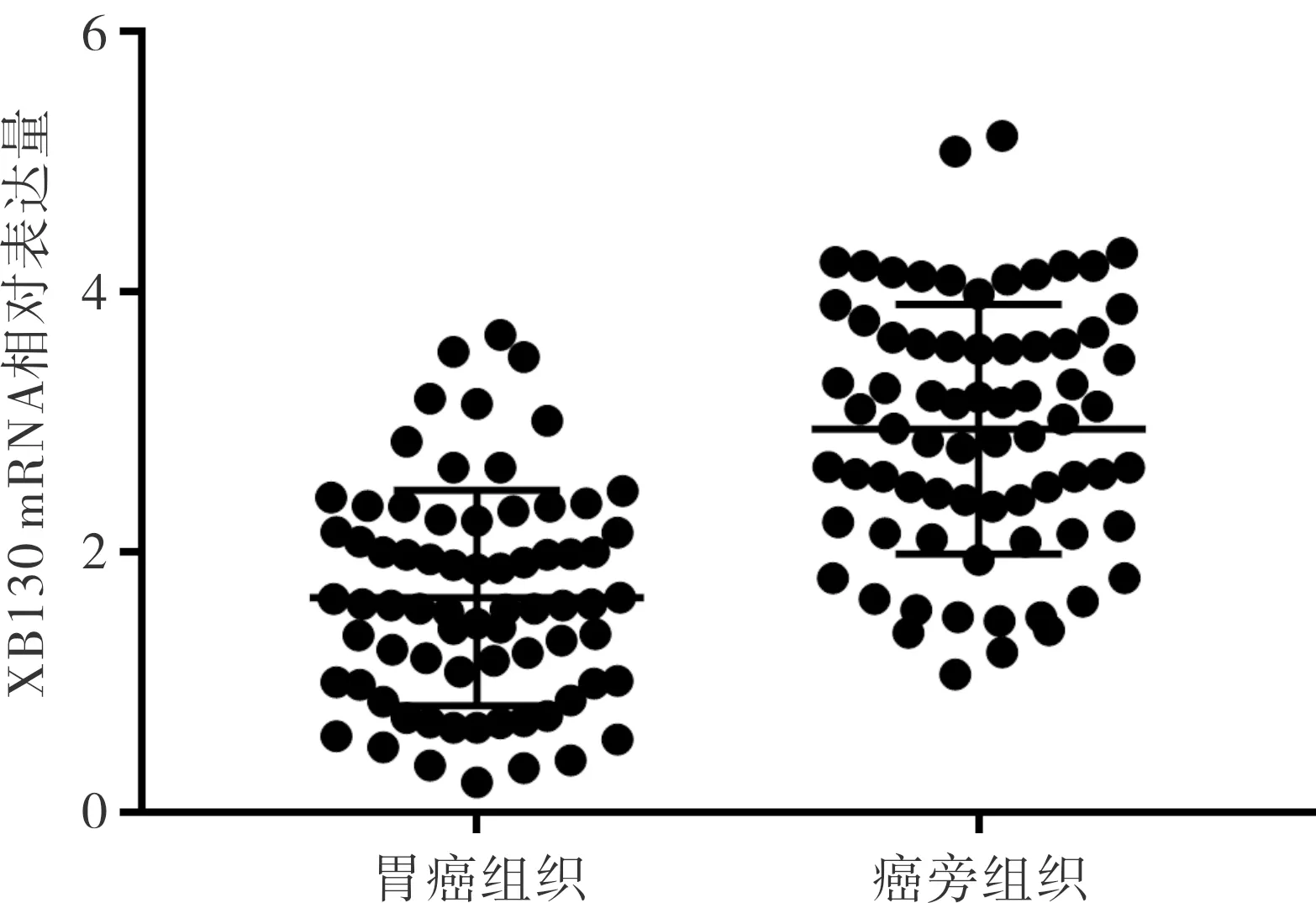
图2胃癌和癌旁组织中XB130mRNA的表达
Fig.2XB130mRNAexpressioningastriccancertissuesandparacanceroustissues
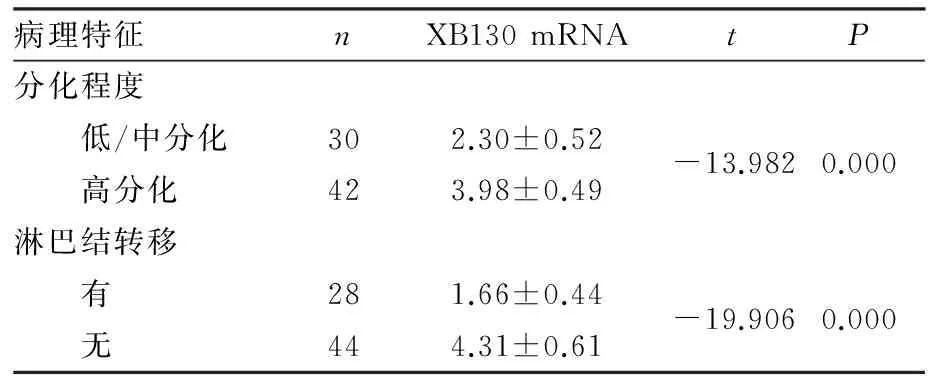
2.4XB130mRNA表达与胃癌临床病理特征的关系结果见表2。高分化胃癌组织中XB130 mRNA表达显著高于低、中分化胃癌组织(P<0.05),有淋巴结转移者胃癌组织中XB130 mRNA表达显著低于无淋巴结转移者(P<0.05)。
表2XB130mRNA表达与胃癌临床病理特征的关系
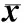
2.5XB130mRNA高表达者与XB130mRNA低表达者生存期比较按照XB130 mRNA表达量中位数2.22进行分组,高表达组36例,低表达组36例。高表达组患者的平均生存期为(37.040±14.826)个月,低表达组患者的平均生存期(21.529±11.789)个月,XB130 mRNA高表达胃癌患者的生存期显著高于XB130低表达患者(t=9.121,P<0.05);见图3。

图3XB130mRNA高表达患者与XB130低表达患者生存期比较
Fig.3ComparisonofthesurvivaltimebetweenthepatientswithhighandlowexpressionofXB130mRNA
3 讨论
胃癌是常见的恶性肿瘤之一,是多因素多阶段发展形成的,在危险环境长期暴露、幽门螺杆菌感染及饮食因素的共同作用下,胃黏膜细胞会产生多种活性因子,使细胞发生氧化应激、炎症损伤,增殖与凋亡之间的平衡被打破,最终形成胃癌组织[6]。目前,已经证实的致癌基因有K-ras、p53、腺瘤性结肠息肉病基因、Bmi-1等[7-10],但对于XB130与胃癌发生发展关系的研究报道较少。本研究旨在探讨胃癌组织和癌旁组织中XB130的表达及其与胃癌分化程度、淋巴结转移及患者生存期的关系,以期为XB130在胃癌的机制研究提供基础数据。
XB130是一种新型接头蛋白,位于染色体10q25.3,编码由818个氨基酸组成的蛋白质,相对分子质量为130 000[3]。研究发现,XB130在人正常甲状腺和脾脏组织中高表达,而在甲状腺癌组织中低表达[11]。XB130可能是原癌基因,在正常组织中表达,可以维持正常细胞自我更新和迁移;同时,还有另外一套调控基因预防正常的细胞过度增殖和分化,当平衡被打破后,细胞增殖转移失控,产生致癌作用[12]。原癌基因经典理论对正常组织中XB130高表达仍然保持“健康”做出了合理接受,众所周知,基因和信号通路发挥致癌性或致病性作用依赖于上下分子的调控,所以同一基因可能会在不同组织类型的癌症或癌症的不同阶段中发挥不同的作用[13-14]。有研究对应用氟尿嘧啶治疗的胃癌患者进行检测,发现XB130的下调会降低氟尿嘧啶敏感性,XB130低表达患者的预后较差,XB130高表达患者的生存率高于低表达患者,XB130可能是通过调控细胞增殖、细胞周期及转录通路发挥作用[15-16]。
本研究结果显示,胃癌组织中XB130 蛋白和mRNA表达显著低于癌旁组织;低、中分化腺癌组织中XB130表达低于高分化腺癌组织,伴有淋巴结转移的胃癌组织中XB130表达低于未伴有淋巴结转移者;XB130高表达者生存期长于XB130低表达者。以上结果表明,XB130在胃癌发生、发展过程中可能发挥了抑制作用,胃癌的转移及患者预后与XB130表达水平密切相关。
综上所述,XB130可能参与了胃癌的发生和发展过程,调控XB130的表达有望成为胃癌靶向治疗的新位点。
[1] KUROKAWA Y,YANG H K,CHO H,etal.Phase Ⅱ study of neoadjuvant imatinib in large gastrointestinal stromal tumours of the stomach[J].BrJCancer,2017,117(1):25-32.
[2] SHIOZAKI A,LODYGA M,BAI X H,etal.XB130,a novel adaptor protein,promotes thyroid tumor growth[J].AmJPathol,2011,178(1):391-401.
[3] XU J,BAI X H,LODYGA M,etal.XB130,a novel adaptor protein for signal transduction[J].JBiolChem,2007,282(22):16401-16412.
[4] LODYGA M,BAI X H,KAPUS A,etal.Adaptor protein XB130 is a Rac-controlled component of lamellipodia that regulates cell motility and invasion[J].JCellSci,2010,123(Pt 23):4156-4169.
[5] LODYGA M,DE FALCO V,BAI X H,etal.XB130,a tissue-specific adaptor protein that couples the RET/PTC oncogenic kinase to PI3-kinase pathway[J].Oncogene,2009,28(7):937-949.
[6] BORDA F,MIRANDA C,BORDA A,etal.Relation between preoperative prognostic onodera′s index and postsurgery complications in the R0 gastric carcinoma resection[J].AnSistSanitNavar,2017,40(1):67-75.
[7] SZKARADKIEWICZ A,KARPINSKI T M,MAJEWSKI J,etal.The participation of p53 and bcl-2 proteins in gastric carcinomas associated with helicobacterpylori and/or epstein-barr virus (EBV)[J].PolJMicrobiol,2015,64(3):211-216.
[8] OKUMURA T,ERICKSEN R E,TAKAISHI S,etal.K-ras mutation targeted to gastric tissue progenitor cells results in chronic inflammation,an altered microenvironment,and progression to intraepithelial neoplasia[J].CancerRes,2010,70(21):8435-8445.
[9] VAN AALST S,LUDWIG I S,VAN KOOTEN P J,etal.Dynamics of APC recruitment at the site of injection following injection of vaccine adjuvants[J].Vaccine,2017,35(12):1622-1629.
[10] LI X,ZHENG X,XU B,etal.Lower Bmi-1 expression may predict longer survival of colon cancer patients[J].CellPhysiolBiochem,2016,39(6):2421-2426.
[11] LIU X,CAI H,HUANG H,etal.The prognostic significance of apoptosis-related biological markers in Chinese gastric cancer patients[J].PLoSOne,2011,6(12):e29670.
[12] ZHANG J,CHEN Y H,LU Q.Pro-oncogenic and anti-oncogenic pathways:opportunities and challenges of cancer therapy[J].FutureOncol,2010,6(4):587-603.
[13] DAMM K.ErbA:tumor suppressor turned oncogene[J].FASEBJ,1993,7(10):904-909.
[14] JOHNSON D G.The paradox of E2F1:oncogene and tumor suppressor gene[J].MolCarcinog,2000,27(3):151-157.
[15] SHI M,HUANG W,LIN L,etal.Silencing of XB130 is associated with both the prognosis and chemosensitivity of gastric cancer[J].PLoSOne,2012,7(8):e41660.
[16] LIU X,WANG S,XIA X,etal.Synergistic role between p53 and JWA:prognostic and predictive biomarkers in gastric cancer[J].PLoSOne,2012,7(12):e52348.

