利用BmNPV-家蚕表达系统包装重组腺相关病毒2型(rAAV2)研究
鲁 念, 刘兴健, 胡小元, 李轶女, 易咏竹, 张志芳*
1.中国农业科学院生物技术研究所, 北京 100081; 2.中国农业科学院蚕业研究所, 江苏 镇江 212018
腺相关病毒(adeno-associated virus,AAV)是无包膜的单链DNA(single-strand DNA,ssDNA)病毒,直径为18~25 nm。到目前为止,研究人员发现其至少有120种新血清型,其中,已经从人类和灵长类中分离鉴定到的血清型有12种[1]。
AAV主要由反向末端重复序列(inverted terminal repeat sequences,ITRs)、复制基因(rep)和衣壳基因(cap)3个结构基因构成。ITRs折叠形成发卡结构,是AAV复制、包装、整合所需的唯一的顺式作用元件,在病毒粒子转染细胞时可能起到稳定病毒基因组的作用;rep编码的蛋白质可将AAV基因组从宿主染色体上切割下来,并调节基因组的复制、整合和包装;而cap编码的3个衣壳蛋白(VP1、VP2和VP3)[2]可自组装成无包膜的二十面体病毒衣壳。
AAV最早于19世纪60年代从腺病毒中被分离出来,并通过血清学等分析方法将其归纳到细小病毒科(Prvovirdae)依赖病毒属(Dependovirus)。1984年,作为病毒载体, AAV首次被用于哺乳动物细胞中表达外源基因[3]。因为AAV具有安全性高(至今未发现其对人具有致病作用)、特异性强(有数十种血清型,不同血清型对不同器官具有特异识别感染能力)、扩散性强(具有远高于腺病毒和慢病毒的扩散性)、免疫原性低(感染不同组织时几乎不会被免疫系统清除)、感染谱广(可感染分裂期和静止期的细胞)等优点[4],使其逐渐成为基因治疗中最常用的病毒载体。
AAV包装一般是在人源或哺乳动物来源的细胞以及昆虫细胞中实现的[5]。如在人胚胎肾细胞(HEK293T)中,先将含有rep、cap基因的质粒pHelper和含有目的基因的质粒pAAV转染进入细胞,再通过辅助病毒诱导得到目的rAAV。该方法获得rAAV的生产效率最高只能达到104vg/cell[6]。为了得到足够用于临床试验的rAAV,至少需要培养5 000瓶175 cm2细胞瓶的细胞[7],且操作较为复杂,在实际应用中难以实现。另一种方法则是利用杆状病毒-细胞(如AcMNPV-sf细胞)表达系统在昆虫细胞中包装rAAV[8],将包装rAAV所需的基因分别克隆到杆状病毒上,并用这些杆状病毒共同感染草地贪夜蛾(Spodopterafrugiperda)卵巢细胞系Sf9,从而在悬浮培养的昆虫细胞中获得rAAV,用10 L搅拌罐反应器发酵约3 d,其产量达到1.1×1014vg/L[9],该方法较用人源细胞包装的方法便利,但在实际应用中,该方法包装的rAAV单次治愈剂量的标价高达160万美元,由于造价较高,无法实现广泛应用。
BmNPV表达系统也是一种较为常用的杆状病毒表达系统,在重组蛋白表达应用中,5个蚕蛹外源蛋白的表达量就相当于1 L昆虫细胞的表达量[10],而其生产成本比昆虫细胞低几百倍。因此,BmNPV表达系统可以作为生产rAAV的一种经济高效的选择。在家蚕幼虫的血淋巴中各类基因的表达量分别是在sf细胞中表达量的几十倍甚至上百倍。而BmNPV-家蚕表达系统与AcMNPV-sf细胞表达系统相比表达量较高的主要原因是:AcMNPV在sf细胞培养基中的病毒基因组数目通常为108~109vg/mL,即使在高密度发酵的昆虫细胞中也很难超过1010vg/mL,其rAAV的理论包装量也不应该超过这一数值;而BmNPV在每毫升家蚕血淋巴和每克蚕蛹中的病毒基因组数目均能达到1012~1013vg[11],因此用BmNPV-家蚕表达系统包装rAAV的最高理论包装量至少是等体积AcMNPV-sf细胞表达系统的上百倍。此外,家蚕的饲养成本远远低于昆虫细胞的培养成本。综上所述,BmNPV-家蚕表达系统是一个比较理想的生产rAAV的系统。
本研究利用家蚕杆状病毒表达系统来包装含有报告基因的2型 AAV(AAV2)。AAV2是最早用作病毒载体的血清型[3],也是目前为止最适合用做基因治疗载体的血清型[12],大多数基因治疗研究也都是以2型为模型。为了简便研究,本次实验使用的是假型包装载体(pseudotype virus)[13],即这种载体的所有重组基因组都用AAV2型的ITRs和rep基因,只有cap是根据需要选择血清型。因此,不同血清型的物理性质已经足够亲近,使得它们能够用接近2型的条件来生产纯化。
目前并没有使用家蚕杆状病毒表达系统包装rAAV的研究,本次实验首次使用家蚕杆状病毒表达系统包装rAAV,为今后使用单杆状病毒包装rAAV提供了理论基础。
1 材料和方法
1.1 试验材料
1.1.1试验试剂 限制性内切酶、T4 DNA连接酶、荧光素酶检测试剂盒购自Promega公司,Fast pfu购自北京全式金生物技术有限公司,TC100培养基购自Applichem公司,DMEM(高糖)培养基、FBS购自Gibco公司,脂质体购自Invitrogen公司。
1.1.2供试载体、质粒、细胞和病毒 杆状病毒转移载体pVL1393购自Invitrogen公司,病毒复制基因失活拯救型家蚕杆状病毒reBmBac、表达绿色荧光蛋白的重组水泡性口炎病毒(VSV-GFP)均由本实验室保存,大肠杆菌DH10Bac、Top10、家蚕细胞BmN细胞系、人胚胎肾细胞HEK293T细胞系等为本实验室保存。
BmN细胞系的培养和准备:根据Summers和Smith的操作手册[14],用含有FBS的TC100昆虫培养基培养家蚕BmN细胞系,达到合适的密度(106个/mL)后,接种到六孔板中或者35 mm的细胞培养皿上培养8~12 h,用于共转染构建重组病毒。
HEK293T细胞系的培养和准备:用DEME培养基培养HEK293T细胞系,达到合适的密度(106个/mL)后,接种到六孔板中或35 mm的细胞培养皿上培养8~12 h,用于检测包装后的rAAV2病毒活力。
1.1.3AAV2的获得 根据文献报道[15],获得了AAV2病毒的rep2序列(GenBank: AF043303 )、cap2序列(GenBank:AAA42372)。Chen[16]研究发现,将cap2启动子改为polh,研究表明在cap序列中插入一个intron(将家蚕polh启动子序列插入intron序列的第26位碱基)能有效提高蛋白的表达,本研究在rep2序列的第850位碱基、cap2 VP1的第25位碱基后分别插入intron(含家蚕polh)。同时,在启动子序列前插入BglⅡ酶切位点,在cap2序列后插入XbaⅠ,以方便后续进行血清型的替换。在设计完成的rep2序列5′端加上BglⅡ酶切位点和Kozak序列,3′端加上终止密码子、单纯疱疹病毒胸苷激酶(herpes simplex virus thymidine kinase,HSV tk)polyA和XbaⅠ酶切位点;在设计完成的cap2序列5′端加上BamHⅠ酶切位点和Kozak序列,3′端加上终止密码子、牛生长素(bovine growth hormone,BGH)polyA和EcoRⅠ酶切位点。设计完成后交由南京金斯瑞公司进行合成并克隆到pUC-simple载体上,得到pUC-Cap2和pUC-Rep2。
根据文献报道[15],获得了AAV2两端ITRs序列,在ITRs序列中间插入CMV启动子和多克隆位点(multiple cloning site,MCS)。尾端插入猴病毒40(simian virus 40,SV40)polyA,在设计完成的ITRs序列5′端加上EcoR V酶切位点,3′端加上BglⅡ酶切位点。设计完成后交由南京金斯瑞公司进行合成并克隆到pUC-simple载体上,得到pUC-ITRs-MCS。
1.2 含AAV2基因转移载体的构建
将载体pUC-ITRs-MCS用EcoR V-BglⅡ双酶切,琼脂糖凝胶电泳回收目的片段ITRs-MCS,与经同样双酶切处理的转移载体pVL1393用T4 DNA连接酶连接,连接产物转化大肠杆菌Top10感受态细胞,在含有Amp抗生素的LB平板上培养。获得阳性克隆后提取质粒进行酶切鉴定,筛选出连接有相应大小目的片段的克隆,测序鉴定正确后得到转移载体pVL1393-ITRs-MCS。
将载体pUC-Cap2用BglⅡ-EcoRⅠ双酶切,琼脂糖凝胶电泳回收目的片段cap2,与经同样双酶切的转移载体pVL1393用T4连接酶连接,重复上述步骤,测序鉴定正确后获得转移载体pVL-Cap2。
将载体pUC-Rep2用BglⅡ-XbaⅠ双酶切,琼脂糖凝胶电泳回收目的片段rep2,与经同样双酶切的转移载体pVL1393用T4 DNA连接酶连接,重复上述步骤,测序鉴定正确后得到转移载体pVL-Rep2。
EGFP、Luc是两个较为常用的报告基因,由于其表达检测方便、灵敏度高[17],本实验选取这2个基因作为标记基因。EGFP来源于载体pEGFP-N3,Luc来源于载体pGL3-basic。PCR扩增[18]获得基因后分别用BamHⅠ-XbaⅠ和BamHⅠ-EcoRⅠ进行双酶切,琼脂糖凝胶电泳回收目的片段EGFP和Luc,与经同样双酶切处理的转移载体pVL1393-ITRs-MCS用T4连接酶连接,重复上述步骤,测序鉴定正确后得到转移载体pVL-EGFP和pVL-Luc。
1.3 重组杆状病毒的构建
根据失活拯救型reBmBac构建重组病毒的方法[19],将适量的转移载体pVL-Luc、pVL-EGFP、pVL-Cap2、pVL-Rep2分别和纯化的reBmBac病毒DNA共转染BmN细胞系,27℃培养4~5 d,待细胞感染发病并剥落后收集共转染上清液,获得重组病毒reBm-Luc、reBm-EGFP、reBm-Cap2、reBm-Rep2。
1.4 利用杆状病毒在家蚕中包装获得rAAV2
将上述获得的重组家蚕杆状病毒进行纯化并在细胞中进行扩增、病毒鉴定和病毒滴度测定后,将AAV骨架序列的重组病毒(reBm-Rep2、reBm-Cap2)与报告基因的重组病毒reBm-Luc、reBm-EGFP分别按等比例混合后注射感染5龄起家蚕幼虫(105pfu/头),在湿度65%、温度25℃~27℃的条件下培养108~120 h,观察家蚕发病情况并收集含有rAAV2表达产物的蚕血淋巴,于-20℃保存备用。
1.5 重组杆状病毒的PCR鉴定
将重组病毒注射感染正常5龄期基因家蚕幼虫,获得重组杆状病毒表达的蛋白及复制的病毒粒子。提取病蚕血淋巴基因组,以其为模板,设计特定引物(表1),通过PCR鉴定目的片段是否重组到病毒基因组中。PCR扩增体系(50 μL):病毒基因组 1 μL,5×Buffer 10 μL,上下游引物各1 μL,dNTP 1 μL,Fast pfu 1 μL,ddH2O 35 μL。PCR程序:95℃ 5 min;95℃ 30 s,56℃ 30 s,72℃ 30 s,共30个循环;72℃ 5 min。

表1 PCR引物序列Table 1 Sequences of PCR primers.
1.6 家蚕中包装的rAAV2的纯化
将上述实验收集的蚕血淋巴在-80℃和37℃间反复冻融4次,用来破碎细胞;10 000 r/min离心10 min,收集上清即得到rAAV2-EGFP、rAAV2-Luc病毒,60℃加热30 min以灭活杆状病毒,于-80℃保存待进一步纯化。
将收集的含重组腺相关病毒载体的病毒液,重悬于PBS溶液中,加入1/10体积的氯仿,置于37℃摇床中剧烈振荡1 h,利用AAV耐氯仿的特性来去除杂蛋白;加入固体氯化钠至终浓度1 mol/L,振荡溶解,4℃、12 000 r/min离心15 min, 取出上层水相,弃氯仿和沉淀;加PEG8000至终浓度达到10%(w/V),振荡溶解后冰浴静置1 h,用来沉淀rAAV病毒颗粒,随后,11 000 r/min离心15 min,弃上清,用5 mL PBS缓冲液将各离心管管底和管壁上的沉淀吹打洗脱下来合并,再将其分装至1.5 mL 离心管中,加入DNA酶和RNA酶至终浓度为1~2 μg/mL,室温下消化30 min。加等体积的氯仿抽提,4℃、11 000 r/min离心5 min,进一步去除杂蛋白;将纯化的病毒液装入Milipore浓缩柱(3 kDa)中,6 000~7 000 r/min离心,浓缩为500 μL,即为纯化的rAAV2-EGFP和rAAV2-Luc病毒。
1.7 家蚕中包装的rAAV2的生物活性检测
将HEK293T细胞接种到六孔板中(1×105个/孔),取100 μL的rAAV2-EGFP、rAAV2-Luc病毒分别置于接种好的细胞中进行孵育,24~48 h内观察绿色荧光蛋白、荧光素酶的表达情况。
2 结果与分析
2.1 含AAV2基因转移载体的构建
由转移载体pVL-Cap2、pVL-Rep2、pVL-Luc和pVL-EGFP的酶切鉴定结果(图1)可知,pVL-Rep2(BamHⅠ-XbaⅠ)双酶切后约2 500 bp,pVL-Cap2(EcoR V-EcoRⅠ)双酶切后约2 900 bp, pVL-Luc(BamHⅠ-EcoRⅠ)双酶切后约1 700 bp,pVL-EGFP(BamHⅠ-XbaⅠ)双酶切后约730 bp。电泳条带大小与目的片段大小一致,说明目的片段成功插入转移载体中,后续测序也与酶切鉴定结果一致。
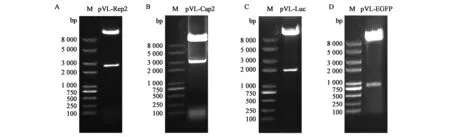
图1 含AAV2基因转移载体的酶切鉴定Fig.1 Restriction enzyme analysis of transfer vector containing AAV2.A:pVL-Rep2酶切(BamHⅠ-XbaⅠ);B:pVL-Cap2酶切(EcoRⅤ-EcoRⅠ);C:pVL-Luc酶切(BamHⅠ-EcoRⅠ);D:pVL-EGFP酶切(BamHⅠ-XbaⅠ);M:DNA marker。
2.2 重组杆状病毒的PCR鉴定
通过同源重组将目的片段cap2、rep2、EGFP和Luc克隆到家蚕杆状病毒基因中,共转染BmN细胞,分别获得reBm-Cap2、reBm-Rep2、reBm-EGFP和reBm-Luc病毒液。如图2所示,在2 900 bp、2 500 bp、730 bp和1 700 bp处扩增出了与目的片段大小一致的4个条带,说明目的片段cap2、rep2、EGFP和Luc成功重组到病毒基因组中,并在家蚕中扩增。
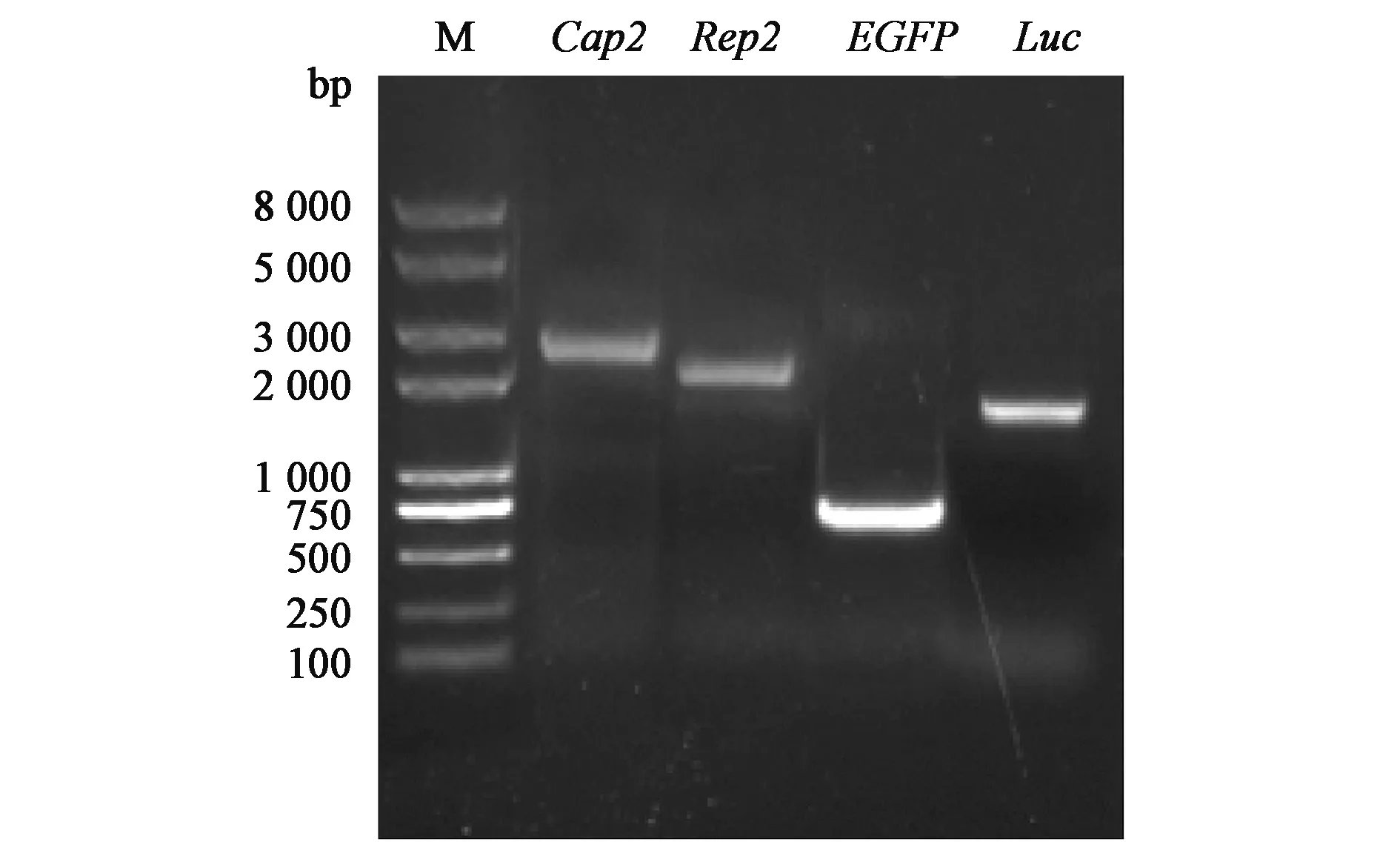
图2 重组杆状病毒感染家蚕中目的基因PCR鉴定Fig.2 PCR identification of targeted genes in recombinant silkworm baculovirus.
2.3 家蚕中包装的rAAV2的生物活性检测
2.3.1家蚕中包装的rAAV2-EGFP在HEK293T细胞中的EGFP表达效果 由图3(彩图见封三图版)可以看出,感染reBm-EGFP的HEK293T细胞,无绿色荧光,说明reBm-EGFP在该纯化过程中已被灭活,不可能产生荧光;感染rAAV2-Luc的HEK293T细胞和正常的HEK293T细胞都无绿色荧光,说明正常状态的HEK293T细胞不会产生荧光,即使感染了携带荧光素酶基因的rAAV2也不会;而感染rAAV2-EGFP的HEK293T细胞有绿色荧光,说明在家蚕中包装的rAAV2具有生物学活性,且在哺乳动物细胞中表达了EGFP,即表明成功用BmNPV-家蚕表达系统包装了rAAV2。
2.3.2家蚕中包装的rAAV2-Luc在HEK293T细胞中Luc表达量的测定 通过比对采用同样方法纯化的rAAV2-Luc和reBm-Luc感染的样品中光量子强度的差别(图4),可以推断出采用氯仿纯化的方法可以灭活reBm-Luc,即表明成功用BmNPV-家蚕表达系统包装了rAAV2。
3 讨论
腺相关病毒是基因治疗中常见的病毒载体,因其具有对人体无害的特性而被广泛研究。AAV2是研究的最透彻的也是目前研究中最适于基因治疗的血清型,目前生产的AAV大多是利用血清2型的rep、ITRs构建的假性载体。2型AAV对骨骼肌、神经元、血管平滑肌和肝脏细胞等都有很好的转染效果。研究还表明,AAV2能够杀死癌细胞而不伤害正常细胞[20]。
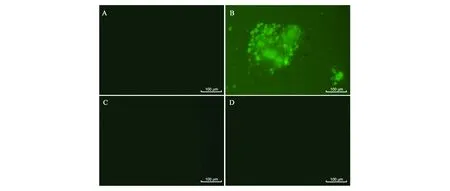
图3 正常HEK293T细胞及其感染纯化rAAV2-EGFP、rAAV2-Luc、reBm-EGFP后的绿色荧光蛋白表达效果Fig.3 The green fluorescent protein expression of HEK293T cells and after infected with rAAV2-EGFP、rAAV2-Luc and reBm-EGFP.A:正常HEK293T细胞;B:感染rAAV2-EGFP的HEK293T细胞;C:感染rAAV2-Luc的HEK293T细胞;D:感染reBm-EGFP的HEK293T细胞。(彩图见封三图版)
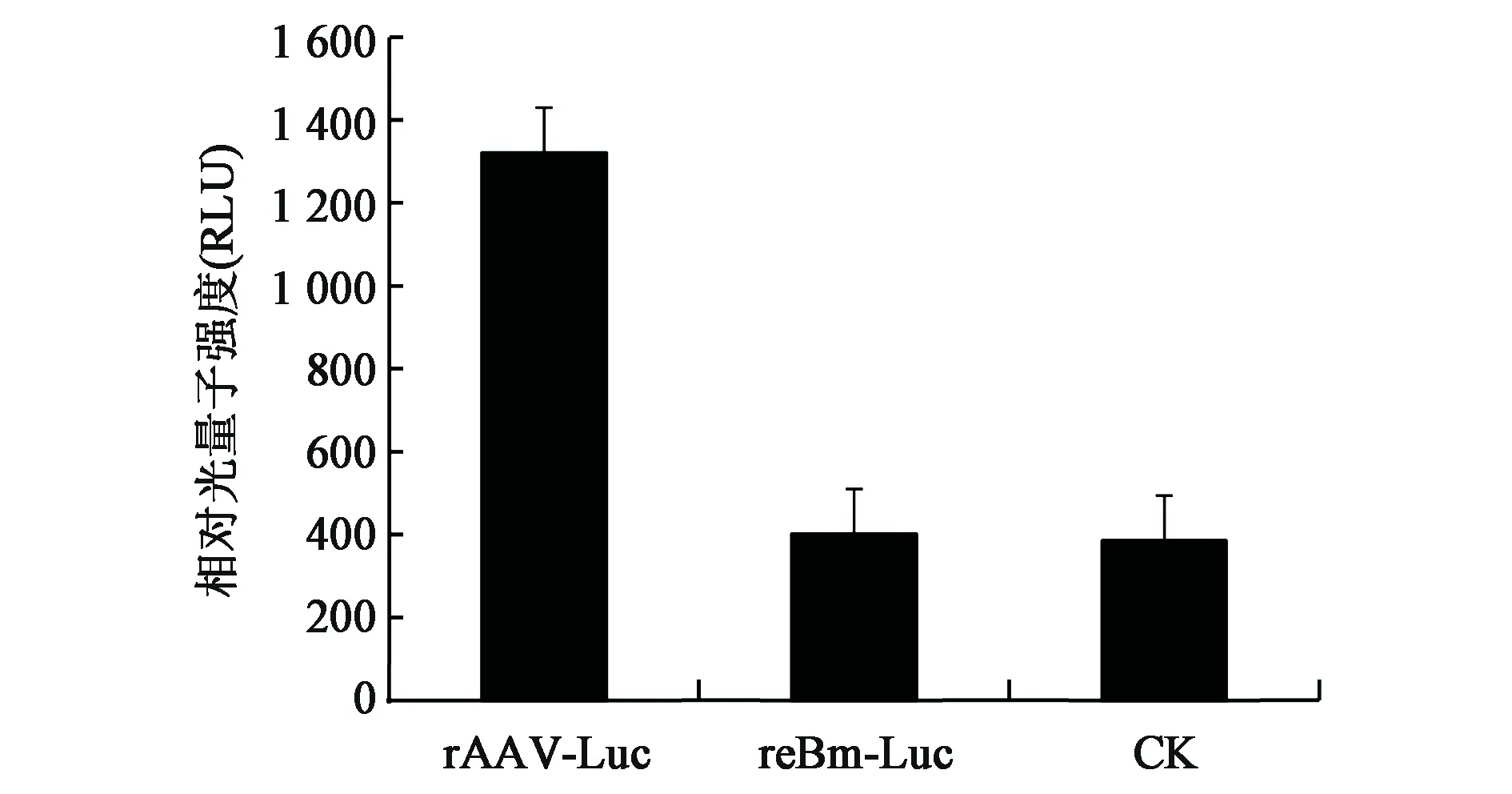
图4 正常HEK293T细胞(CK)及其感染纯化rAAV2-Luc、reBm-Luc后的相对光量子强度Fig.4 Relative light unit of HEK293T cells (CK) and after infected with rAAV2-Luc and reBm-Luc.
目前,科研和实际应用中生产rAAV主要是通过非脊椎动物细胞(昆虫细胞)获得的,用AcMNPV-sf表达系统获得rAAV需要3个重组AcMNPV 载体:rBac-Rep、rBac-Cap和rBac-ITR-GFP-ITR,这3个载体需要同时感染sf细胞用以包装rAAV病毒,利用该方法包装获得的rAAV病毒量为104~105vg/cell。而本实验使用的是BmNPV-家蚕表达系统,结果表明,利用家蚕杆状病毒表达系统也可以实现rAAV2的包装,且根据EGFP和Luc的表达结果,验证了使用此方法包装获得的rAAV2具有感染哺乳动物细胞并驱动目的基因表达的能力。利用该表达系统,理论上在每毫升家蚕血淋巴和每克蚕蛹中的病毒基因组数目均能达到1012~1013vg,大大降低了rAAV的包装成本,进而降低了临床实验和应用的成本,即其具有AcMNPV-sf表达系统的优点同时表达量更高,且生产成本低几百倍[21]。因此,用BmNPV-家蚕系统包装rAAV也有可能获得比昆虫细胞高得多的产量,是一个比较理想的生产rAAV的系统。但与sf细胞相比,由于家蚕含有较多的非目的蛋白,所以其纯化过程会更加繁琐,即在实际操作中,使用氯仿纯化的方法会降低rAAV表达量。
目前尚无利用家蚕表达系统包装rAAV的相关报道。本次实验证明了rAAV能够在家蚕表达系统中表达,为后续用单家蚕杆状病毒包装rAAV,从而实现其大规模的生产,提供了理论基础。但本研究中所用的三载体表达包装策略的效率较单载体策略要低很多,且后续包装操作方法较为繁琐。2012年,Galibert等[22]开发出了单杆状病毒包装系统,将rep、cap基因和目的基因表达盒分别插入AcMNPV基因组的egt和polyhedrin基因等位点,构建一个重组杆状病毒,这样用一个重组病毒即可制备出rAAV载体。与三载体和双载体体系相比,单载体策略的表达量显著提高,是双载体系统的6倍以上、三载体系统的60倍以上,且其稳定性也有提高。以后研究使用家蚕杆状病毒包装rAAV时,可参考Galibert等[22],用单家蚕杆状病毒来包装rAAV,从而获得更高的包装效率。
[1] Gao G, Alvira M R, Somanathan S,etal.. Adeno-associated viruses undergo substantial evolution in primates during natural infections[J]. Proc. Natl. Acad. Sci. USA, 2003, 100(10): 6081-6086.
[2] Kitts P A, Possee R D. A method for producing recombinant baculovirus expression vectors at high frequency[J]. Biotechniques, 1993, 14(5):810-817.
[3] Tratschin J D, West M H P, Sandbank T,etal.. A human parvovirus, adeno-associated virus as a eukaryotic vector: Transient expression and encapsidation of the prokaryotic gene for chloramphenicol acetyl transferase[J]. Mol. Cell Biol., 1984, 4: 2072-2081.
[4] Bohenzky R A, Lefebvre R B, Berns K I. Sequence and symmetry requirements within the internal palindromic sequences of the adeno-associated virus terminal repeat[J]. Virology, 1988, 166 (2): 316-327.
[5] Carter B. Adeno-associated virus and the development of adeno-associated virus vectors: A historical perspective[J]. Mol. Ther., 2004, 10 (6): 981-989.
[6] Booth M J, Mistry A, Li X,etal.. Transfection-free and scalable recombinant AAV vector production using HSV/AAV hybrids[J]. Gene Ther., 2004, 11(10): 829-837.
[7] Chadeuf G, Salvetti A. Stable producer cell lines for adeno-associated virus (AAV) assembly[J]. Cold Spring Harb. Protoc., 2010, doi:10.1101/pdb.prot5496.
[8] Urabe M, Ding C, Kotin R M. Insect cells as a factory to produce adeno-associated virus type 2 vectors[J]. Hum. Gene Ther., 2002, 13(16): 1935-1943.
[9] Smith R H, Levy J R, Kotin R M. A simplified baculovirus-AAV expression vector system coupled with one-step affinity purification yields high-titer rAAV stocks from insect cells[J]. Mol. Ther., 2009, 17(11): 1888-1896.
[10] Yin X, Li Z, Li J,etal.. Rabies virus nucleoprotein expressed in silkworm pupae at high-levels and evaluation of immune responses in mice[J]. J. Biotechnol., 2013, 163(3): 333-338.
[11] 张志芳, 李轶女, 易咏竹. 表达多外源基因的昆虫生物反应器及其构建方法和应用[P]. 中国: CN102286534A, 2011-12-21.
[12] Samulski R J, Chang L S, Shenk T. A recombinant plasmid from which an infectious adeno-associated virus genome can be excisedinvitroand its use to study viral replication[J]. J. Virol., 1987, 61(10): 3096-3101.
[13] Wistuba A, Kern A, Weger S,etal.. Subcellular compartmentalization of adeno-associated virus type 2 assembly[J]. J. Virol., 1997, 71(2): 1341-1352.
[14] Summers M D, Smith G E. A manual of methods for baculovirus vectors and insect cell culture procedures[M]. USA: Texas A&M University Press, 1987.
[15] Qiu J, Pintel D J. Alternative polyadenylation of adeno-associated virus type 5 RNA within an internal intron is governed by the distance between the promoter and the intron and is inhibited by U1 small nuclear RNP binding to the intervening donor[J]. J. Biol. Chem., 2004, 279(15): 14889-14898.
[16] Chen H. Intron splicing-mediated expression of AAV rep and cap genes and production of AAV vectors in insect cells[J]. Mol. Ther., 2008, 16(5): 924-930.
[17] Vesuna F, Winnard J P, Raman V. Enhanced green fluorescent protein as an alternative control reporter toRenillaluciferase[J]. Anal. Biochem., 2005, 342(2): 345-347.
[18] Liu X J, Li Y N, Hu X Y,etal.. Gene delivery and gene expression in vertebrate using baculovirusBombyxmorinucleopolyhedrovirus vector [J]. Oncotarget, 2017,8(62):106017-106025.
[19] King J A, Dubielzig R, Grimm D,etal.. DNA helicase-mediated packaging of adeno-associated virus type 2 genomes into preformed capsids[J]. EMBO J., 2001, 20(12): 3282-3291.
[20] Weitzman M D, Linden M R. Adeno-associated virus: Methods and protocols[M]. Berlin: Springer, 2011,2-15.
[21] Usami A, Ishiyama S, Enomoto C,etal.. Comparison of recombinant protein expression in a baculovirus system in insect cells (Sf9) and silkworm[J]. J. Biochem., 2010, 149(2): 219-227.
[22] Galibert L, Merten O W, Jacob A. Baculovirus system for the expression of a gene therapy vector [P]. FR: WO2013014400A1, 2013-01-31.

