淫羊藿苷对大鼠精子质量和精核蛋白作用的影响*
葛 斌,石 燕,王露娟(遵义医学院附属医院生殖中心,贵州遵义563000)
雄性生殖系统损害导致的不育症已普遍受到国内外学者关注[1]。精核蛋白(TNBP)是一种与雄性生育能力密切相关的碱性蛋白质,大鼠精核蛋白(RP)含量在反映精子质量方面有着重要意义[2]。淫羊藿苷(ICA)作为一种传统中药,可以抑制生精细胞凋亡、促进睾酮分泌并提高阴茎海绵体鸟苷环磷酸(cGMP)水平。本研究通过观察不同剂量ICA对大鼠精子质量和TNBP表达的影响,探索ICA在治疗不育症中的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性SD大鼠80只,体重210~235 g,由第三军医大学附属大坪医院动物中心提供。合格证编号:20150017,饲养于遵义医学院实验动物中心,温度:25℃,湿度:50%。
1.1.2 实验试剂 腺嘌呤由上海远幕生物科技有限公司提供;ICA由南京泽朗生物有限公司提供,纯度大于或等于98%。
1.1.3 分组 将80只雄性SD大鼠随机分为对照组、模型组、ICA低剂量组、ICA高剂量组,每组20只。
1.2 方法
1.2.1 建立模型 对照组:蒸馏水3 mL灌胃60 d;模型组:腺嘌呤25 mg/100 g和用蒸馏水3 mL配置后灌胃30 d,再以蒸馏水3 mL灌胃30 d;ICA低剂量组:先用腺嘌呤25 mg/100 g和蒸馏水3 mL配置后灌胃30 d,再以ICA 1.8 g/kg和蒸馏水3 mL配置后灌胃30 d;ICA高剂量组:先用腺嘌呤25 mg/100 g和蒸馏水3mL配置后灌胃30d,再以ICA3.6g/kg和蒸馏水3 mL配置后灌胃30 d。
1.2.2 附睾精液采集和测定 按照文献[3]方法处死大鼠、采集精液,在37℃恒温水浴箱液化10 min后置于精子全自动分析仪上测定。
1.2.3 精子碱性蛋白提取及电泳 按照文献[2]方法提取碱性蛋白,在酸性-尿酸系统中进行电泳分析,结果扫描测量条带数值,总碱性蛋白(TH)/RP比值代表TNBP相应含量。
1.2.4 观察指标 精子密度:每毫升精液的精子数;精子活率:活动精子/精子总数;精子活力:前向运动精子数/精子总数;TNBP相应含量:TH/RP。
1.3 统计学处理 应用SPSS11.0统计软件进行数据分析,计量资料以表示,采用t检验;计数资料以率或构成比表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠精子质量比较 模型组、ICA低剂量、ICA高剂量组精子密度、活率和活力均显著低于对照组,差异均有统计学意义(P<0.05);ICA低剂量组大鼠精子密度和活力与模型组比较,差异均无统计学意义(P>0.05);ICA高剂量组活率和活力均显著高于模型组,差异均有统计学意义(P<0.05),精子密度与模型组比较,差异无统计学意义(P>0.05)。见表1。
表1 各组大鼠精子质量比较(±s)
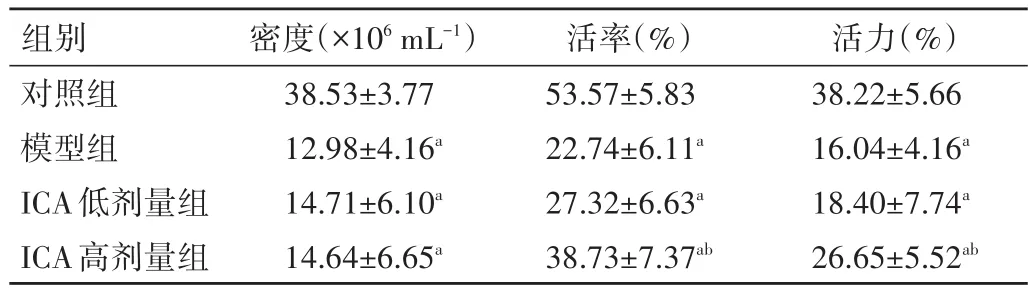
表1 各组大鼠精子质量比较(±s)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05
组别对照组模型组ICA低剂量组ICA高剂量组活力(%)38.22±5.66 16.04±4.16a 18.40±7.74a 26.65±5.52ab密度(×106mL-1)38.53±3.77 12.98±4.16a 14.71±6.10a 14.64±6.65a活率(%)53.57±5.83 22.74±6.11a 27.32±6.63a 38.73±7.37ab
2.2 各组大鼠TNBP含量比较 模型组和ICA低剂量组、ICA高剂量组TH、TH/RP值均显著高于对照组,RP值显著低于对照组,差异均有统计学意义(P<0.05);ICA高剂量组TH、TH/RP值均显著低于模型组,RP值显著高于模型组,差异均有统计学意义(P<0.05)。见表2。
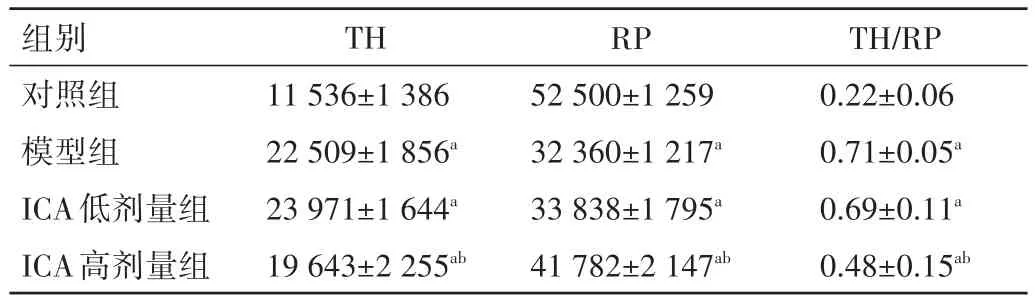
表2 各组大鼠TNBP含量比较(x±s)
3 讨 论
目前,男性不育患者发病率呈上升趋势,近20年来,人类精子数量平均每年以2%的速度下降。不育不仅影响患者的身心健康,而且还会带来一些社会问题,因此,男性不育症的研究已经引起全世界的高度重视。
腺嘌呤可损伤睾丸组织、曲精小管,并导致生精细胞和TNBP数量减少、变性,常用于构建睾丸损伤大鼠模型[3]。本实验发现,腺嘌呤大鼠模型无论是精子密度、活力、活率和TNBP均显著低于对照组,说明模型建立比较成功。
TNBP又称鱼精蛋白,是在晚期精子细胞中出现的一类富含精氨酸和半胱氨酸的碱性蛋白质。根据氨基酸的组成序列可分为两类,一类是P1TNBP,存在于所有哺乳动物精子细胞中;另一类为P2TNBP,只存在于人类及很少一部分哺乳动物中。TNBP主要功能是浓缩精子细胞核,保护DNA的遗传信息。
近年研究发现,精子细胞内组蛋白-精核蛋白反应(HPRR)和TNBP的数量与生育能力有密切关系[4-5]。哺乳动物精子从精原细胞发育为成熟精子的过程中,精子细胞内与DNA结合体细胞类型组蛋白,逐渐被TNBP取代,这个过程称HPRR,通过HPRR,最终成为高浓度的精子特异性染色质。成熟精子内的碱性核蛋白主要为TNBP[6]。WU等[7]研究发现,钙调素依赖蛋白激酶4(Camk4)的信使作用与TNBP的转化有关。1976年,SILVESTRONI等[8]首次报道15例少精子症不育患者的成熟精子缺乏TNBP成分,认为这是导致原发性不育症的原因之一。CARRELL等[9]的研究也发现,P2精核蛋白异常与生育力减退有关。DE YEBRA等[10]报道,116例男性少弱精症患者TNBP异常率为77.5%,且有些患者P2 TNBP完全缺失。陈晖等[11]对1 050例少弱精症患者TNBP分析提示,异常率为81.05%,认为男性TNBP指标可供临床评价精子受孕能力。费江枫等[12]研究发现,腺嘌呤诱导的不育大鼠精子中TNBP及其mRNA含量明显低于正常组。
ICA为淫羊藿的干燥茎叶提取物,是淫羊藿的主要有效成分之一。研究表明,ICA在心脑血管系统、生殖系统、骨骼系统、免疫系统和肿瘤中具有重要的药理作用。李波等[13]发现,ICA可使动物睾酮水平升高,并调控下丘脑CHR和垂体POMC基因的表达水平,说明ICA对生殖系统的影响主要在下丘脑和垂体组织。高学勇等[14]研究发现,ICA能促进幼年小鼠附睾及精囊的发育。覃光辉等[15]研究发现,ICA能明显改善雷公藤多苷对小鼠睾丸的病理损伤,与模型组相比,治疗组小鼠睾丸生精管管壁较厚,细胞层次较宽,细胞增殖旺盛。高孟婷等[16]应用125I放射免疫法测定不同浓度ICA对家兔阴茎海绵体内PDE5酶底物cGMP水平的影响。结果显示,ICA能提高阴茎海绵体内cGMP水平。蒋兆健等[17]也采用125I放射免疫法观察ICA对家兔阴茎海绵体平滑肌组织中cGMP水平的影响,结果显示,ICA能直接升高cGMP水平。钟瑜等[18]制备肾阳虚细胞模型,观察ICA干预后糖皮质激素受体(GR)的mRNA和蛋白的表达情况。结果显示,经ICA干预后的GR mRNA和蛋白表达均明显增加。表明ICA对内分泌系统的作用明显。另外,ICA对性腺还有较大的影响作用。赵翌等[19]通过在获能液mTBM+肝素中添加ICA,利用金霉素荧光染色法结合体外受精试验,观察新鲜猪精子的体外获能效果,结果表明,ICA能够显著促进猪精子体外获能效果。
本研究发现,ICA高剂量组能显著提高模型大鼠的精子活率、活力、RP值,说明ICA可促进精子获能、提高TNBP含量;但是本研究也发现,ICA不能提高精子密度,而且ICA高剂量组虽然可以有效改善大鼠精子的活率、活力和TNBP含量,但仍然低于对照组。分析原因可能与用药时间短和样本量少有关,下一步拟扩大样本量、进一步延长用药时间进行研究。
综上所述,ICA作为一种传统中药,可通过提高RP值和精子活率来有效改善雄性生殖功能。
[1]李俊涛,曲晓伟,张蜀武,等.益肾生精胶囊对邻苯二甲酸二丁酯致生殖功能损伤大鼠精子质量及生殖激素水平的影响[J].中华男科学杂志,2016,22(12):1110-1115.
[2]葛斌,杨智敏,路健,等.重度畸形精子症患者精核蛋白表达的研究[J].现代医药卫生,2015,31(6):818-819.
[3]王旭初,潘天明.四子种王胶囊治疗雄性不育大鼠实验研究[J].河北中医,2011,33(2):269-271.
[4]潘天明.少弱精症与精核蛋白的关系研究进展[J].现代中西医结合杂志,2010,19(33):4358-4360.
[5]OLIVA R,DIXON GH.Vertebrate protamine genes and the histone-toprotamine replacement reaction[J].Prog Nucleic Acid Res Mol Biol,1991,40:25-94.
[6]王旭初.男性不育与精核蛋白的关系及中西医治疗进展[J].光明中医,2012,27(12):2614-2616.
[7]WU JY,RIBAR TJ,CUMMINGS DE,et al.Spermiogenesis and exchange of basic nuclear proteins are impaired in male germ cells lacking Camk4[J].Nat G enet,2000,25(4):448-452.
[8]SILVESTRONI L,FRAJESE G,FABRIZIO M.Histones instead of protamines in terminal germ cells of infertile,oligospermic men[J].Fertil Steril,1976,27(12):1428-1437.
[9]CARRELL DT,LIU L.Heparin binding sites are present at a higher concentration on sperm of subfertile men than donors of known fertility[J].Arch Androl,2002,48(2):147-154.
[10]DE YEBRA L,BALLESCÀ JL,VANRELL JA,et al.Complete selective absence of protamine in humans[J].J Bio Chem,1993,268(14):10553-10557.
[11]陈晖,陈松,费江枫,等.1050例不育男性精子碱性核蛋白的分析[J].生殖医学杂志,2005,14(3):135-138.
[12]费江枫,李海松,陈晖.腺嘌呤诱导不育大鼠精子中精蛋白mRNA的研究[J].生殖与避孕,2003,23(2):65-68.
[13]李波,安睿,王新宏,等.淫羊藿苷和补肾复方对肾阳虚大鼠下丘脑CRH基因和垂体POMC基因表达的影响[J].中成药,2008,30(1):132-134.
[14]高学勇,王玮.淫羊藿苷对环磷酰胺诱导生精障碍大鼠睾丸的影响[J].中外医疗,2009,28(17):19.
[15]覃光辉,姚重华,王骁,等.不同剂量淫羊藿苷对雷公藤多苷模型小鼠睾丸病理损伤的影响[J].中国中医药现代远程教育,2014,12(2):156-158.
[16]高孟婷,马芳芳,吴少辉,等.淫羊藿苷的药理作用研究进展[J].安徽农业科学,2012,40(18):9623-9625.
[17]蒋兆健,胡本容,付琴,等.淫羊藿苷对家兔阴茎海绵体环核苷酸水平的影响[J].华中科技大学学报(医学版),2007,36(2):166-168.
[18]钟瑜,李晓清,徐晓玉,等.淫羊藿苷对肾阳虚细胞糖皮质激素受体表达影响的研究[J].中国药房,2007,18(36):2801-2803.
[19]赵翌,徐捷,相荣科,等.β-谷甾醇、淫羊藿苷对猪精子体外获能效果的影响[J].中国兽医学报,2010,30(7):996-999.

