清燥救肺汤及其分解剂对肺炎支原体感染小鼠肺部炎症相关因子的影响
吴振起,敏娜,岳志军,杨璐,王雪峰,杨慧
(1.辽宁中医药大学附属医院,沈阳 110032; 2.辽宁中医药大学研究生学院,沈阳 110847)
Conflict of interest statement: We declare that we have no conflict of interest statement
肺炎支原体 (mycoplasmapneumoniae,MP) 是一种介于病毒与细菌之间的非活性微生物,是儿童社区获得性肺炎的主要病原体,20%~40%的呼吸道感染均由MP感染所致[1]。其致病机制主要是对气道上皮细胞的黏附作用,产生氧化应激并释放CARDS毒素,导致气道损伤[2]。肺炎支原体肺炎(MP pneumonia,MPP)其临床特征性症状“干咳”,恰如燥邪伤肺所致,可见头痛身热,干咳无痰,气逆而喘,咽喉干燥等症。治燥经典名方清燥救肺汤(Qingzao Jiufei decoction,QJD)具有清肺润燥,益气养阴的功效,用于治疗临床上小儿MP感染后燥热伤肺之证,在临床上已取得较好的疗效[3]。前期的实验研究已发现QJD具有抗MP作用[4],为探寻QJD的起效组份,对其进行了拆方研究。根据药物的功效特点,将QJD拆解成含有“宣、清、降”法的分解I组和含有“润、补”法的分解II组,试图从炎症、细胞毒素、黏附蛋白表达及水通道蛋白等方面,来探讨QJD及其分解剂控制MP感染所致肺部炎症的作用机理。
1 材料与方法
1.1 材料
1.1.1 实验动物
4~6 周龄SPF级BALB/c小鼠144只,体重(20±2)g,雌雄各半,购于辽宁长生生物技术有限公司【SCXK(辽)2013-0009】,饲养于辽宁中医药大学实验动物中【SYXK(辽)2015-0001】。水和饲料经高温高压消毒后使用。饲养环境:室温20~22℃,湿度 (50±2)%,12 h/12 h明暗周期,分笼饲养。
1.1.2 病毒株
MP标准株FH,由辽宁中医药大学附属医院病毒室保存。
1.1.3 实验药品及制备
药物组成:QJD全方组:人参21 g、阿胶21 g、麦门冬36 g、杏仁21 g、石膏36 g、甘草30 g、桑叶90 g、枇杷叶30 g、胡麻仁30 g;分解剂I组:杏仁21 g、石膏36 g、桑叶90 g、枇杷叶30 g;分解剂II组:人参21 g、阿胶21 g、麦门冬36 g、甘草30 g、胡麻仁30 g,由辽宁中医药大学附属医院门诊中草药局提供,经辽宁中医药大学中药分析教研室鉴定为正品。供试药液的配制:石膏水煎浓缩,阿胶烽化,药液备用;余药用8倍量70%乙醇加热回流提取2次,合并药液,回收溶剂并浓缩,分别制成含生药1、0.61、0.39 g/mL混悬液。阿奇霉素分散片(东北制药,批号:4170201),配成6 mg/mL药液。每组药液分别4℃保存备用。
1.1.4 试剂与仪器
Trizol总RNA提取试剂(Invitrogen,1203406),RT-PCR试剂盒(TaKaRa,Bk2701),DEPC(TaKaRa,BBI0916S03),DNA marker DL2000(TaKaRa,CB3301),TNF-α ELISA试剂盒(BOSTER,982354956),INF-γ ELISA试剂盒(BOSTER,971335616),AQP5(BOSTER,287487),GAPDH(BOSTER,14MA18),ECMⅡof Western Blotting检测试剂盒浓缩型兔IgG二抗(BOSTER,12J27C),TP1020型自动组织脱水处理机(Leica,德国),EG1150型石蜡包埋机(Leica,德国),RM2135型精密轮转切片机(Leica,德国),BX50F4型显微镜(Olympus),荧光定量PCR仪(LC-Ⅱ,美国),IMark型酶标仪(Thermo,美国),PowerPacTM Universal Power Supply电泳通用型电源(Bio-Rad,美国),Trans-Blot SD半干转印系统(Bio-Rad,美国),FlourChem Q蛋白印记成像系统(Proteinsimple,美国),低温高速离心机 (Heraeus,德国)。
1.2 实验方法
1.2.1 动物分组
将144只BALB/c小鼠按随机数字表法分为6组,正常组(A组)、模型组(B组)、清燥救肺汤组(C组)、分解剂I组(D组)、分解剂II组(E组)及阿奇霉素组(F组),每组24只,对各组小鼠进行标记称重。
1.2.2 模型制备
除A组外,每组小鼠均在乙醚轻度麻醉下,用1 mL注射器缓慢向鼻腔中滴入1×107CCU/mL的MP菌液0.1 mL,连续滴鼻3 d。将正常组小鼠置于无菌同等房间,滴鼻0.1 mL蒸馏水。
1.2.3 给药方法
造模后,C组、D组及E组均给予0.3 mL/只的对应方剂进行灌胃,1次/日,连续14 d;F组,给予每只阿奇霉素0.3 mL,1次/日,灌胃,连续3d,停药4 d,2个循环,停药期间蒸馏水灌胃;A组、B组每只给予0.3 mL蒸馏水灌胃。各组小鼠分别于造模后第3、7、10、14天,给药后禁食、禁水4 h后取材。
1.2.4 光镜下病理组织学观察
用4%多聚甲醛固定的组织包埋成蜡块,切片机切成薄片约5 μm,苏木精-伊红(HE) 染色后在光镜下观察肺组织病理学改变。病理变化程度计分方法依照文献[5]。每个标本取6张切片,每张切片随机取3个视野,用高清晰度 Olympus BX50 系统生物显微镜采集图像,根据计分方法进行分析。
1.2.5 qPCR法MPN372、P1基因含量测定
引物根据文献设计[6],P1上游引物:5′-TGGATTCTCATCCTCACCGCCACC-3′;下游引物:5′-CAATGCCATCACCCGCGCTTAAC C-3′;MPN372上游引物:5′-CAGAAACACCCACAGCTATT-3′;下游引物:5′-CACGTTGATACGCAAAGGAAGT-3′;内参三磷酸甘油醛脱氢酶(GAPDH),G1: 5'ACC ACC ATG GAG AAG GCT GG 3',G2: 5'CTC AGT GTA GCC CAG GAT GC 3',扩增特异片段长度为528 bp,由北京六合华大基因科技股份有限公司合成。将各组小鼠肺组织取出,制造细胞悬液,用Trizol提取细胞总RNA。分析RNA的纯度及完整性,检测RNA质量合格后,进行反转录,以反转录产物为模板,加入MPN372、P1的引物,进行qPCR检测。
1.2.6 血清TNF-α、INF-γ表达水平检测
于感染后第3、7、10、14天取材,摘眼球取血,离心,取上清,存于EP管放于-80℃冷冻以备用。采用双抗体夹心ELISA法,测定小鼠血清中TNF-α、INF-γ表达水平,分别用小鼠TNF-α、INF-γ的ELISA试剂盒。检测程序按照试剂盒说明书进行。
1.2.7 Western blot法检测AQP5蛋白的表达
用总蛋白提取试剂提取总蛋白,离心取上清液,-20℃冰箱中保存。BCA蛋白浓度测定试剂盒测定蛋白浓度,用蒸馏水调整到统一浓度,提取液中加入5× SDS上样缓冲液,100℃变性10 min,蛋白上样每孔含10 μL,10% SDS-聚丙烯酰胺凝胶电泳分离,转膜30 min,2% BSA室温封闭2 h。一抗室温孵育2 h,4℃过夜,TBST每次10 min洗膜(3次),二抗室温孵育1 h,TBST每次10 min洗膜(3次)。ECL发光,Fluor Chem Q蛋白质印迹,成像系统显色。
1.3 统计学分析
2 结果
2.1 小鼠肺指数、干湿比及病理评分
MP感染后,各时间点小鼠肺指数均升高、干湿比降低(P<0.05),如表1所示。与B组比较,第3天C组、F组小鼠肺指数、病理评分降低,C组干湿比升高(P<0.05);第7天各组肺指数、病理评分均降低,干湿比均升高(P<0.05);第10、14天,C组、D组、F组肺指数降低,各组病理评分均降低,干湿比均升高(P<0.05);与C组比较,第3天E组肺指数,第7天D组肺指数、干湿比,第10、14天D组、E组干湿比、病理评分,差异有显著性(P<0.05)。第3天与第14天比较,各组病理评分差异均有显著性(P<0.05),各组肺指数及干湿比差异均无显著性(P>0.05)。
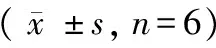
表1 各组小鼠肺指数、干湿比及病理评分Tab.1 Lung index, ratio of dry and wet lung weight, and pathological scores in the mice of each group(±s,n=6)
注:与A组比较,P<0.05;与B组比较,*P<0.05;与C组比较,△P<0.05;第3天与第14天比较,#P<0.05。
Note. Compared with the group A,P<0.05; compared with the group B,*P<0.05; compared with the group C,△P<0.05. Comparison between 3-days and 14-days groups,#P<0.05.
2.2 肺组织光镜病理组织学观察
正常组小鼠肺泡、肺泡囊、肺泡隔形态完整,周围血管未见炎细胞浸润(图1A)。模型组小鼠肺泡、肺泡囊、肺泡管、肺泡隔等结构消失,肺泡间隔增厚,细支气管壁增厚,大量炎症细胞浸润,肺泡壁毛细血管扩张(图1B)。全方组小鼠肺泡内可见少量炎性细胞,支气管粘膜上皮水肿明显减轻(图1C)。分解剂Ⅰ组小鼠可见少量炎性细胞浸润于肺组织,并可见其背膜增厚(图1D)。分解剂Ⅱ组小鼠支气管粘膜上皮水肿明显,较多嗜酸性粒细胞浸润于肺组织(图1E)。阿奇霉素组小鼠可见少量炎性细胞,与模型组相比,炎细胞数量明显减少(图1F)。
2.3 qPCR检测MPN372、P1的mRNA水平
MP感染后,各时间点小鼠肺中MPN372含量均升高,如图2所示。药物干预后,与B组比较,各用药组在第3天开始下降,于第7天显著降低,差异有显著性(P<0.05);与C组比较,在第7天时D组和E组差异有显著性(P<0.05), F组差异无显著性(P>0.05);第10天开始D组和F组差异无显著性(P>0.05), E组差异有显著性(P<0.05);第3天与第14天比较,C、D、F组差异有显著性(P<0.05),B组、E组差异无显著性(P>0.05)。
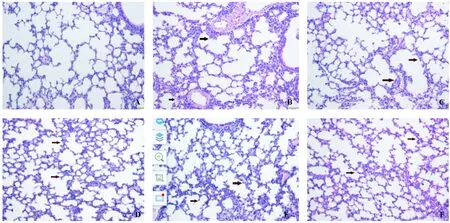
注:A.正常组,B. 模型组,C. 全方组,D.分解 I组,E.分解II组,F.阿奇组。箭头所示:炎症细胞浸润,肺泡间隔增厚,支气管壁增厚。图1 小鼠肺组织光镜病理改变Note.A. Normal group. B. Model group. C. QJD group. D. QJD decomposition agent I group. E. QJD decomposition II group. F. Azithromycin group.Arrow: Inflammatory cell infiltration,alveolar septum thickening,bronchial wall thickening.Fig.1 Pathological changes in the lung tissues of the mice
MP感染后,各时间点小鼠肺中P1含量均升高,如图3所示。药物干预后,与B组比较,各用药组从第7天开始均有显著降低,差异有显著性(P<0.05);与C组比较,在第7天时D组和F组差异无显著性(P>0.05), E组差异有显著性(P<0.05);第14天时,各用药组之间差异均无显著性(P>0.05);第3天与第14天比较,B组差异无显著性(P>0.05),C、D、E、F组差异有显著性(P<0.05)。
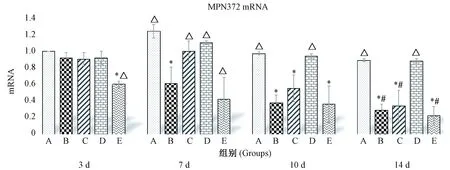
注:A.模型组,B. 全方组,C.分解Ⅰ组, D.分解Ⅱ组,E.阿奇组。与A组比较,*P<0.05;与B组比较,△P<0.05;第3天与第14天比较,#P<0.05。图2 QJD对MP感染小鼠肺组织中MPN372 mRNA水平的影响Note.A.Model group. B. QJD group. C. QJD decomposition agent I group. D. QJD decomposition agent II group. E. Azithromycin group.Compared with the group A, *P<0.05; compared with the group B, △P<0.05. Comparison between the 3-day and 14-day groups, #P<0.05.Fig.2 Effect of QJD on the level of MPN372 mRNA in the lung tissues of MP-infected mice
2.4 小鼠血清中TNF-α、INF-γ含量检测
MP感染后,各时间点小鼠血清中TNF-α含量均显著增高(P<0.05),如表2所示。且于第7天达到峰值,差异有显著性(P<0.05);药物干预后,与B组比较,各用药组于第3天改变不明显(P>0.05),其中E组各时间点改变均不明显,差异无显著性(P>0.05);C组、D组及F组均于造模后第7天开始明显降低,差异有显著性(P<0.05);第3天与第14天比较,C组、F组差异无显著性(P>0.05),B、D、E组差异有显著性(P<0.05)。
MP感染后,各时间点小鼠血清中INF-γ含量出现一过性增高(P<0.05),如表3所示。于第7天达峰值;药物干预后,与B组比较,各用药组各时间点差异均有显著性(P<0.05);与C组比较,D组、E组、F组各时间点差异均有显著性(P<0.05);第3天与第14天比较,各组差异均无显著性(P>0.05)。
2.5 Western blot检测AQP5蛋白表达水平
MP感染后,小鼠肺组织中AQP5蛋白的表达降低(P<0.05),如图4~5所示。与A组比较,B组在第3、7、10天均有显著降低,第14天时逐渐回升;与B组比较,各用药组各时间点均能上调AQP5蛋白表达(P<0.05);与C组比较,各时间点D组和E组均差异有显著性(P<0.05),第7天开始,F组差异无显著性(P>0.05);第3天与第14天比较,B组、C组差异无显著性(P>0.05),D组、E组差异有显著性(P<0.05)。
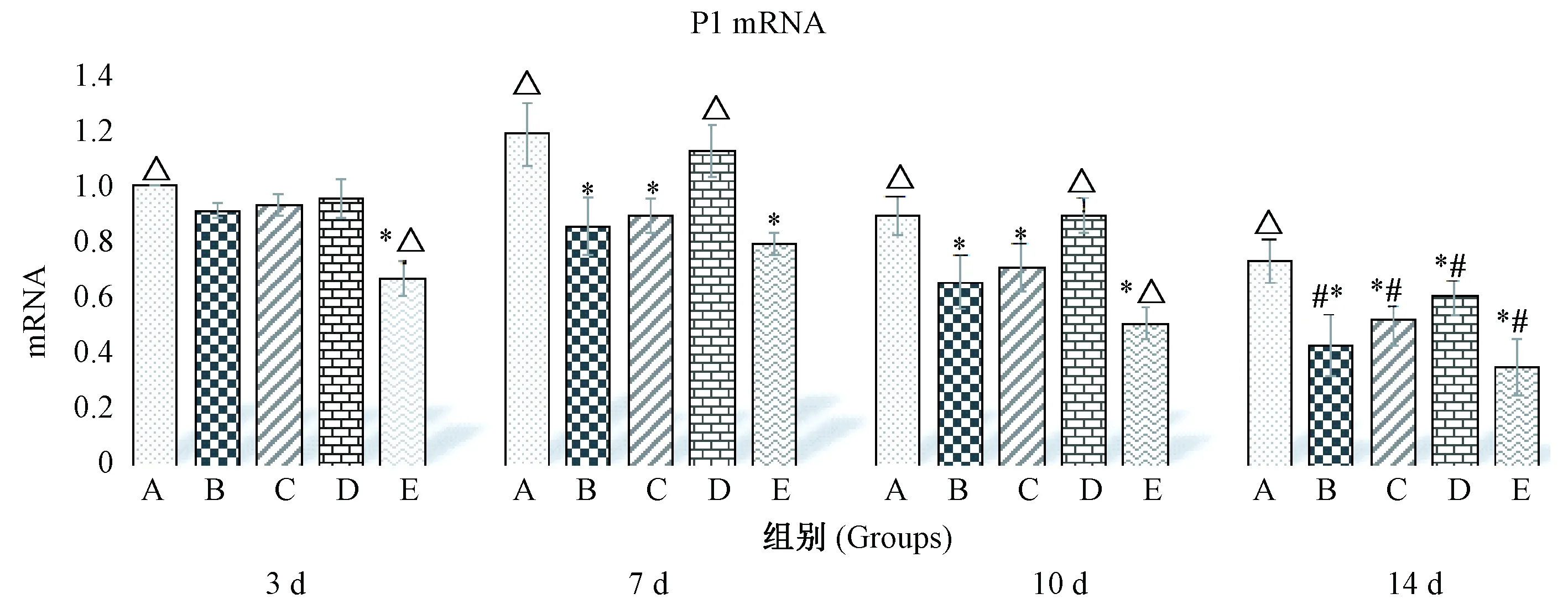
注:A.模型组,B. 全方组,C.分解Ⅰ组, D.分解Ⅱ组,E.阿奇组。与A组比较,*P<0.05;与B组比较,△P<0.05;第3天与第14天比较,#P<0.05。图3 QJD对MP感染小鼠肺组织中P1 mRNA水平的影响Note. A. Model group. B. QJD group. C. QJD decomposition agent I group. D. QJD decomposition group II Group. E. Azithromycin group. Compared with the group A, *P<0.05; compared with the group B, △P<0.05. Comparison between 3-day and 14-day groups, #P<0.05.Fig.3 Effect of QJD on the level of P1 mRNA in lung tissues of the MP infected mice

组别Groups3d7d10d14dA组1876±2251862±0981772±0711834±075B组2483±1754422±1464038±1653556±150#C组2415±1353234±145∗2843±124∗2612±151∗D组2453±1703902±144∗△3536±171∗△3141±194∗△#E组2480±1554336±206△3942±194△3526±136△#F组2223±143∗2820±121∗△2526±151∗△2083±047∗△
注:与A组比较,P<0.05;与B组比较,*P<0.05;与C组比较,△P<0.05;第3天与第14天比较,#P<0.05。
Note. Compared with the group A,P<0.05; compared with the group B,*P<0.05; compared with the group C,△P<0.05. Comparison between the 3-day and 14-day groups,#P<0.05.
表3 各组小鼠血清INF-γ含量检测结果Tab.3 Detection results of INF-γ content in serum of the mice in each group(±s,n=6, pg/mL)
注:与A组比较,P<0.05;与B组比较,*P<0.05;与C组比较,△P<0.05;第3天与第14天比较,#P<0.05。
Note. Compared with the group A,P<0.05; compared with the group B,*P<0.05; compared with the group C,△P<0.05. Comparison between the 3-day and 14-day groups,#P<0.05.
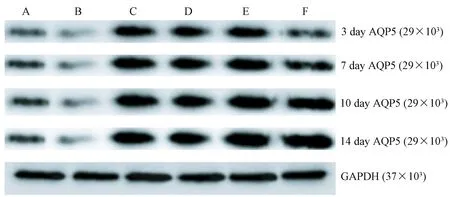
注:A.正常组,B. 模型组,C. 全方组,D.分解I组,E.分解II组,F.阿奇组。图4 QJD对MP感染小鼠肺组织中AQP5蛋白水平的影响Note. A. Normal group. B. Model group. C. QJD group. D. QJD decomposition agent I group. E. QJD decomposition agent II Group. F. Azithromycin group.Fig.4 Effect of QJD on the level of AQP5 protein in lung tissues of the MP-infected mice
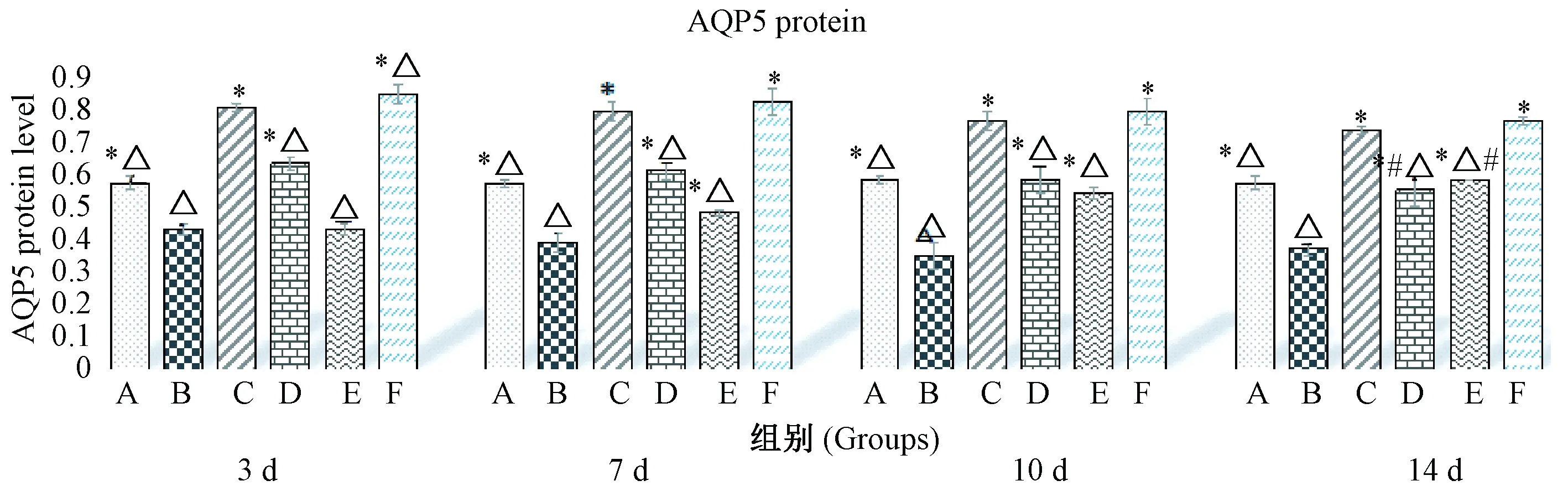
注:A.正常组,B. 模型组,C. 全方组,D.分解I组,E.分解II组,F.阿奇组。与A组比较,P<0.05;与B组比较,*P<0.05;与C组比较,△P<0.05;第3天与第14天比较,#P<0.05。图5 QJD对MP感染小鼠肺组织中AQP5蛋白水平的影响Note.A. Normal group. B. Model group. C. QJD group. D. QJD decomposition agent I. E. QJD decomposition group II Group. F. Azithromycin group. Compared with the group A, P<0.05; compared with the group B, *P<0.05; compared with group C, △P<0.05. Comparison between 3-day and 14-day groups, #P<0.05..Fig.5 Effect of QJD on the level of AQP5 protein in lung tissues of the MP-infected mice
3 讨论
MP致病机制至今尚不完善,目前主要包括毒素作用、上皮粘附及免疫功能紊乱等假说。近年来中药抗MP感染的机理研究主要侧重于MPP的发病机制,包括直接抑制MP、提高机体免疫力、保护上皮细胞、促进损伤修复等方面[7]。Kannan和Baseman在实验中发现了MP致病相关因子MPN372,又名为社区获得性呼吸窘迫综合征毒素[8],可引起小鼠气管上皮细胞广泛的空泡变性直至死亡[9]。由于MP自身缺乏细胞壁,需通过其自身细胞膜上的黏附蛋白与宿主靶细胞膜紧密结合。这种黏附蛋白有很多类型,其中最主要的是P1蛋白,它不仅具有抗原性,还有一定的变异性[10]。P1蛋白通过与呼吸道上皮细胞的神经氨酸受体相结合,可使气道黏膜的完整性遭到破坏。这种黏附作用同时还表现为抑制呼吸道上皮的纤毛运动,影响其细胞的新陈代谢,并最终导致上皮细胞坏死[11]。MP对上皮细胞的黏附可激活宿主的免疫反应, 可见淋巴细胞、免疫球蛋白的生成增多,同时可释放TNF-α,INF-γ和各种白介素细胞(包括IL-2、IL-4、IL-8、IL-10)。TNF-α作为早期的细胞因子之一,可促使中性粒细胞释放,诱导局部炎症反应,其在气道炎症的产生及发展中起着重要作用[12]。IFN-γ作用较广泛,包括杀伤炎症细胞毒性、介导细胞的免疫应答和抑制Th1细胞增殖等[13]。AQP5作为水通道蛋白家族(AQPs)的主要成员,是一组与水通透性有关并介导水分子跨膜转运的细胞膜转运蛋白,同时也是肺部病变的重要因子,感邪后AQP5失活易导致肺内水液平衡紊乱,肺泡水肿形成[14]。本研究发现,MP感染后小鼠肺指数、肺组织炎症病理评分均升高、干湿比降低;MPN372、P1表达和TNF-α、INF-γ含量升高,而AQP5表达降低。QJD治疗后,小鼠肺指数、肺组织炎症病理评分均降低、干湿比升高,INF-γ和AQP5表达逐渐升高,MPN372、P1、TNF-α降低。QJD分解剂I可下调MPN372、P1、TNF-α的表达;QJD分解剂II对AQP5的表达逐渐增加。本次实验结果表明QJD可明显减轻小鼠肺部的炎症损伤,正向调节了炎症因子;其中分解剂I的作用表现为抑制细胞毒素MPN372和粘附蛋白P1的产生,抑制炎症因子TNF-α、INF-γ的释放;分解剂Ⅱ的作用表现为上调AQP5表达,改善燥邪对肺部的损伤。
QJD是治疗温燥伤肺的常用方,主治外感燥火伤肺,身热头痛,气逆而喘,咳嗽不止,甚则引动胃气,呕吐痰涎,脉虚大而数。《医门法律》认为本方所治应属秋令气候干燥,外感温燥伤肺之重证。方中重用桑叶色青入肝,禀大寒之性,清宣肺燥,透邪外出,为君药。温者属热宜清,燥胜则干宜润,故臣以石膏辛甘而寒,淸泄肺热;麦冬甘寒,养阴润肺。石膏虽沉寒,但用量轻于桑叶,则不碍君药之轻宣;麦冬虽滋润,但用量不及桑叶之半,则不妨君药之外散。人参益气生津,合甘草以培土生金补肺气;胡麻仁、阿胶助麦冬养阴润肺。再加少量杏仁、枇杷叶苦降肺气;甘草调和诸药。诸药相配,燥邪得宣,气阴得复,共奏清燥救肺之功。QJD以“宣、清、降、润、补”为立法,清中有润,润中寓补,对于燥热所致肺部损伤均有疗效。其中分解剂Ⅰ组内含“宣、清、降”三法,由杏仁、石膏、桑叶、枇杷叶组成,具有清热宣肺,肃降肺气的作用;分解剂II组内含“润、补”二法,由人参、阿胶、麦门冬、甘草、胡麻仁组成,具有补益气血,养阴润燥的作用。本研究发现,QJD既能够抑制过度的炎症反应,又能提高免疫因子含量,而依“法”分组的分解剂I和分解剂II,即不同的药物组份配伍,所起的作用和靶位不同。QJD及其分解剂能够控制MP感染后肺部炎症,减少MPP1、TNF-α的表达和毒素MPN372的产生,其中分解剂I起主要作用;QJD能够上调INF-γ、AQP5蛋白表达,其中分解剂Ⅱ起主要作用;
QJD具有清肺润燥,益气养阴的功效,能够抗MP感染,表现为抑制炎症因子的释放,减少MP细胞毒素的产生及其黏附蛋白的表达,同时可以修复MP对肺部的损伤,也间接证实了外感燥邪和感染MP在致病机制上可能存在一定的相似性。
References)
[1] Tao LL, Hu BJ, He LX, et al. Etiology and antimicrobial resistance of community-acquired pneumonia in adult patients in China [J].Chin Med J (Eng1), 2012, 125(17): 2967-2972.
[2] Chaudhry R, Ghosh A, Chandolia A. Pathogenesis of Mycoplasma pneumoniae: An update [J]. Indian J Med Microbiol, 2016, 34(1): 7.
[3] 吴振起, 刘光华, 王雪峰. 从燥论治肺炎支原体感染 [J]. 中医杂志,2012, 53(21): 1879-1880.
Wu ZQ, Liu GH, Wang XF. The treatment of Mycoplasma pneumoniae infection from dryness [J]. Chin Med J, 2012, 53(21): 1879-1880.
[4] 吴振起, 刘光华, 岳志军,等. 清燥救肺汤抗肺炎支原体感染大鼠作用的实验研究 [J]. 中国中西医结合儿科学, 2013, 5(01): 1-4, 97.
Wu ZQ, Liu GH, Yue ZhJ, et al. Experimental study on the effect of Qingzao Jiufei Decoction against Mycoplasma pneumoniae infection in rat [J]. Chin Pediat Integr Tradit Western Med, 2013, 5(01): 1-4, 97.
[5] 刘晓红,辛德莉,侯安存,等. 小鼠肺炎支原体肺炎模型的建立及组织病理学评分方法的应用 [J]. 重庆医学, 2004, 33(09): 1338-1340.
Liu XH, Xin DL, Hou AC, et al. The establishment of Mycoplasma pneumoniae pneumonia model in mice and the application of histopathological scoring method [J]. Chongqing Med, 2004, 33(09):1338-1340.
[6] 麻粉莲, 李引乾, 郑丽舒,et al. 人甲型流感病毒H1N1亚型NS1蛋白的原核表达及纯化 [J]. 中国生物制品学杂志, 2009, 22(03): 221-225.
Ma FL, Li YY, Zheng LS, et al. Prokaryotic expression and purification of NS1 protein of human influenza A virus H1N1 subtype [J]. Chin J Biologicals, 2009, 22(03): 221-225.
[7] 王英岩, 蒙艳丽, 钱锋,等. 中药抗肺炎支原体作用的研究进展 [J]. 黑龙江中医药, 2015, 44(05): 65-67.
Wang YY, Meng YL, Qian F, et al. Research progress on the effect of traditional Chinese medicine on Mycoplasma pneumoniae [J]. Heilongjiang J Tradit Chin Med, 2015, 44(05): 65-67
[8] Kannan TR, Krishnan M, Ramasamy K, et al. Functional mapping of community-acquired respiratory distress syndrome (CARDS) toxin of Mycoplasma pneumoniae, defines regions with ADP-ribosyltransferase, vacuolating and receptor-binding activities [J]. Mol Microbiol, 2014, 93(3): 568-581.
[9] 罗浩荡, 游晓星, 吴移谋. 肺炎支原体致炎的分子机制研究进展 [J]. 免疫学杂志, 2017, 33(7): 639-644.
Luo HD,You XX,Wu YM. Research progress in molecular mechanism of Mycoplasma pneumoniae induced inflammation [J]. Lmmunol J 2017, 33(7): 639-644.
[10] Waites KB, Balish MF, Atkinson TP. New insights into the pathogenesis and detection of Mycoplasma pneumoniae infections[J]. Future Microbiol, 2008, 3(6): 635-648.
[11] 张晓娟, 沈伊娜. 小儿肺炎支原体肺炎发病机制的研究进展 [J]. 安徽医学, 2016, 37(1): 111-113.
Zhang XJ, Shen YN. Research progress on the pathogenesis of Mycoplasma pneumoniae pneumonia in children [J].Anhui Med J, 2016, 37(1): 111-113.
[12] 魏东, 刘英, 贾宁,等. H9N2亚型猪流感病毒诱导小鼠急性肺损伤中TNF-α、IL-1β、IL-6和IL-10的变化和作用 [J]. 中国实验动物学报, 2013, 21(2): 72-74.
Wei D, Liu Y, Jia N,et al. Changes and effects of TNF-α, IL-1 β, IL-6 and IL-10 in acute lung injury induced by H9N2 subtype swine influenza virus in mice [J]. Acta Lab Anim Sci Sin, 2013, 21(2): 72-74.
[13] 朱华, 张扬清, 涂新明, 等. 严重急性呼吸综合征动物模型中血清因子的检测 [J]. 中国实验动物学报, 2005, 35(s1): 10-12.
Zhu H, Zhang YQ, Tu XM, et al. Detection of serum factors in animal models of severe acute respiratory syndrome [J].Acta Lab Anims Sci Sin, 2005, 35(s1): 10-12.
[14] 丁建中, 张六通, 李军川, 等. 水通道蛋白1、4、5在外燥小鼠肺表达的意义 [J]. 时珍国医国药, 2012, 23(3): 764-765.
Ding JZ, Zhang LT, Li JC, et al. The significance of water channel proteins 1, 4, 5 in the lung expression of mice with external dryness [J]. Zhenguo Nat Med, 2012, 23(3): 764-765.

