家福捕鸟蛛毒腺cDNA文库构建及其毒素-16序列和活性分析
卓城洁, 袁 萌, 伍文攀, 邓娟华, 喻振国, 向小亮, 胡朝暾
(怀化学院生物与食品工程学院/民族药用植物资源研究与利用湖南省重点实验室,湖南 怀化 418008)
近年来随着研究的不断深入,蜘蛛毒素的重要性日益显现。蜘蛛毒素的专一性和高效性使其成为潜在的新型药物、离子通道工具试剂和杀虫剂等领域重要的原料来源[1-2],其在农业生物技术、神经生物学、蛋白质化学、天然药物开发等领域广泛应用。由于蜘蛛毒液分泌量很少,且其毒液是由很多性质不同、含量差异很大的成分组成的混合物,除了几个主要成分外,大多数成分在粗毒中含量很低,因此很难获得足够的单体毒素用于相关研究[3]。随着分子生物学的发展,利用毒腺cDNA 文库的构建结合基因工程表达的方法可以有效解决毒素来源问题。近十年来,已经构建了很多有毒动物毒腺cDNA文库[4-9],获得了大量的编码毒素的ESTs序列。
疼痛是世界医学面临的重大难题,也是急需攻克的顽固性疾病。目前,这种疾病严重影响到数百万人的生命[10]。研究发现电压门控钠通道的改变与炎性疼痛和神经病理性疼痛密切相关[11]。能阻断这些钠通道亚型的成分具有开发成为治疗疼痛的药物分子的潜能。由于蜘蛛毒素是一类主要作用于离子通道及具有特定药理学特性的多肽毒素[12-13],因此,从蜘蛛粗毒中筛选一些治疗疼痛的药物分子成为研究人员梦寐以求的事情。家福捕鸟蛛是一种生活在广西、云南等地的蜘蛛新种。本实验室最先对该蜘蛛毒素进行了研究[14]。目前,未见家福捕鸟蛛毒腺cDNA文库相关研究的报道。为了阐明家福捕鸟蛛毒素的分子多样性和获得其毒素序列,构建了一个定向的毒腺全长cDNA 文库,获得了752条高质量的EST序列,并开展了EST聚类分析。另外,从家福捕鸟蛛粗毒中筛选到了1种对DRG细胞TTX-R钠通道具有明显抑制作用的毒素分子(命名为JF-16),并对该毒素进行了序列分析和活性测定。这些试验的开展为家福捕鸟蛛毒腺转录组以及JF-16潜在镇痛活性分析奠定了基础。
1 材料与方法
1.1 材料
1.1.1 试验动物 家福捕鸟蛛捕自广西宁明县、SD大鼠购于中南大学湘雅医学院动物房。
1.1.2 试剂 cDNA文库试剂盒为Clontech公司产品,Trizol试剂为Invitrogen公司产品,DNA Marker、焦碳酸二乙酯、氯霉素、NaOH、葡萄糖、冰乙酸、KCl、MgCl2、溴化乙锭、溴酚蓝、甘油、蛋白酶K、乙醇、氯仿、异丙醇等购自上海生工生物工程有限公司,RNase Free的枪头和离心管为Axygen公司产品,三氟乙酸(Trifluoroacetic acid ,TFA)、河豚毒素、α-氰基-4-羟基-肉桂酸(CCA)、胰蛋白酶、胶原酶、胰蛋白酶抑制剂、HEPES 、EGTA 、D-glucose 、氯化铯 、氢氧化铯等购自Sigma公司,色谱纯乙腈购自湖南化工研究所,其他为国产分析纯试剂。
1.1.3 仪器 PCR仪和电泳仪均为bio-rad公司产品,MALDI-TOF-TOF 质谱仪为Bruker公司产品, U-2000型紫外-可见分光光度计购自Hitachi公司,真空冷冻干燥机为Thermo Savant公司产品,Waters Alliance 2695高效液相色谱仪为美国Waters公司产品, EPC-10膜片钳仪为德国HEKA公司产品,491型蛋白质测序仪为美国Applied Biosystem公司产品,高速冷冻离心机为德国Eppendorf公司产品。
1.2 方法
1.2.1 总RNA的提取与分析 将解剖的家福捕鸟蛛毒腺加入到研钵中液氮研磨30 min至粉状。采用Trizol试剂提取总RNA,用核酸测定仪测定总RNA在260 nm、280 nm处的吸光值,计算OD260/OD280的值。总RNA的纯度和完整性通过1.5%琼脂糖凝胶电泳来检测。
1.2.2 家福捕鸟蛛毒腺cDNA文库构建 以总RNA为模板,按照SMARTTM cDNA Library Construction Kit (Clontech) 试剂盒说明书方法合成cDNA第一条链,采用LD-PCR法扩增合成双链cDNA。将合成的双链cDNA进行蛋白酶K消化及SfiI酶切。酶切后双链cDNA用CHROMASPIN- 400 柱分级分离,选取优化的cDNA用T4 DNA 连接酶连接到载体。用电转化法将连接产物转化到宿主菌E.coliHST08,将转化后的宿主菌接种到含氯霉素的LB培养基中培养,获得家福捕鸟蛛毒腺cDNA文库。
1.2.3 cDNA 文库的滴度测定和插入片段检测 从文库中取1.0 μl 细菌培养液,分别稀释不同倍数,再从中取1 μl稀释菌液与200 μl LB液体培养基混匀后分别涂布于含氯霉素的LB固体培养基上,37 ℃培养 12~16 h 后计算菌落生长个数并计算文库滴度。随机选取16个单克隆进行PCR扩增试验得到插入片段。PCR反应程序如下:95 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸3 min,30个循环;4 ℃冷却。反应完成后,取5 μl产物用1.5%琼脂糖凝胶电泳鉴定。将符合要求的单克隆菌落送北京六合华大基因科技股份有限公司测序。
1.2.4 EST 序列分析和功能预测 将测序的序列处理后得到高质量的EST序列。利用DNAStar 软件对EST序列进行聚类分析。应用在线分析软件Translate tool(http://www.expasy.org/tools/dna.html)对测序获得的EST序列进行编码蛋白质氨基酸序列分析。EST及其编码的蛋白质氨基酸序列与公共数据库进行Blast比对,可以获取与目的序列匹配的序列信息及功能注释。
1.2.5 家福捕鸟蛛毒液采集和JF-16的分离纯化 按文献[3]的方法采集毒液,采集得到的家福捕鸟蛛毒液冷冻干燥后为粗毒。粗毒用超纯水配制成浓度为10 mg/ml的溶液,8 000 r/min离心15 min。毒液经RP-HPLC分离纯化,上样量为100 μl。反相柱为C18柱 (Phenomenex 100 Å, 4.6 mm×250 mm, 5 μm)。洗脱液A为含0.1 % TFA的水溶液,洗脱液B为含0.1% TFA的乙腈溶液。在50 min内 0~50%洗脱液B的线性梯度洗脱,流速为1.0 ml/min ,柱温40 ℃,在215 nm下收集洗脱峰冷冻干燥或质谱分析。
1.2.6 JF-16的MALDI-TOF分析 质谱分析在MALDI-TOF质谱仪上进行。N2激光器,离子源加速电压为20 kV,检测电压16.5 kV,激光波长337 nm,阳离子模式。用含0.1 % TFA 的50 % 乙腈溶液溶解CCA基质至终浓度为10 mg/ml,取 0.5 μl样品与1.0 μl CCA基质液混合,再取0.5 μl混合液点样室温干燥后质谱鉴定。使用外标(混合标准样品)进行校正。
1.2.7 大鼠背根神经节细胞的急性分离培养 参照文献[15]的方法进行。
1.2.8 钠电流的全细胞膜片钳记录 将细胞培养液更换为细胞外液,20~25 ℃置于倒置显微镜下选择质膜光滑饱满的细胞进行全细胞模式(Whole-cell)膜片钳试验。玻璃电极经电极拉制仪(PC-10,Narishige)两步拉制后热抛光,加电极内液后电阻为 1.8~3.0 MΩ。电极内液:CsCl 145 mmol/L,MgCl24 mmol/L,HEPES 10 mmol/L,EGTA 10 mmol/L,D-Glucose 10 mmol/L,ATP-Mg 2 mmol/L,用1 mol/L CsOH 调节pH至7.2。细胞外液:NaCl 145.0 mmol/L,KCl 2.5 mmol/L,CaCl21.5 mmol/L,MgCl21.2 mmol/L,HEPES 10.0 mmol/L,D-glucose 10.0 mmol/L,用1 mol/L NaOH调至7.2。2种溶液都用蔗糖调至280 mOsm/L。试验细胞形成稳定电流后经过3 kHz和10 kHz的双重过滤,采用P/4程序删除电容电流和线性漏电流。采用低压微量进样器施加毒素。毒素先配制成1 mmol/L的母液,-20 ℃储存。试验时稀释至目的浓度,加药剂量为10 μl。
1.2.9 JF-16的氨基酸序列测定 氨基酸序列分析是利用Edman降解原理,在Perkin Elmer Procise 491A型气相测序仪上进行的。选用碘乙酰胺烷基化修饰后的毒素肽作为测序样品。根据毒素分子量大小设定测序循环数。
1.2.10 JF-16的cDNA序列分析 根据JF-16 Edman降解测定的氨基酸序列和EST编码的蛋白质氨基酸序列比对,找到JF-16的cDNA序列。应用在线分析软件SignalP 4.1程序(http://www.cbs.dtu.dk/services/SignalP/)进行JF-16 前体信号肽预测。根据Von等[16]的方法确定JF-16前体肽酶切割位点。根据在线分析软件(http://web.expasy.org/protparam/)计算JF-16成熟肽序列的理论等电点和理论分子量。
2 结果与分析
2.1 RNA的提取与分析
Trizol提取的家福捕鸟蛛毒腺总RNA经紫外分光光度计检测, 测得总RNA 的OD260/OD280=1.87,比值在 1.8~2.0,说明家福捕鸟蛛毒腺总RNA纯度较好。总RNA 浓度为0.49 μg/μl。总RNA经1.5%琼脂糖凝胶电泳检测后显示出28S、18S和5S 3个条带(图1)。从图谱中没有发现明显的拖尾现象,表明家福捕鸟蛛毒腺总RNA提取成功。
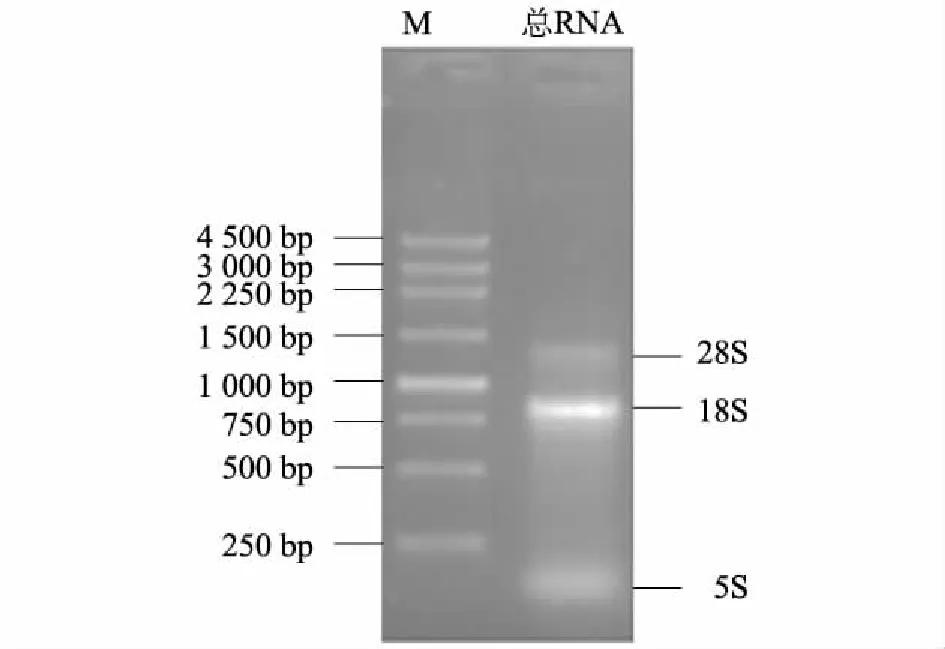
M:Marker。图1 家福捕鸟蛛毒腺总RNA电泳图Fig.1 Electrophoresis of total RNA from venom glands of Selenocosmia jiafu
2.2 双链cDNA的合成和片段大小的选取
取1.0 μg总RNA进行逆转录合成第一链,再以第一链产物为模板通过长距离PCR合成双链cDNA。双链cDNA产物经琼脂糖凝胶电泳结果显示,条带分布在 300~3 000 bp,且在 400~750 bp区域形成亮带 (图2)。双链cDNA经蛋白酶K和SfiI酶切消化,再通过CHROMASPIN-400柱分离并收集液滴,最后从每1管中取出适量样品进行琼脂糖凝胶电泳检测,保留 400~750 bp (短片段部分,主要是毒素基因)和 750~2 000 bp(长片段部分,主要是细胞蛋白基因)两部分(图3)。保留这两部分片段是基于下列考虑:研究发现蜘蛛毒素主要是由 20~65个氨基酸残基组成的多肽类毒素。根据毒素氨基酸残基数目大致估计其前体肽的大小,再加上5′端非编码区和3′端非编码区部分,最终估算家福捕鸟蛛毒素cDNA片段大小大致在400~750 bp。另外,蜘蛛毒腺完成毒液的合成和分泌等生命活动需要很多相关蛋白质参与。因此,保留长片段部分是为了得到相关蛋白质的信息,以期对蜘蛛毒腺分泌毒液的机理有初步的了解。
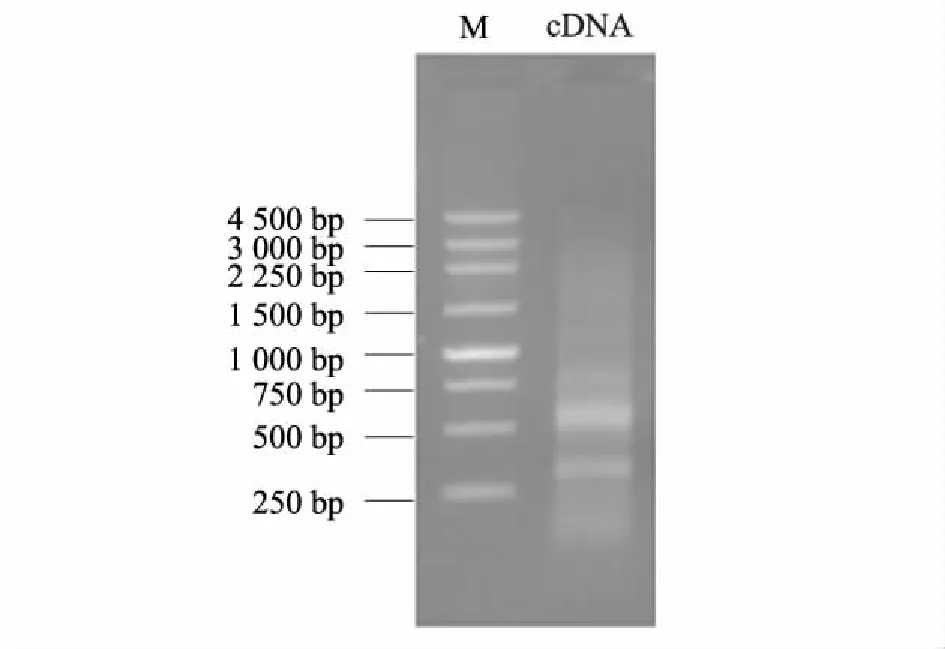
M:Marker。图2 家福捕鸟蛛毒腺双链cDNA电泳图Fig.2 Electrophoresis of double-stranded cDNA from venom glands of S. jiafu
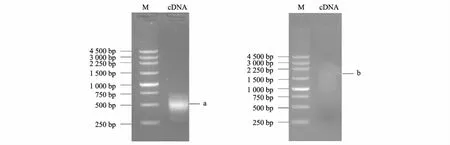
M:Marker;a:400~750 bp;b:750~2 000 bp。图3 家福捕鸟蛛毒腺双链cDNA柱分离后电泳图Fig.3 Electrophoresis of double-stranded cDNA from venom glands of S. jiafu by column separation
2.3 文库库容和插入片段大小分析
将家福捕鸟蛛毒腺cDNA进行放大培养检测,结果显示短片段部分cDNA文库的初级文库滴度为 2.0×107CFU/ml,长片段部分cDNA文库的初级文库滴度为 1.4×106CFU/ml,均符合cDNA文库构建的要求(一般要求文库滴度在 1.0×105CFU/ml以上即为有效库容)。长片段和短片段各随机抽取16个克隆进行插入片段大小检测。图4为插入片段电泳检测图,从图中可知短片段长度为 400~750 bp,平均长度约500 bp,长片段长度为 750~2 000 bp,平均长度为1 500 bp。
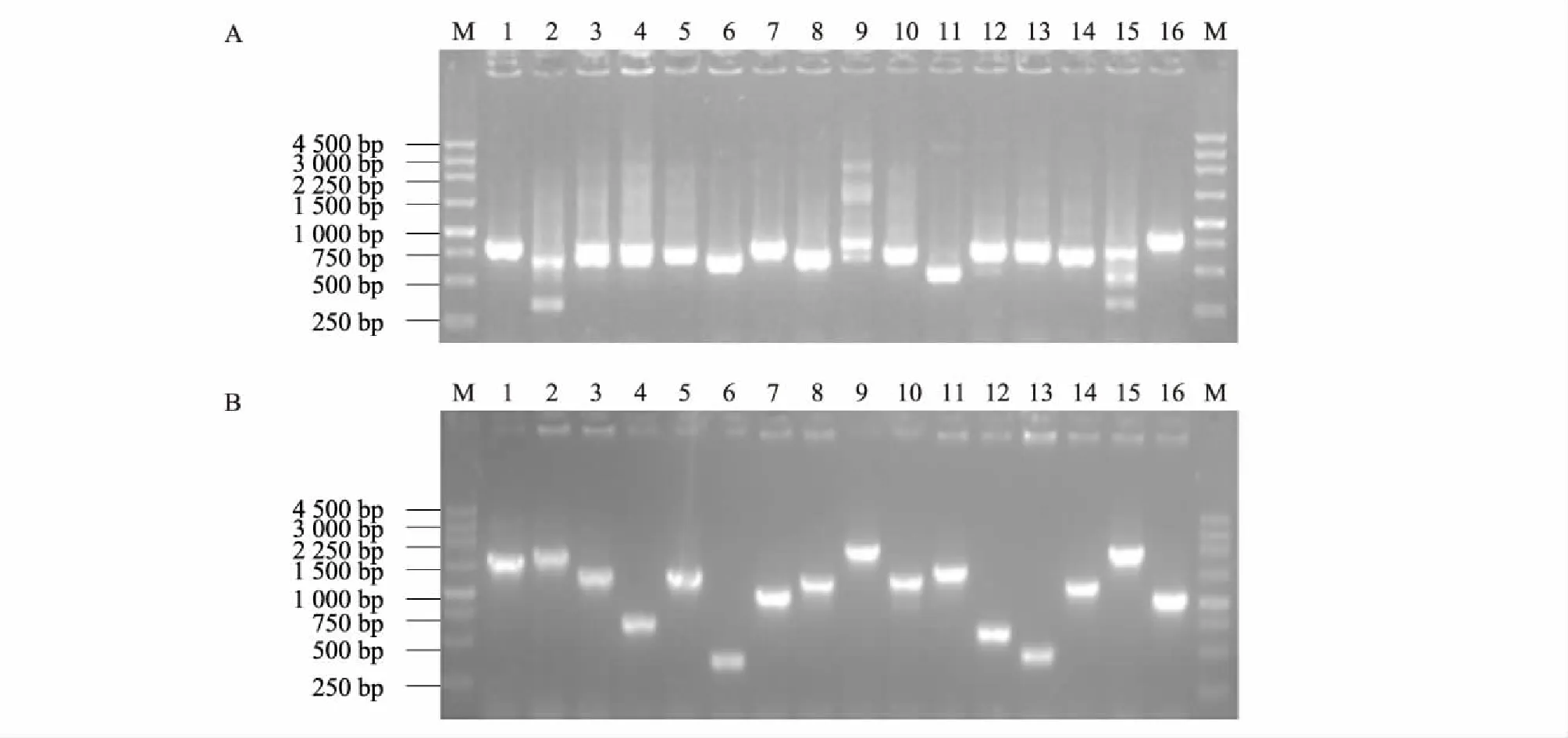
A:400~750 bp 插入片段电泳图;B:750~2 000 bp 插入片段电泳图。图4 家福捕鸟蛛毒腺cDNA文库插入片段电泳图Fig.4 Electrophoresis of the inserted fragments of cDNA library from venom glands of S. jiafu
2.4 EST序列分析和功能预测
选取899个短片段菌落和400个长片段菌落送北京六合华大基因科技股份有限公司测序,最后获得高质量的EST序列752条。752条EST经聚类分析得到257个唯一序列(Unique sequence),其中61个重叠群(Contigs)和196个单一序列(Singletons)。61个重叠群中,2个重叠群包含50条以上的ESTs,4个重叠群包含 20~49条ESTs,9个重叠群包含 10~19条ESTs,46个重叠群包含 2~9条ESTs。752条EST序列中毒素序列438条(毒素序列必须同时满足2个条件:序列含有信号肽和含有4个或4个以上半胱氨酸),普通蛋白序列220条,另外有94条序列没有匹配到相似的序列。
EST序列的丰度能反映该转录组的蛋白质表达情况。因此,按EST序列重复数高低将EST序列的丰度分成5个区段。(1)≥50 ESTs:包含2个重叠群,每个重叠群含50条以上的EST序列,这是家福捕鸟蛛毒腺转录组中最丰富的部分,该2族占所有族的比例为0.78%(2/257),而所包含的EST序列占整个EST序列的比例却高达21.94% (165/752),这2个重叠群全部是毒素基因。(2) 20~49 ESTs:包含4个重叠群,该4族占所有族的比例为1.56%(4/257),而所包含的EST序列占整个EST序列的比例为16.62% (125/752),这4个重叠群全部是毒素基因。(3)10~19 ESTs:包含9个重叠群,该9族占所有族的比例为3.50%(9/257),而所包含的EST序列占整个EST序列的比例为15.03% (113/752),这9个重叠群中有7个重叠群是毒素基因, 2个重叠群是普通细胞蛋白基因。(4)2~9 ESTs:包含46个重叠群,该46族占所有族的比例为17.90%(46/257),而所包含的EST序列占整个EST序列的比例为20.35% (153/752),这46个重叠群中有11个重叠群是毒素基因,另外35个重叠群为普通细胞蛋白基因。(5)1 EST:196个单拷贝序列,其所占族的比例为76.26%(196/257),而所包含的EST序列占整个EST序列的比例为26.06% (196/752),这196个单一序列中有9个是毒素基因,另外187个是普通细胞蛋白基因。因此,家福捕鸟蛛毒腺转录组中绝大部分的单一序列基因为非毒素基因。
2.5 JF-16的分离纯化、分子量和活性鉴定
图5为家福捕鸟蛛粗毒反相高效液相色谱图。粗毒经RP-HPLC后得到40多个色谱峰,采用全细胞膜片钳技术将各个色谱峰进行TTX-R通道活性筛选。发现保留时间为29.81 min的标注为16的色谱峰(命名JF-16)经全细胞膜片钳检测,对DRG细胞TTX-R通道电流具有抑制作用。JF-16膜片钳活性鉴定时,先往细胞外液中加入200 nmol/L TTX,将DRG细胞上记录的河豚毒素敏感性(Tetrodotoxin-sensitivity, TTX-S)钠电流阻断。选取小直径(<10 μm)的DRG细胞进行膜片钳试验,将膜电位控制在-80 mV,给予脉冲宽度为50 ms,以10 mV步幅递增的去极化电压刺激引出DRG细胞TTX-R电流,再加入JF-16进行全细胞膜片钳TTX-R通道活性的测定。结果发现JF-16对DRG细胞上TTX-R通道具有抑制作用。浓度为400 nmol/L 的JF-16大约抑制 36.17%±3.2% (n=5) TTX-R钠通道电流,当JF-16浓度增到1 μmol/L时大约能抑制 49.89%±4.70% (n=5)的TTX-R钠通道电流(图6A)。JF-16经MALDI-TOF鉴定分子量为3 954.616(图6B)。
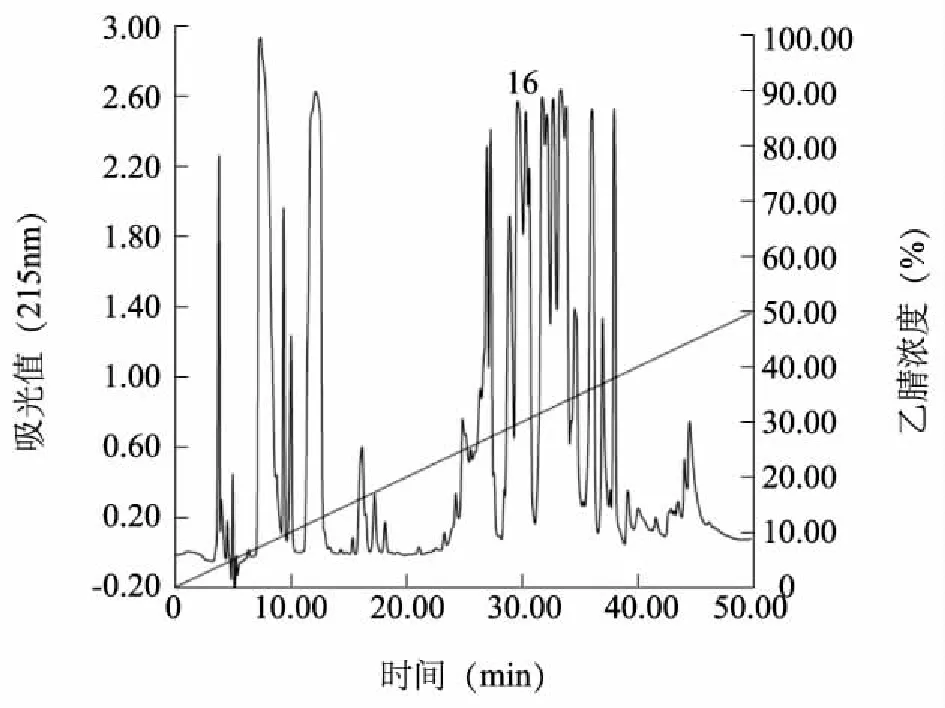
图5 JF-16反相高效液相色谱图Fig.5 Reversed phase-HPLC of JF-16

图6 JF-16对大鼠DRG细胞TTX-R钠电流的影响(A)及其质谱分析图谱(B)Fig.6 Effects of JF-16 on TTX-R sodium currents in rat dorsal root ganglion neurons (A) and MALDI-TOF mass analysis (B)
众所周知,DRG细胞表达的TTX-R钠电流为Nav1.8和Nav1.9电流,其中以Nav1.8为主。这2类钠通道电流也是目前研究的热点。Nav1.8被认为和神经性疼痛相关[10],而Nav1.9通过调节神经元的兴奋性从而与炎症反应和疼痛调节紧密相关[17]。Nav1.8主要在小直径和中等直径感觉神经元上高表达,可被阈上电位激活,且呈现缓慢激活,缓慢失活及快速去失活的动力学特征,从而介导大量钠离子内流引起细胞膜快速去极化,因此是动作电位上升相的主要电流成分[18]。大量研究结果表明Nav1.8在机体炎症、神经病理性以及多种伤害性刺激诱发的疼痛中具有重要作用,因此靶向Nav1.8已成为新型镇痛药研发的新策略和热点[19-20]。由于JF-16能够抑制DRG细胞TTX-R钠通道电流,因此,JF-16是一个潜在的可能具有镇痛活性的毒素分子。
2.6 JF-16的序列测序与分析
通过Edman降解法进行全序列测定,发现JF-16是1个由35个氨基酸残基组成的多肽,全序列为:H2N-ECTKLLGGCTKSSECCPHLGCRRKWPYHCGWDGTF-COOH,序列中包含有6个Cys。根据在线分析软件计算得到该序列的理论分子量为3 960.5,这与质谱鉴定所测定的值相差约6.0,表明该多肽分子的6个半胱氨酸残基形成了3对二硫键。该序列中包含3个极性带负电荷的酸性氨基酸(1Asp+2 Glu)和5个极性带正电荷的碱性氨基酸(2Arg+3Lys),碱性氨基酸数大于酸性氨基酸数使得整个多肽分子偏碱性,这与在线分析软件计算出的该序列理论等电点为8.35相符。
2.7 JF-16的cDNA序列分析
根据JF-16 Edman降解测定的氨基酸序列和EST编码的蛋白质氨基酸序列比对,找到编码JF-16的cDNA序列。研究发现JF-16的全长cDNA为518 bp,其中开放阅读框ORF长261 bp,编码87个氨基酸(前体肽)。5′-端非翻译区(5′-UTR)长116 bp, 3′-端非翻译区(3′-UTR)长141 bp, 具有典型的polyA 尾结构。信号肽预测结果显示,在前体肽N末端含有1个21个氨基酸组成的信号肽序列, 切割位点位于21位A和22位A之间。起始密码子为ATG,终止密码子为TGA。前体肽具有典型的“EER”蛋白酶水解位点(48~50)和酰胺化标记残基“GF”(86、87)。毒素前体被蛋白水解酶在“EER”位点水解为成熟肽储存于毒囊中,尾部的2个酰胺化标记氨基酸残基“GF”也会切割。最终形成由35个氨基酸组成的成熟肽,与Edman降解法测定的序列完全吻合。JF-16的cDNA序列及其编码的蛋白质氨基酸序列见图7。

灰色部分表示信号肽序列(1~21);下划线表示蛋白水解酶位点(EER);▲表示保守的半胱氨酸残基;*表示终止密码子。图7 JF-16 cDNA序列及其推导的氨基酸序列Fig.7 Deduced amino acid sequence and cDNA sequence of JF-16
3 讨 论
cDNA文库构建是研究基因功能和发现新基因的主要技术方法,而高质量的RNA 是cDNA文库构建成功的必要条件。本试验采用Trizol法提取家福捕鸟蛛毒腺总RNA,所提取的毒腺总RNA经电泳检测未见明显的降解,纯度和含量都符合要求,表明家福捕鸟蛛毒腺总RNA提取成功。影响文库质量的另一个因素是构建方法的选择。本试验采用SMART 法构建了家福捕鸟蛛毒腺cDNA文库。SMART 法是Clontech公司发明的一种全长cDNA文库构建方法,具有以下优点[21]:(1)文库构建时所需mRNA量少,一般只需要 0.5~1.0 μg;(2)文库构建过程中mRNA 不会损耗和降解;(3)试验快速和简便。cDNA文库构建后进行了文库滴度和cDNA片段大小的检测分析,发现构建的文库滴度和获得的插入片段大小均符合文库构建的要求,表明家福捕鸟蛛毒腺cDNA文库构建成功。
BLAST序列比对发现JF-16与敬钊缨毛蛛部分毒素[22]及一种生活在澳大利亚的捕鸟蛛Phlogiussp.毒素分子μ-TRTX-Phlo1a、μ-TRTX-Phlo1b相似性很高[23]。这些毒素分子的Cys不但高度保守且位置也基本相同,为第2、第9、第15、第16、第21、第29位,第15和第16位Cys紧密相邻。其他很多氨基酸残基也高度保守,如第7位的Gly,第18、第19位的His、Leu,第24、第25位的Lys、Trp,第26位的Pro,第31、第32位的Trp、Asp。BLAST比对发现JF-16与JZTX-9有高达94%的序列相似性[24]。JZTX-9是一个含有6个半胱氨酸,由35个氨基酸残基组成的C端酰胺化的多肽分子。与JZTX-9相比,JF-16的第12位由极性带负电荷的酸性氨基酸Asp变成极性不带电荷的中性氨基酸Ser,第21位由极性带正电荷的碱性氨基酸Lys变成Arg。因此,JF-16的理论等电点会高于JZTX-9。JZTX-9空间结构属于典型的抑制型胱氨酸结构 (Inhibitor cystine knot,ICK) 模体,由于JF-16与JZTX-9序列相似性很高,推断JF-16的空间结构也很有可能属于ICK模体。
由于JF-16 对DRG细胞上TTX-R钠通道电流具有抑制作用,因此,可以将JF-16作为一个潜在的镇痛药物开展相关研究。当然,JF-16 对DRG细胞上TTX-R钠电流具有抑制作用并不意味着JF-16就能够成为镇痛药物。首先,JF-16开发成为镇痛药物分子需要其具有高度的专一性。近十年来,在靶向Nav1.8镇痛新药研发领域, 国际上主要集中在专一性抑制剂的发现和作用机制研究。虽然取得一些进展[25-26],但是国际上该研究领域进展缓慢,具有应用前景的Nav1.8 专一性抑制剂很少。其次,JF-16必须具有高效低毒性的特性。另外,本研究只开展了JF-16 对DRG细胞上TTX-R钠通道活性的初步检测,未开展通道的分子水平作用机理研究,后续可以开展这方面的研究。
[1] ESCOUBAS P, DIOCHOT S, CORZO G. Structure and pharmacology of spider venom neurotoxins [J]. Biochimie, 2000, 82(9/10):893-907.
[2] ESCOUBAS P, BOSMANS F. Spider peptide toxins as leads for drug development [J]. Expert Opinion on Drug Discovery, 2007, 2(6): 823-883.
[3] LIANG S P. An overview of peptide toxins from the venom of the Chinese bird spiderSelenocosmiahuwenaWang [=Ornithoctonushuwena(Wang)][J]. Toxicon, 2004, 43(5): 575 -585.
[4] CHATRATH S T, CHAPEAUROUGE A, LIN Q, et al. Identification of novel proteins from the venom of a cryptic snakeDrysdaliacoronoidesby a combined transcriptomics and proteomics approach [J]. Journal Proteome Research, 2011, 10(2): 739-750.
[5] RUIMING Z, YIBAO M, YAWEN H, et al. Comparative venom gland transcriptome analysis of the scorpionLychasmucronatusreveals intraspecific toxic gene diversity and new venomous components [J]. BMC Genomics, 2010, 11: 452.
[6] DIEGO-GARCIA E, PEIGNEUR S, CLYNEN E, et al. Molecular diversity of the telson and venom components fromPandinuscavimanus(Scorpionidae Latreille 1802): Transcriptome, venomics and function [J]. Proteomics, 2012, 12(2): 313-328.
[7] REMIGIO E A,DUDATF J R. Evolution of ecological specialization and venom of a predatory marine gastropod [J]. Molecular Ecology, 2008, 17(4): 1156-1162.
[8] ZHANG Y Q, CHEN J J, TANG X, et al. Transcriptome analysis of the venom glands of the Chinese wolf spiderLycosasingoriensis[J]. Zoology (Jena), 2009, 113(1): 10-18.
[9] DIEGO-GARCI E, PEIGNEUR S, PEIGNEUR S, et al. Venom components fromCitharischiuscrawshayispider (Family Theraphosidae): exploring transcriptome, venomics, and function [J]. Cellular and Molecular Life Sciences, 2010, 67(16): 2799-2813.
[10] HARRIOTT A M, GOLD M S. Contribution of primary afferent channels to neuropathic pain [J]. Current Pain and Headache Reports, 2009, 13(3): 197-207.
[11] AMIR R, ARGOFF C E, BENNETT G J, et al. The role of sodium channels in chronic inflammatory and neuropathic pain [J]. Journal of Pain, 2006, 7 (Suppl5 ):1-29.
[12] 梁海勇,李 骞,陈金军. 蜘蛛毒素研究进展[J]. 检验医学与临床, 2013, 10(19): 2612-2613.
[13] 浦飞飞,尹 松,王晓英. 蜘蛛毒素的生物学活性研究进展[J].中国药理学通报, 2014, 30(12):1651-1654.
[14] HU Z T, ZHOU X, CHEN J, et al. The venom of the spiderSelenocosmiajiafucontains various neurotoxins acting on voltage-gated ion channels in rat dorsal root ganglion neurons [J]. Toxins(Basel), 2014, 6(3):988-1001.
[15] 邱 方,刘艳红,姜雨鸽,等. 用于膜片钳研究的大鼠背根神经节细胞急性分离技术的改良[J]. 北京医学, 2012, 34(8):719-722.
[16] VON HEIJNE G. Patterns of amino acids near signal-sequence cleavage sites [J]. European Journal of Biochemistry, 1983, 133(1): 17-21.
[17] QIAO G F , LI B Y, ZHOU Y H , et al. Characterization of persistent TTX-R Na+currents in physiological concentration of sodium in rat visceral afferents [J]. International Journal of Biological Sciences, 2009, 5(3): 293-297.
[18] CATTERALL W A. Voltage-gated sodium channels at 60: structure, function and pathophysiology [J]. Journal of Physiology, 2012, 590(11): 2577-2589.
[19] FABER C G, LAURIA G, MERKIES I S, et al. Gain-of-function Nav1.8 mutations in painful neuropathy [J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(47):19444-19449.
[20] ROWE A H, XIAO Y, ROWE M P, et al. Voltage-gated sodium channel in grasshopper mice defends against bark scorpion toxin [J]. Science, 2013, 342(6157):441-446.
[21] 董志敏,张宝石,关荣霞,等. 全长cDNA文库的构建方法[J]. 中国农学通报,2006,22(2):51-55.
[22] CHEN J J, DENG M C, HE Q Y, et al. Molecular diversity and evolution of cystine knot toxins of the tarantulaChilobrachysjingzhao[J]. Cellular and Molecular Life Sciences, 2008, 65(15): 2431-2444.
[23] CHOW C Y, CRISTOFORI-ARMSTRONG B, UNDHEIM E A, et al. Three peptide modulators of the human voltage-gated sodium channel 1.7, an important analgesic target, from the venom of an australian tarantula [J]. Toxins (Basel), 2015, 7(7): 2494-2513.
[24] DENG M C, KUANG F, SUN Z H, et al. Jingzhaotoxin-IX, a novel gating modifier of both sodium and potassium channels from Chinese tarantulaChilobrachysjingzhao[J]. Neuropharmacology, 2009, 57(2): 77-87.
[25] THEILE J W, CUMMINS T R. Recent developments regarding voltage-gated sodium channel blockers for the treatment of inherited and acquired neuropathic pain syndromes [J]. Frontiers in Pharmacology, 2011, 2(54):54.
[26] ZULIANI V, RAPALLI A, PATEL M K, et al. Sodium channel blockers: a patent review (2010-2014) [J]. Expert Opinion on Therapeutic Patents, 2015, 25(3):279-290.

