小麦黄花叶病毒单克隆抗体的制备及ACP-ELISA检测方法的建立
任春梅, 杨 柳, 缪 倩, 程兆榜
(江苏省农业科学院植物保护研究所,江苏 南京 210014)
小麦黄花叶病是由禾谷多黏菌(PolymyxagraminisL.)传播的一种麦类土传病毒——小麦黄花叶病毒(Wheat yellow mosaic virus, WYMV)引起的[1-2],该病早在1927年就由日本的Sawada发现和报道[3],至今仍对小麦的生产造成一定危害。在自然条件下,中国小麦花叶病毒(Chinese wheat mosaic virus, CWMV)与WYMV一样易感染小麦,导致严重的田间病害[4],且两者常发生复合侵染,因病害症状极其相似,给鉴定工作带来了一定难度。在中国,目前该病主要分布于淮河流域的河南、湖北、安徽、山东以及长江、黄河中下游的四川、陕西、江苏、浙江等省,据2013年的统计,在中国的发生总面积达2.00×106hm2[5-7],已经对中国的小麦产量和品质都造成了严重影响,因此急需建立一种能够准确、规模化检测该病毒的方法,为小麦黄花叶病的防控提供技术保障。
目前,针对WYMV的检测主要有电镜观察、血清学、分子生物学等方法。早在2000年叶荣等就采用电镜观察法对WYMV的典型病毒粒子进行了诊断[8],但此方法的仪器精密,价格昂贵;血清学检测,Xing等以P2蛋白[9]、向荣等以P1蛋白[10]、韩成贵等以CP蛋白[11]的原核表达产物制备了相应抗血清,尚巧霞等[12]根据CP的原核表达建立了WYMV 的ELISA检测系统,耿波等[13]利用异种动物抗血清建立了双抗夹心ELISA 检测技术,但这些血清学方法应用于田间大规模样品的检测还未见报道;分子生物学检测,丛倩倩等[14]利用RT-PCR检测了山东地区小麦黄花叶病的发生情况,缪倩等建立了一步法快速检测WYMV和CWMV的RT-PCR方法, Tao等[15]建立了包括WYMV在内的小麦多种病毒的多重PCR检测体系,Zhang等[16]建立了检测WYMV的环介导等温扩增技术体系,Fukuta等[17]建立了包括WYMV在内的土传小麦花叶病毒多重RT-LAMP检测体系,但该技术的应用受仪器设备和操作人员技术的限制,成本高,耗时长,不适于田间大量样品的检测。因此本实验室利用蔗糖硫酸铯密度梯度离心法提纯了WYMV病毒粒子,以此为抗原免疫BALB/c小鼠,利用杂交瘤技术获得了3个分泌抗WYMV的杂交瘤细胞株,以此制备了WYMV的单抗腹水,并利用其中最灵敏的一株单抗建立了检测WYMV的ACP-ELISA方法,成功地应用于田间小麦黄花叶病毒的检测,为WYMV田间大规模快速检测的实现提供了物质和技术支撑,从而推动小麦黄花叶病的预报预警和科学防控体系的建立。
1 材料和方法
1.1 毒源
WYMV毒源繁殖于江苏省农业科学院植物保护研究所小麦黄花叶病旱池病圃,经RT-PCR鉴定后用于WYMV的提纯,-70 ℃冰箱保存提纯病毒。中国小麦花叶病毒(Chinese wheat mosaic virus, CWMV)和大麦黄花叶病毒(Barley yellow mosaic virus, BaYMV)经本实验室鉴定后保存。
1.2 WYMV的提纯
WYMV的提纯参照任春梅等[18]的方法加以改进,先将约400 g小麦病叶和0.5 mol/L磷酸盐缓冲液置于搅拌机,搅碎后用两层纱布过滤,滤液中加入300 ml 1/4四氯化碳搅拌5 min、静置10 min,8 000 r/min离心15 min取上清液,加入6% PEG-6000、3% NaCl和1% Triton.X-100,冰浴搅拌至全部溶解,4 ℃下放置6 h或过夜,8 000 r/min离心20 min,沉淀用悬浮缓冲液悬浮,10 000 r/min离心15 min取上清液,上清液加5 ml 30%蔗糖垫(含0.3%Triton.X-100),25 000 r/min离心2 h,沉淀用悬浮缓冲液悬浮,12 000 r/min离心10 min取上清液。进一步纯化采用蔗糖硫酸铯不连续密度梯度离心法,以 22 000 r/min离心3 h,取离心管上端1/3处为病毒层,用样品缓冲液稀释,40 000 r/min离心1 h,沉淀用0.5 ml样品缓冲液悬浮,即为所提纯病毒溶液。提纯病毒液经2%磷钨(PTA)染色后置JEM-1200EX电镜下观察病毒粒子形态。以纯化的WYMV病毒粒子作为抗原,制备抗WYMV的单克隆抗体。
1.3 小鼠免疫
参照Shang等[19]的免疫程序,选用7周龄左右雌性BALB/c小鼠6只,将提纯的WYMV与等体积弗氏完全佐剂(Freund's complete adjuvant, FC)混合,首次免疫采用皮下注射,2~3周后加强免疫1次,将抗原与弗氏不完全佐剂(Freund’s imcomplete adjuvant, FC)等体积混合,采用皮下及腹腔注射。4次免疫后采血检测,通过间接ELISA方法确定抗血清的效价,待效价大于1∶10 000,选择1~2只小鼠进行细胞融合。
1.4 细胞融合、筛选与亚克隆
1.4.1 细胞融合 首先依据Wu等[20]的方法,制备数量比为20∶1免疫小鼠的脾细胞和SP2/0鼠骨髓瘤细胞,再用DMEM基础培养基稀释细胞并用冷冻离心机离心弃上清,摇动离心管使细胞均匀,缓慢加入0.8 ml 50% PEG,反应90 s,加入20~30 ml DMEM培养基终止PEG,把融合的细胞放到37 ℃水浴锅中反应10 min,再离心弃上清液加入HAT DMEM培养基,最后置于CO2培养箱中培养,融合10 d后开始筛选检测。
1.4.2 融合筛选 检测前1 d,用PBS包被5 μg/ml抗原于ELISA板,过夜。次日吸取细胞上清液1孔100 μl进行间接ELISA检测,以提纯的WYMV和感染WYMV的病叶为阳性,健康小麦叶片为阴性,根据ELISA结果,判断是否阳性(样品孔OD值/阴性孔OD值≥2.1则判定为阳性)。用单道移液器挑检整板检测出的阳性孔,进行第二次ELISA确认检测,确定后的阳性孔细胞进行亚克隆。
1.4.3 亚克隆 参考Wu等[20]的方法,将强阳性反应杂交瘤细胞进行3次连续细胞克隆,挑出稳定传代细胞的单克隆扩大培养。
1.5 腹水制备和抗体纯化
1.5.1 腹水制备 参考Wu等[20]的方法,将杂交瘤细胞悬液注射入小鼠腹腔,再收集腹部明显膨大的小鼠腹水,离心取上清液即为腹水单克隆抗体,-20 ℃保存备用,待测定效价。
1.5.2 抗体纯化 参照汪谦[21]采用的辛酸硫酸铵方法纯化抗体,最后取少量进行效价测定。
1.6 抗体类型鉴定、效价测定和特异性分析
1.6.1 抗体类型及亚类鉴定 鉴定依据美国Sigma公司的抗体类型鉴定试剂盒操作说明进行。
1.6.2 抗体效价测定 将提纯的WYMV用碳酸盐包被液稀释为1 g/ml作为抗原,一抗采用倍比稀释的单抗,二抗应用辣根过氧化物酶标记的羊抗鼠IgG,参照Wu等[20]采用的间接ELISA方法测定腹水的效价。
1.6.3 Western blot分析单抗的特异性 选用WYMV和CWMV感染的小麦叶片、BaYMV感染的大麦叶片、健康小麦叶片为分析对象,参考刘欢等[22]的方法进行Western blot分析,SDS-PAGE电泳胶一部分用于考马斯亮蓝染色观察,另一部分电转移硝酸纤维素膜(NC)后与不同株单抗进行Western blot分析,测定单抗的特异性反应情况。
1.7 ACP-ELISA方法的建立
1.7.1 ACP-ELISA抗体最适工作浓度 根据刘欢等[22]的方法,利用WYMV的单克隆抗体建立其ACP-ELISA检测方法。用方阵实验确定单抗和酶标抗体的最适工作浓度。设置WYMV单抗浓度:4.000 μg/ml、2.000 μg/ml、1.000 μg/ml、0.500 μg/ml、0.250 μg/ml、0.125 μg/ml、0.062 μg/ml、0.032 μg/ml、0.016 μg/ml和0.008 μg/ml;HRP酶标记的羊抗鼠IgG二抗浓度:0.248 μg/ml、0.124 μg/ml、0.062 μg/ml、0.032 μg/ml、0.016 μg/ml、0.008 μg/ml、0.004 μg/ml和0.002 μg/ml,测定酶标仪上的OD450值。同时设健康小麦为阴性,每个处理3次重复。选取方阵中间OD450≈1.5,阴性,OD450<0.2对应的WYMV单抗和酶标二抗的稀释倍数作为最佳工作浓度。
1.7.2 ACP-ELISA特异性分析 利用以上建立的ACP-ELISA检测方法,测定WYMV感染小麦、CWMV感染小麦、BaYMV感染大麦病叶和健康小麦叶片在酶标仪上的OD450值,分析ACP-ELISA方法的特异性。
1.7.3 ACP-ELISA灵敏度分析 同上,以WYMV感染小麦病叶为阳性,健康小麦叶片为阴性,用0.01 mol/L的PBS(PH7.4)将小麦病叶从1∶100到 1∶102 400(g/ml)倍比稀释,健康小麦叶片作同样倍比稀释,进行ACP-ELISA方法的灵敏度分析。
1.8 ACP-ELISA方法的检测应用
应用建立的ACP-ELISA检测方法,对采自于江苏的高邮、宝应、仪征、常州、姜堰、兴化、盐都、淮安和大丰,安徽的寿县和来安,河南的遂平,山东的临沂、泰安和济宁等的小麦中小麦黄化叶病疑似样品进行检测,用温室生长的小麦健康叶片为阴性对照,病圃中经检测为小麦黄化叶病病叶为阳性对照,每个处理设3个重复,以P/N>2.1作为阳性判断标准。再对每个样品用RT-PCR方法进行验证,观察并记录结果。
2 结果与分析
2.1 小麦黄花叶病毒的提纯
用改进的方法提纯小麦黄花叶病毒样品,经2%磷钨酸负染后在透射电镜下观察到较纯且浓密的病毒粒子(图1),粒子形状呈直线状,长度约200 nm,直径约13 nm。用紫外分光光度法测得的浓度为5.44 mg/ml。

图1 WYMV病毒粒子的电镜观察Fig.1 Electron microscopic observation of wheat yellow mosaic virus (WYMV) particles
2.2 杂交瘤细胞的融合率、阳性率和克隆
提纯的WYMV免疫小鼠,经融合、筛选和培养后,18块96孔板细胞的融合率达到100%。当杂交瘤细胞生长至覆盖孔底 20~30%时,以提纯病毒为包被抗原采用间接ELISA方法对融合细胞进行阳性筛选,结果显示阳性率为9.5%。利用有限稀释法对5个阳性反应强、特异性好的杂交瘤细胞进行3次细胞克隆,最终获得6F4、2D3和2D4共3株生长良好且能稳定分泌抗WYMV的单抗杂交瘤细胞株。
2.3 抗体的制备和特性鉴定
用克隆好的杂交瘤细胞注射BALB/c小鼠腹腔,采集腹水,最终3个细胞株各获得约25 ml腹水。3株腹水纯化后的IgG含量在1.45~3.10 mg/ml(表1),经试剂盒鉴定,3个抗体均为IgG1、κ链,间接ELISA方法测得3株腹水单抗的效价达 10-7~10-6(表1)。
表1WYMV单克隆抗体(MAbs)的特性
Table1Propertiesofmonoclonalantibodies(MAbs)againstWYMV

单克隆抗体单克隆抗体类型单克隆抗体腹水效价IgG含量(mg/ml)6F4IgG1,κ链10-61.452D3IgG1,κ链10-62.302D4IgG1,κ链10-73.10
2.4 单抗的特异性分析
Western blot结果表明,6F4和2D4两株抗体均能与WYMV病叶中1条约32 kD的蛋白亚基结合,而在CWMV和BaYMV病叶、健康小麦叶片中均没有出现任何条带(图2),说明这两株单抗均能与WYMV外壳蛋白亚基特异性结合。2D3抗体在WYMV、CWMV、BaYMV病叶、健康小麦叶片中均未检测到任何条带,但ACP-ELISA检测时2D3抗体与WMVY病毒呈阳性反应,故推测2D3单抗是针对WYMV构象型的抗原决定簇,具有一定的空间构象,其空间结构由于电泳过程中的变性而被破坏,使得单抗不能与抗原结合。
2.5 ACP-ELISA法的条件优化
经方阵实验, ACP-ELISA法中6F4、2D4和2D3的3个单抗的最适工作浓度分别为0.50 μg/ml、0.25 μg/ml和2.00 μg/ml,酶标二抗的最适工作浓度为0.062 μg/ml。

M:蛋白marker;1、5和9:WYMV感染小麦病叶提取液;2、6和10:CWMV感染小麦病叶提取液;3、7和11:BaYMV感染大麦病叶提取液;4、8和12:健康小麦叶片提取液。图2 WYMV单克隆抗体(MAbs)与病毒衣壳蛋白的Western blot分析Fig.2 Western blot analysis of WYMV coat protein with monoclonal antibodies(MAbs)
2.6 ACP-ELISA法的特异性分析
3个抗体建立的ACP-ELISA法的特异性分析见图3,结果显示3个单抗的ACP-ELISA检测中,只有WYMV感染病叶出现了强阳性反应,而CWMV和BaYMV感染病叶与健康小麦叶片为阴性反应,说明这3种单抗建立的ACP-ELISA方法均具有很好的特异性。
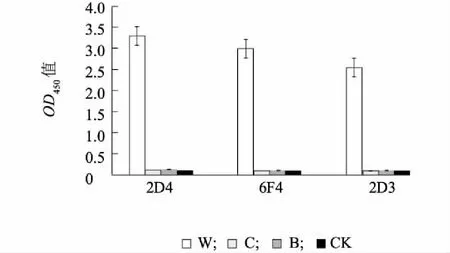
W:WYMV感染的小麦叶片;C:CWMV感染的小麦叶片;B:BaYMV感染的大麦叶片;CK:健康小麦叶片。图3 ACP-ELISA的特异性Fig.3 Specificity of the ACP-ELISA
2.7 ACP-ELISA法的灵敏度
灵敏度分析结果表明,以2D4单抗建立的ACP-ELISA检测病叶的灵敏度最高,当小麦病叶以1∶25 600倍稀释时,仍呈阳性反应;而以6F4和2D3单抗建立的ACP-ELISA检测病叶的灵敏度稍差(图4)。
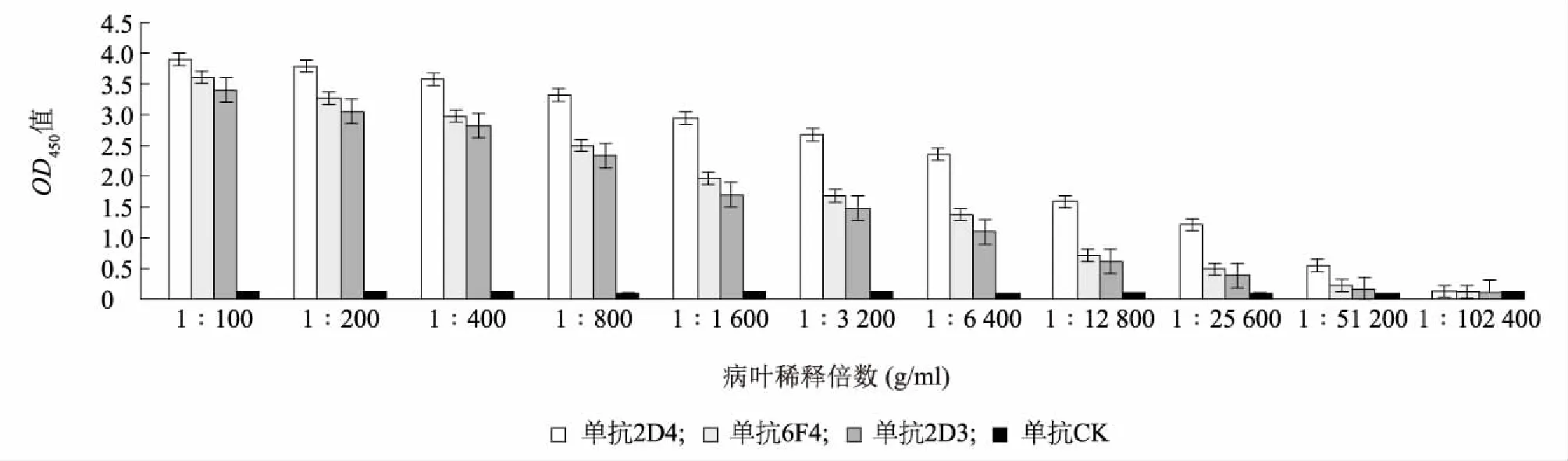
图4 ACP-ELISA的灵敏度Fig.4 Sensitivity of the ACP-ELISA
2.8 ACP-ELISA法的检测应用
应用最灵敏的2D4单抗建立的ACP-ELISA检测方法对采自中国4个省15个县、市的60个样品进行检测,结果见表2。由表可知,WYMV的分布广泛,除江苏的淮安、大丰和仪征三地的小麦样品中未检到外,其余12个县、市均有分布,阳性检出率在63.63%以上,说明WYMV目前仍是麦子上较为流行的主要病毒。同时,小麦样品进一步用RT-PCR检测验证,结果表明与ACP-ELISA检测的阳性结果高度一致(图5),此外,阳性RT-PCR产物经核酸测序验证均为WYMV。说明本研究建立的检测WYMV的ACP-ELISA方法能够可靠、准确地用于小麦中WYMV的检测。
3 讨 论
单克隆抗体(monoclonal antibody, MAb)是由一个B淋巴细胞产生的针对一种抗原决定簇的抗体,因其特异性强、灵敏度高、可无限量生产等特点而被广泛应用,目前已被应用于生物学和医学的各个研究领域,促进了细胞学、遗传学、免疫学和病毒学等众多学科的发展[23]。自1982年西德科学家成功研制了烟草花叶病毒(Tobacco mosaic virus, TMV)的单克隆抗体,目前单抗在植物病毒学的检测方面得到了广泛应用。国内外学者已经制备了水稻、玉米、蔬菜等作物上几十种植物病毒的单抗,大部分都已应用于田间样品的检测,对控制病毒病害在田间的发生,减少经济损失,抗病筛选和病害流行预测都起到了十分重要的作用。
表2ACP-ELISA法检测田间疑似小麦黄化叶病样品结果
Table2DetectionresultsoffieldwheatsamplestestedbyACP-ELISA
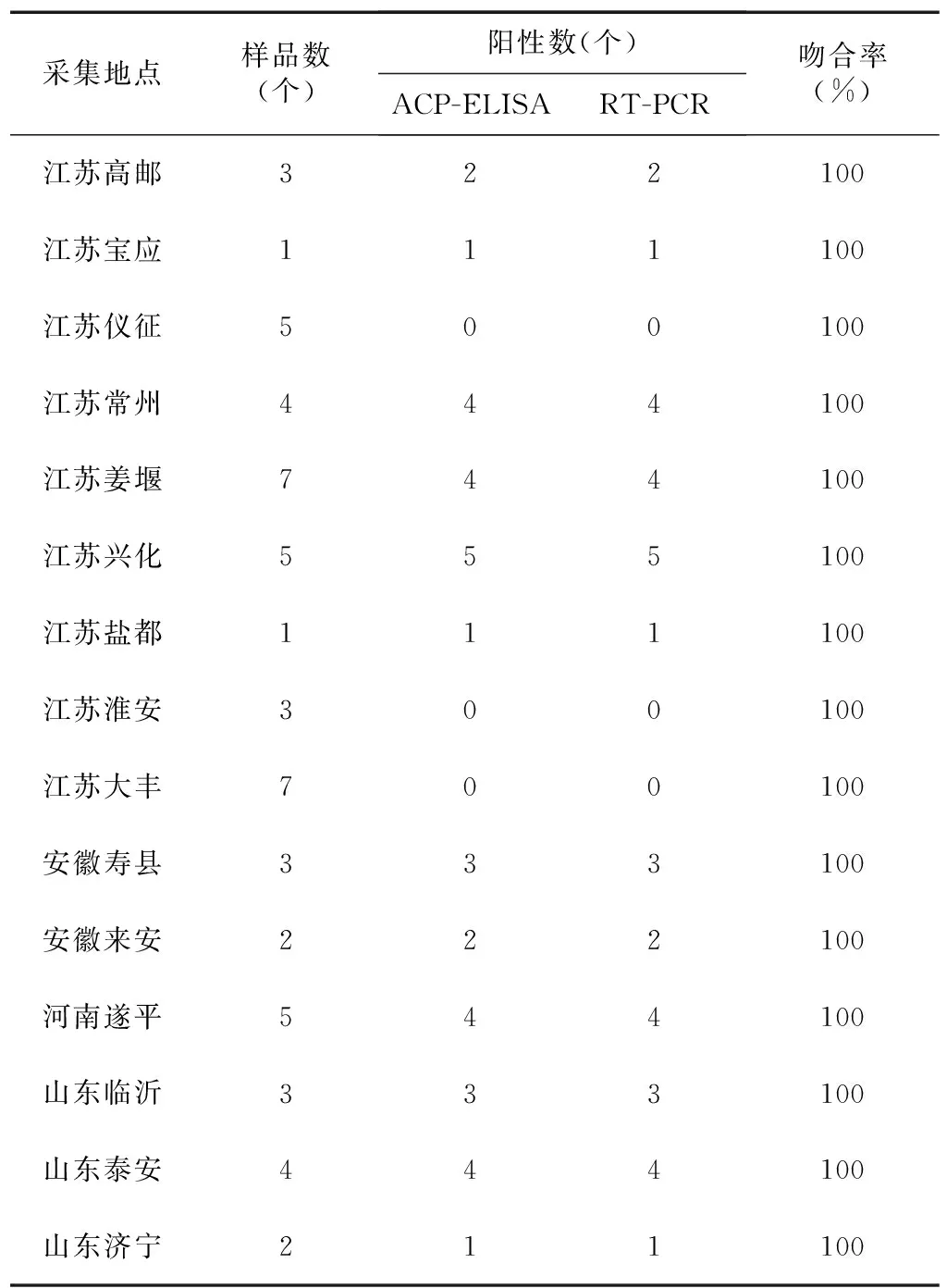
采集地点样品数(个)阳性数(个)ACP-ELISART-PCR吻合率(%)江苏高邮322100江苏宝应111100江苏仪征500100江苏常州444100江苏姜堰744100江苏兴化555100江苏盐都111100江苏淮安300100江苏大丰700100安徽寿县333100安徽来安222100河南遂平544100山东临沂333100山东泰安444100山东济宁211100
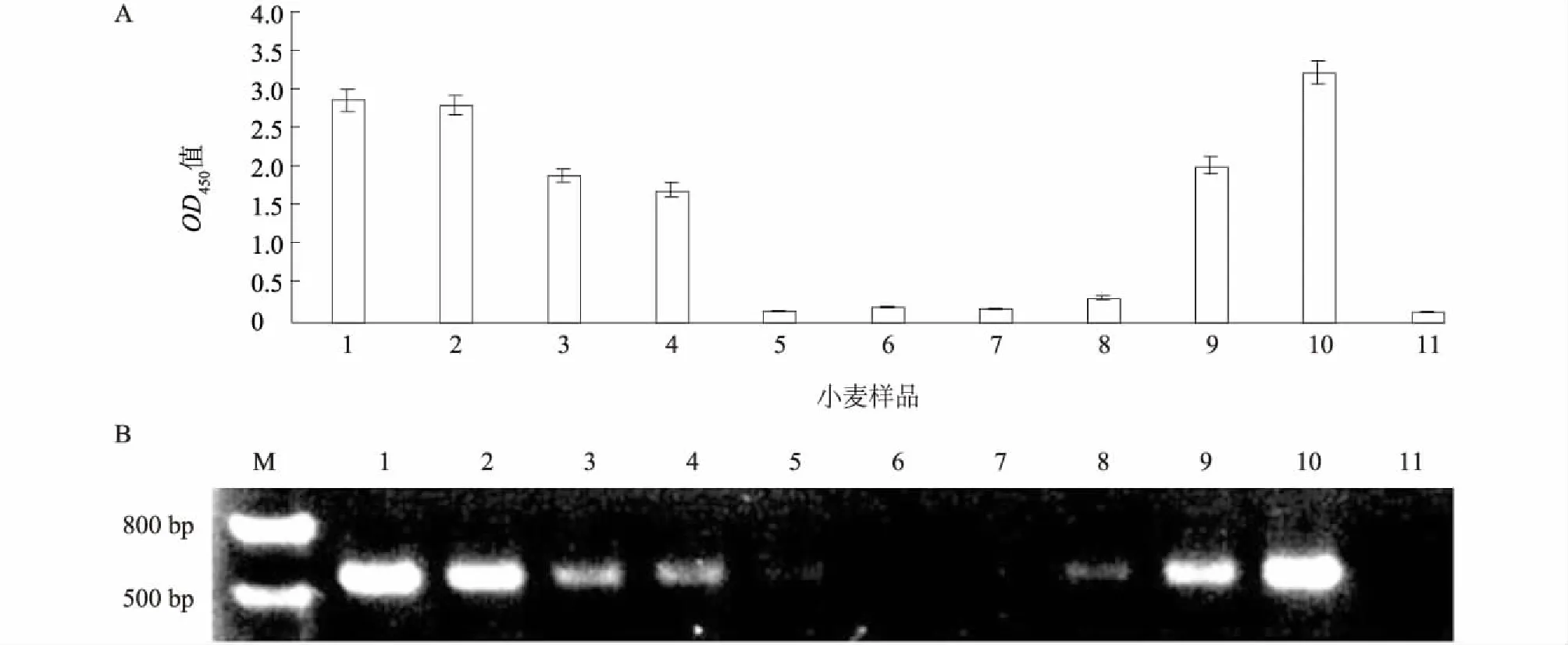
A: ACP-ELISA检测方法;B: RT-PCR检测方法;M:DNA分子量marker;1-9:田间小麦样品;10:WYMV感染小麦样品(阳性对照);11:健康小麦样品(阴性对照);图中扩增带均为520 bp WYMV目的条带。图5 ACP-ELISA法(A)和RT-PCR法(B)检测结果的吻合度Fig.5 Detection results of field wheat samples tested by ACP-ELISA(A) and RT-PCR(B)
近几年,随着耕作制度和推广品种的交替变化,小麦黄花叶病在山东、河南、江苏、安徽等冬小麦上发生仍然严重[24-25],因此亟待寻找到控制该病害的有效方法。其中病害的预测预报是前提,抗病品种的应用是首选,这些策略都会产生大量需要检测的样品。因为田间小麦黄花叶和小麦花叶病毒病的发病症状极其相似,而且常常发生复合侵染、隐症等现象,生物学方法不可有效鉴定。虽然分子生物学方法的灵敏度强且特异性好,但其需要更高的成本和更精密的仪器,且对操作者的要求比较高,所以一般只局限于实验室使用。综合而言,血清学方法的操作相对简便,且具有特异性好、灵敏度高、成本低等特点,所以更适用于大规模田间样品的检测,也易于在基层进行推广。基于此,本研究从自建的小麦黄花叶病病圃中采集了大量病叶,用蔗糖硫酸铯密度梯度离心提纯病毒,免疫小鼠,通过杂交瘤技术得到了3株能高效分泌WYMV的单克隆抗体细胞株并制备了单抗腹水,其效价达10-7~10-6,以其为核心建立了检测WYMV的ACP-ELISA方法,其检测病叶的灵敏度达1∶25 600倍稀释,且特异性强。利用建立的ACP-ELISA方法测定中国小麦主产区小麦黄花叶病的发生情况,检测结果发现WYMV的感染率高达63.64%,说明该病仍是当下小麦上极易发生的病毒病害,应引起相关部门足够的重视,也提示我们快捷、高效、低成本检测方法研制的必要性。该方法虽不及RT-PCR法的检测灵敏度高,但检出率与其一致,说明其检测的可靠性。相比于多抗建立的检测方法,其具有特异性高、均质性好,且只要得到1株好的细胞株就可以无限量生产等优点。强特异性能有效解决田间WYMV和CWMV复合感染不易区分的难题,这在田间应用中的优点尤为明显。总之,以单抗为核心建立的ACP-ELISA方法具有操作简便、准确性强、易标准化和大规模生产等特点,可有效应用于田间小麦WYMV的检测,对该病毒病的诊断、预测、预报及防控具有重要意义。
[1] 陈剑平,阮义理,董玛佳. 我国一些地区发生的小麦土传病毒病原研究[J]. 病毒学杂志, 1989(2):176-181.
[2] 雷利娟,陈 炯,陈剑平,等. 我国真菌传线状小麦花叶病毒病病原初步鉴定为小麦黄花叶病毒(WYMV) [J]. 中国病毒学, 1998,13(1): 89-96.
[3] SAWADA E. Wheat yellow mosaic prevention[J]. Journal of Plant Protection (Byochugai-Zasshi), 1927, 14: 444-449.
[4] 缪 倩,季英华,任春梅,等. 一种快速同步检测小麦花叶病毒和中国小麦花叶病毒的方法[J]. 麦类作物学报, 2013, 33(3): 595-599.
[5] 孙炳剑,羊 健,孙丽英,等. 禾谷多黏菌传小麦病毒病的分布及变化动态[J]. 麦类作物学报, 2011,31(5): 969-973.
[6] 燕 飞,孙丽英,尚佑芬,等. 我国粮食作物病毒病发生与防控现状[J]. 植物保护, 2013,39(5): 33-37.
[7] 李 鹏,崔正勇,高国强,等. 小麦黄花叶病研究进展[J].山东农业科学,2017,49(8):168-172.
[8] 叶 荣,郑 滔,徐 磊,等. 山东烟台小麦土传病毒病由小麦黄花叶病毒和土传小麦花叶病毒相关病毒复合侵染所致[J]. 病毒学报, 2000,16(1): 80-82.
[9] XING Y, SU N, LI D. Over-expression of 72 kDa protein of wheat yellow mosaic virus inE.coliand preparation of its antiserum[J]. Chinese Science Bulletin, 2000, 45(6):525-528.
[10] 向 荣,孙丽英,孙炳剑,等. 小麦黄花叶病毒P1蛋白原核表达、抗血清制备及其检测[J]. 浙江农业学报, 2011, 23(2):324-328.
[11] 韩成贵,李大伟,于嘉林,等. 小麦黄色花叶病毒外壳蛋白基因E.coli表达产物特异性抗血清的制备及其应用[J]. 农业生物技术学报, 2002, 10(4):373-376.
[12] 尚巧霞,韩成贵,杨莉莉. 小麦黄花叶病毒的血清学检测[J]. 北京农学院学报, 2002, 17(2):15-17.
[13] 耿 波,韩成贵,翟亚锋,等. 利用异种动物抗血清双抗夹心法检测小麦黄花叶病毒[J].中国病毒学, 2003, 18(1):76-78.
[14] 丛倩倩,许斐斐,李向东,等. 山东小麦黄花叶病毒的分子检测与鉴定[J].山东农业科学, 2012, 44(11): 8-11.
[15] TAO Y, MAN J, WU Y. Development of a multiplex polymerase chain reaction for simultaneous detection of wheat viruses and a phytoplasma in China[J]. Archives of Virology, 2012, 157(7):1261-1267.
[16] ZHANG Z Y, LIU X J, LI D, et al. Rapid detection of wheat yellow mosaic virus by reverse transcription loop-mediated isothermal amplification[J]. Virology Journal, 2011, 8(1):550.
[17] FUKUTA S, TAMURA M, MAEJIMA H, et al. Differential detection of Wheat yellow mosaic virus, Japanese soil-borne wheat mosaic virus and Chinese wheat mosaic virus by reverse transcription loop-mediated isothermal amplification reaction[J]. Journal of Virological Methods, 2013,189(2):348-354.
[18] 任春梅,程兆榜,朱 慧,等. 3种麦类土传花叶病毒的多抗制备及检测应用[J]. 江苏农业科学, 2014, 42(11):143-146.
[19] SHANG H, XIE Y, ZHOU X, et al. Monoclonal antibody-based serological methods for detection of Cucumber green mottle mosaic virus[J]. Virology Journal, 2011, 8(1):228-236.
[20] WU J X, NI Y Q, LIU H, et al. Development and use of three monoclonal antibodies for the detection of Rice black-streaked dwarf virus in field plants and planthopper vectors[J]. Virology Journal, 2013, 10(1):114.
[21] 汪 谦. 现代医学实验方法[M], 北京: 人民卫生出版社, 1997:730-738.
[22] 刘 欢,倪跃群,饶黎霞,等. 南方水稻黑条矮缩病毒和水稻黑条矮缩病毒的单抗制备及其检测应用[J]. 植物病理学报, 2013,43(1):27-34.
[23] 孔 君,刘 箐,韩跃武,等. 单克隆抗体制备技术的最新进展及应用前景[J]. 免疫学杂志, 2011, 27(2):170-173.
[24] 陈剑平. 中国禾谷多黏菌传麦类病毒研究现状与展望[J]. 自然科学进展, 2015,15(5):524-533.
[25] HAN C G, LI D W, XING Y M, et al. Wheat yellow mosaic virus widely occurring in wheat(Triticum aestivum) in China[J]. Plant Disease, 2000,84(6):627-630.

