整体优化的信号肽和人溶菌酶基因在毕赤酵母的高效表达
陈珊珊, 丁 健, 李 鑫, 刘 军, 贾禄强, 槐强强, 孙佼文, 史仲平
(1.江南大学生物工程学院/工业生物技术教育部重点实验室,江苏 无锡 214100; 2.武汉轻工大学生物与制药工程学院,湖北 武汉 430040)
细菌对传统抗生素耐药性的增强使得越来越多的研究人员致力于开发一种新型的抗菌化合物。溶菌酶的抗菌机制不同于抗生素,不会使细菌产生耐药性,已引起科学界的极大关注[1]。溶菌酶又称胞壁质酶或N-乙酰胞壁质聚糖水解酶,能够水解细菌细胞壁中β-1,4糖苷键[2],破坏细胞壁肽聚糖的结构,从而保护宿主细胞免受细菌感染。按来源可将溶菌酶分为微生物溶菌酶、植物溶菌酶和动物溶菌酶,其中动物溶菌酶又可分为c、g、i 3种类型。人溶菌酶属于c型,由130个氨基酸组成,相对分子量为14 700[3],其表达量及活力远远高于其他物种。
溶菌酶作为一种天然蛋白质,能在胃肠内作为营养物质被消化和吸收,对人及动物无毒害作用,也不会在体内残留,是一种安全性很高的药品、饲料和食品添加剂。在畜牧业溶菌酶可用作饲料防腐剂和杀菌剂,邱伟海等[4]报道饲料中添加溶菌酶抑制剂可有效控制猪仔因消化不良而引起的腹泻;Sotirov等[5]报道溶菌酶可有效防治球虫病,提高鸡体的健康,减少死亡;此外在饲料中添加溶菌酶、聚合磷酸盐及甘氨酸等复合物可起到抑菌防腐的作用,延长饲料的保质期[6]。在医学上溶菌酶具有抗菌、抗炎症、抗HIV病毒以及抗肿瘤活性等应用价值[7-10]。在食品行业,溶菌酶可作为抗菌防腐剂添加到食品中,且对人体无任何毒副作用[11],也可利用其具有一定甜味的特点,作为低卡路里的食品甜味剂[12-13]。
目前,市场上销售的溶菌酶主要是从鸡蛋清、动物脏器等中提取获得的,这种溶菌酶热稳定性差,活力只有人溶菌酶活力的一半[14]。但人源溶菌酶受限于原料来源、纯化精制成本等因素,制备量较少,无法满足各领域的需求。因此,科研人员采用基因工程手段,将人源溶菌酶基因克隆至原核或真核表达载体中,用以生产溶菌酶。表达载体包括大肠杆菌[15]、酿酒酵母[16-17]、毕赤酵母[11, 18]以及黑曲霉[19]等。其中,巴斯德毕赤酵母(Pichiapastoris)具有遗传操作简单,拥有强诱导型甲醇氧化酶(AOX)启动子,能对外源蛋白质进行转录后修饰(包括糖基化和二硫键形成)等,表达的外源蛋白可通过信号肽引导分泌至胞外等诸多优点,是表达真核细胞来源蛋白质的理想系统之一。在将外源基因转入毕赤酵母前,研究者会根据毕赤酵母密码子偏爱性对外源基因序列进行优化设计。刘真英等[20]对柞蚕溶菌酶基因进行密码子优化后,其在毕赤酵母中表达量可达2.4 g/L,且纯化后的柞蚕溶菌酶比酶活力达到23 970 U/mg。Zhou等[18]对人源溶菌酶基因进行优化,并转入毕赤酵母(P.pastorisSMD1168)进行表达,发酵上清液中人源溶菌酶蛋白浓度为331 mg/L,比酶活力达到7 069 U/mg。经过密码子优化,许多蛋白质在毕赤酵母中实现了高效表达。但包括人源溶菌酶在内,不少蛋白质的基因编码序列经密码子优化后仍表达量较低。信号肽是蛋白质分泌表达的一个重要影响因素。有研究者发现,表达载体上的α信号肽序列优化后,毕赤酵母中外源蛋白分泌表达量显著提高[21-23]。因此,本研究根据毕赤酵母密码子偏爱性,对α信号肽序列和人源溶菌酶基因序列进行整体优化。并在优化的信号肽序列上2处不同位置,增加39个碱基,获得增长的α信号肽序列,并与人源溶菌酶基因碱基序列相连。将2个优化后的信号肽+溶菌酶基因碱基序列分别插入表达载体pPICZα,并转入毕赤酵母KM71进行表达,以期在不影响酶活力的前提下,提高人源溶菌酶在毕赤酵母中的表达量。
1 材料与方法
1.1 试验材料
1.1.1 菌株和载体 真核表达载体pPICZαA购自Invitrogen公司,大肠杆菌DH5α、毕赤酵母KM71为本实验室保存。
1.1.2 酶及试剂 DNA限制性内切酶、DNA marker (DL2 000及DL10 000)、TaqDNA聚合酶、T4 DNA连接酶、TaKaRaExTaq酶以及Lysis Buffer for Microorganism to Direct PCR购自大连TaKaRa公司,zeocin、质粒提取、PCR产物回收及胶回收试剂盒购自上海捷瑞生物公司,YNB、溶菌酶标准品购自Sigma公司。
1.1.3 通用引物 AOX-F:5′-GACTGGTTCCAATTGACAAGC-3′;AOX-R:5′-GCAAATGGCATTCTGACATCC-3′;MF4-F:5′-AGCTTTCGAAACGATGGCTATTCCA-3′;MF4-R:5′-AGCTTCTAGATTACACACCACATCC-3′。
1.1.4 培养基 大肠杆菌培养基(DLB+LB)、酵母培养基(YPD、YPDS+zeocin)、诱导表达培养基(BMGY、BMMY)配制及培养方法参照EasySelect; 5 L发酵罐种子培养基、初始培养基、甘油流加培养基、甲醇诱导培养基参照文献[24]。
1.2 人源溶菌酶基因的设计合成及表达载体的构建
根据毕赤酵母偏爱性,对调控表达产物分泌的信号肽序列及溶菌酶基因进行优化设计,并在这段序列5′端加上BspT104Ⅰ酶切位点,3′端加上XbaⅠ酶切位点。采用全基因人工合成,并克隆至pPICZαA载体中构建含有人源溶菌酶基因的重组表达载体pPICZ-OptαF+hlyz。同时在已优化的信号肽的2处不同位置,插入A I P 和E EA E A E A E P K等氨基酸,并完成增长后信号肽序列的合成。将增长的序列插入pPICZαA空载,构建得到另一个人源溶菌酶表达载体pPICZ-EhnαF+hlyz(图1)。
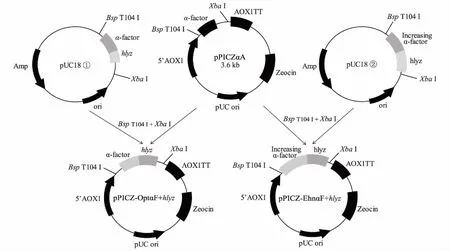
图1 pPICZα-hlyz构建示意图Fig.1 The schematic diagram of pPICZα-hlyz structure
1.3 重组表达载体对毕赤酵母的转化及鉴定
经测序验证正确的pPICZ-OptαF+hlyz及pPICZ-EhnαF+hlyz重组质粒,用SacⅠ酶线性化并回收,DNA量为5~10 μg。采用电转化法转化至毕赤酵母KM71。取100 μl转化产物涂布含Zeocin抗性的YPDS平板,培养2~3 d,观察菌的生长情况,将菌落用无菌水洗脱下来再经Zeocin浓度为 200~1 000 μg/ml的YPD平板筛选,从而获得更高拷贝数的菌株。
挑取平板上长势较好的菌落于4 ml YPD液体试管,28 ℃、220 r/min培养18~24 h,取100 μl菌悬液离心去上清液,加入50 μl裂解液并用枪头吹打混匀,85 ℃热变性15 min后,6 000 r/min离心2 min,取1 μl裂解的上清液作为PCR反应模板。扩增产物经1%琼脂糖凝胶DNA电泳验证。
1.4 重组菌株诱导表达
摇瓶表达:挑取单菌落接入装有25 ml BMGY培养基的250 ml三角瓶中,放置于摇床中以200 r/min的转速在30 ℃下培养18~20 h。将培养液转移至50 ml离心管中,5 000 r/min室温离心5 min,除去上清液,用25 ml的BMMY培养基重新悬浮细胞,继续培养,每隔24 h向培养基中添加无水甲醇,使其终浓度为0.5%,诱导表达72 h后,离心取上清液作进一步检测分析。
5 L发酵罐表达:按13%的接种量将种子液接入发酵罐中,初始发酵装液量为2 L,温度30 ℃,通气量为1.3 vvm,pH为6.0(用50%的磷酸和氨水调节pH)。发酵过程中溶解氧浓度(DO)逐渐下降,逐级提高搅拌速度将DO水平维持于20%以上。当初始培养基中的甘油耗尽时,DO急剧上升,启动DO-Start甘油流加程序,进入甘油流加阶段。当菌体浓度达到预期水平(OD600=200)时停止流加甘油,饥饿培养2 h后进入甲醇诱导阶段。通过On-Off控制模式调节甲醇流加速度,将甲醇浓度控制在5~10 g/L[25]。对于产量较高的K4进一步采取高密度(OD600=400)诱导策略。
1.5 重组人源溶菌酶蛋白产量分析及活力检测
采用SDS-PAGE凝胶电泳对重组人源溶菌酶进行定性分析,配制12%的分离胶及5%浓缩胶,电泳电压120 V,考马斯亮蓝染色液染色10 min,脱色10 min。
对发酵液总蛋白质含量测定采用Bradford法[26],以牛血清白蛋白为标准品绘制标准曲线,利用标准曲线计算发酵上清液总蛋白质含量。
利用管蝶法[27]鉴定人源溶菌酶的生物活性,并通过比浊法[28]定量测定人源溶菌酶酶活力大小。管碟法是效仿抗物素的生物学鉴定方法,指示菌为1.5%溶壁微球菌(OD600=1),双蝶制备好后静置10 min,在牛津杯中加入样品及阴性对照,24 h后观察透明圈的大小。比浊法以溶壁微球菌作为底物,通过菌悬液OD450处吸光度值的变化进行酶活力测定。溶壁微球菌活化及培养步骤参照国标GB/T 30990-2014。称取一定量的溶菌酶标品(100 000 U/mg),用缓冲液稀释成一定的浓度梯度(50~250 U/ml),取0.5 ml的酶液加入2.5 ml的菌悬液混匀,记录在450 nm处反应1 min时的读数A1,反应2 min时的读数A2,计算△E=|A1-A2|的值,以酶活力为纵坐标,△E为横坐标作酶活力标准曲线。同样测定发酵上清液的△E(1 min内的变化范围在 0.025~0.125),根据酶活力标准曲线计算出发酵上清液的酶活力。
1.6 数据处理
数据采用Excel2010、Origin8.5处理,使用SPSS10.0进行方差分析。
2 结果与分析
2.1 信号肽和溶菌酶基因碱基序列的整体优化
原始序列存在的主要问题有:1.载体上的酿酒酵母α信号肽及人源溶菌酶基因编码序列所使用的密码子有不少在毕赤酵母中属于稀有密码子;2.序列GC含量不平衡;3.序列中存在较多重复序列。针对上述问题,我们将α信号肽及人源溶菌酶序列作为一个整体进行序列优化,优化策略如下:1. 使用毕赤酵母偏爱密码子,替换序列中的稀有密码子;2.对α信号肽和人源溶菌酶蛋白中出现的丰度氨基酸,除了选择偏爱密码子外,也使用毕赤酵母第二或第三常用密码子,避免在表达过程中出现某一tRNA不足,影响蛋白质表达量;3.平衡序列整体及局部区域的GC含量控制在40%~60%;4.避免出现影响mRNA稳定及其他不利于表达的序列。按上述策略优化后的序列如图2所示。其中,α信号肽在原始序列密码子优化的基础上,在序列ATG后增加了共9个碱基,对应的氨基酸为AIP,在序列的190 bp位置后面加上1个胞嘧啶(C),而在193 bp后面加上29个碱基,连同193位的碱基一起表达10个氨基酸(氨基酸序列为E E A E A E A E P K)。因此,增长后的α信号肽比仅做密码子优化的信号肽多表达13个氨基酸。
2.2 重组表达载体的构建
根据毕赤酵母偏爱性和密码子组成的分析,对负责分泌表达的信号肽序列和溶菌酶基因进行整体优化,并完成全序列合成。通过BspT104Ⅰ和XbaⅠ酶切后,将合成序列插入pPICZαA载体中,构建得到人源溶菌酶表达载体pPICZ-OptαF+hlyz。使用引物5′AOX-F/3′AOX-R 对载体进行PCR鉴定,扩增出912 bp片段与信号肽加溶菌酶基因的大小完全一致。
以相同的方法,将增长的信号肽和溶菌酶基因碱基序列插入pPICZα载体中,构建得到另一个人源溶菌酶表达载体pPICZ-EhnαF+hlyz。使用引物MF4-F/MF4-R对载体进行PCR鉴定,扩增出722 bp片段与增长的信号肽序列的大小完全一致。DNA测序结果显示,上述PCR产物序列与对应的原始合成序列完全一致。

Q(Quary):信号肽序列和人源溶菌酶基因碱基序列作为一个整体进行密码子优化;S(Sbjct):在整体优化基础上作增长信号肽优化处理。信号肽:267 bp (增长后306 bp);溶菌酶基因:393 bp。方框中字母为2处增长序列插入位置。图2 原始的α信号肽和溶菌酶基因序列与优化后序列的比对Fig.2 Comparison of the original α-factor signal and human lysozyme(hLYZ) sequence with the optimized sequence
2.3 毕赤酵母的转化及筛选
将电转化后的酵母均匀涂布在Zeocin浓度为100 μg/ml的YPDS平板上,28 ℃培养3~4 d,将平板上的单菌落洗脱下来,按照方法1.3所述方法逐步增加抗生素浓度,提高筛选压力,筛选出可能带有高拷贝目的基因的菌株。整体优化的α信号肽和人源溶菌酶基因碱基序列重组进入毕赤酵母,经抗生素筛选后获得的重组子命名为K1,而将整体优化的α信号肽和人源溶菌酶基因又整合了增长信号肽的序列重组到毕赤酵母基因组上,经抗生素筛选后获得的重组子命名为K4。以AOX-F/AOX-R为引物对K1基因组,以MF4-F/MF4-R为引物对K4基因组进行PCR扩增鉴定。PCR扩增结果如图3所示,与预期基因大小相符。DNA测序结果表明2条整体优化后的信号肽和溶菌酶基因已稳定整合到毕赤酵母基因组上。
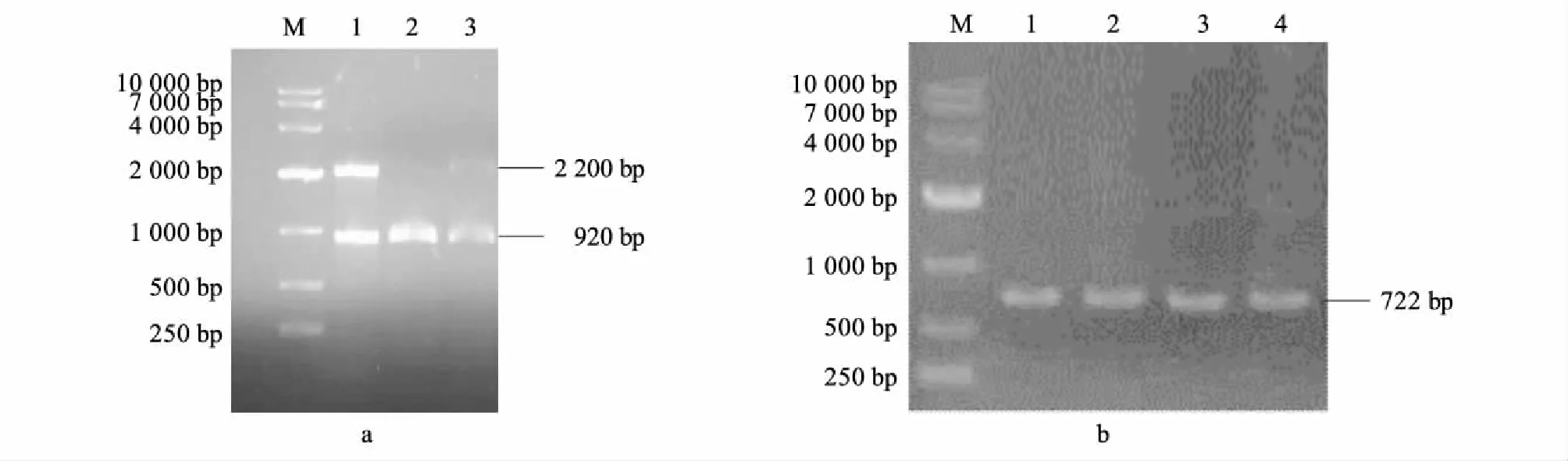
a图:M:DL10 000分子质量标准;1:阴性对照;2~3:K1重组子PCR鉴定。b图:M:DL10 000分子质量标准;1~4:K4重组子PCR鉴定。图3 毕赤酵母重组子PCR鉴定Fig.3 Identification of Pichia pastoris recombinants by PCR
2.4 重组菌株摇瓶诱导表达
对上述筛选并经过验证的重组子进行摇瓶表达。在诱导表达72 h后取发酵上清液,用SDS-PAGE电泳分析,结果如图4所示。1~3泳道表示重组子K1(信号肽和溶菌酶基因整体优化的重组子)摇瓶诱导试验的3个重复,在14 700处有明显的条带。5~7泳道表示重组子K4(信号肽和溶解酶基因整体优化后又整合了增长信号肽的重组子)摇瓶诱导试验的3个重复,K4重组子在14 700处的条带亮度明显高于重组子K1。通过Bradford法测定发酵上清液中总蛋白质含量,结果列于表1。信号肽和溶菌酶基因整体优化的重组子K1,平均总蛋白质产量为260 mg/L;整体优化的信号肽和溶菌酶基因又整合了增长信号肽的重组子K4,平均总蛋白质产量为320 mg/L,相比重组子K1提高了23%。
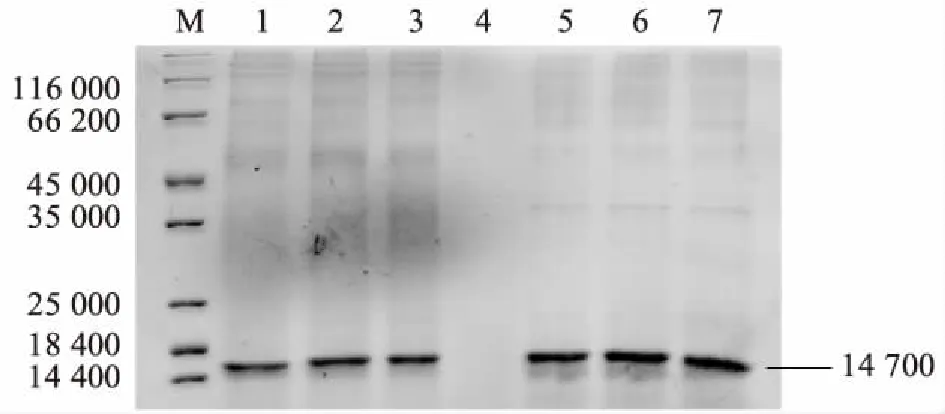
M:蛋白质分子量标准;1~3:K1重组子诱导表达72 h后发酵上清液;5~7:K4重组子诱导表达72 h后发酵上清液。图4 摇瓶表达产物SDS-PAGE分析Fig.4 SDS-PAGE analysis of the expression product by shaking bottle
2.5 人源溶菌酶酶活力
采用管碟法对重组子所表达蛋白质的抑菌活力进行定性检测,以磷酸盐缓冲液作空白对照,以KM71原始菌和携带pPICZα空载体的KM71菌株经诱导培养后的上清液作为阴性对照。结果如图5所示,空白对照、KM71原始菌和携带pPICZα空载体的KM71诱导的发酵上清液都未见有透明圈出现,而重组子K1和K4的发酵上清液所在区域,有明显透明圈出现。对比发现,重组子K4形成的透明圈要大于K1形成的透明圈。
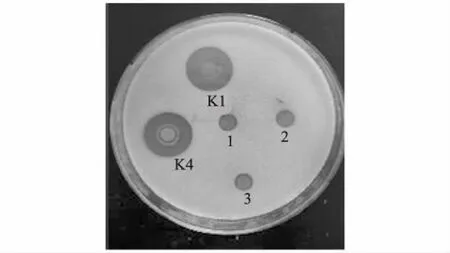
K1:信号肽和溶菌酶基因整体优化的重组子诱导表达的上清液;K4:整体优化的信号肽和溶菌酶基因又整合了增长信号肽的重组子诱导表达的上清液;1:空白对照;2:携带pPICZα空载体的酵母重组子诱导表达的上清液;3:KM71原始菌诱导表达的上清液。图5 重组毕赤酵母表达的人源溶菌酶抑菌效果Fig.5 Measurment of hLYZ activity by cylinder-plate method
进一步利用国标GB/T 30990-2014,以鸡蛋白溶菌酶标准品(标准曲线如图6所示),对重组毕赤酵母表达的人源溶菌酶进行活力检测,结果如表1所示。信号肽和溶菌酶整体优化的重组子K1,总酶活力平均值为12 937.0 U/ml;整体优化的信号肽和溶菌酶基因又整合了增长信号肽的重组子K4,总酶活力平均值为16 973.5 U/ml,略高于重组子K1的总酶活力。
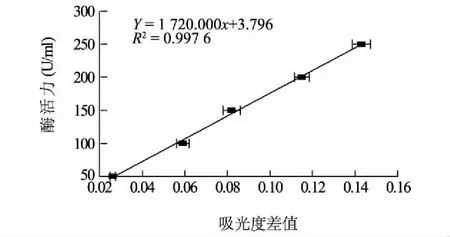
图6 以鸡蛋白溶菌酶为标准品的酶活力标准曲线Fig.6 Enzyme activity standard curve by chicken egg white lysozyme
表1重组子K1、K4摇瓶蛋白质表达量及酶活力
Table1TotalproteinandenzymeactivityresultofK1andK4byshakingbottle

重组子平均总蛋白(mg/L)平均总酶活力(U/ml)K1260±6B12937.0±1255.8BK4320±10A16973.5±627.9A
K1:信号肽和溶菌酶基因整体优化的重组子;K4:信号肽和溶菌酶基因整体优化又整合了增长信号肽的重组子。同列数据后不同大写字母表示差异极显著(P<0.01)。
2.6 重组菌株发酵罐规模诱导表达
在5 L发酵罐中进行重组子K1和K4的诱导表达试验,由于K4摇瓶蛋白质表达量及酶活力都比较高,因此K1采取低密度诱导策略,K4采取高低2种诱导策略。分别采集3个发酵批次诱导期的发酵上清液进行SDS-PAGE电泳分析,结果如图7所示。1~3泳道分别表示K1低密度(菌体浓度OD600=200)、K4低密度(菌体浓度OD600=200)、K4高密度(菌体浓度OD600=400)的发酵上清液样品。采用Bradford法测定发酵上清液中的总蛋白质浓度,总蛋白质浓度随时间呈现出逐渐上升的趋势(图8a)。K1菌株发酵批次诱导80 h总蛋白质浓度为1.71 g/L;K4低密度发酵批次诱导80 h总蛋白质浓度为2.54 g/L。K4高密度发酵批次诱导54 h总蛋白质浓度为3.02 g/L。3个批次发酵上清液中人源溶菌酶蛋白占总蛋白质的比例均不低于85%。采用比浊法测定3个批次最终发酵上清液的溶菌酶活力,结果表明:K1、K4低密度诱导80 h以及K4高密度诱导54 h发酵液中的总酶活力分别为262 152.0 U/ml、258 712.0 U/ml、324 072.0 U/ml(图8b),对应的比酶活力分别为152 971.9 U/mg、101 996.4 U/mg、107 030.7 U/mg(图8b)。

M:蛋白质分子量标准;1:K1重组子低密度诱导80 h发酵上清液;2:K4重组子低密度诱导80 h发酵上清液;3:K4重组子高密度诱导54 h发酵上清液。图7 重组菌株发酵罐表达产物SDS-PAGE分析Fig.7 SDS-PAGE analysis of the expression product via fermentation
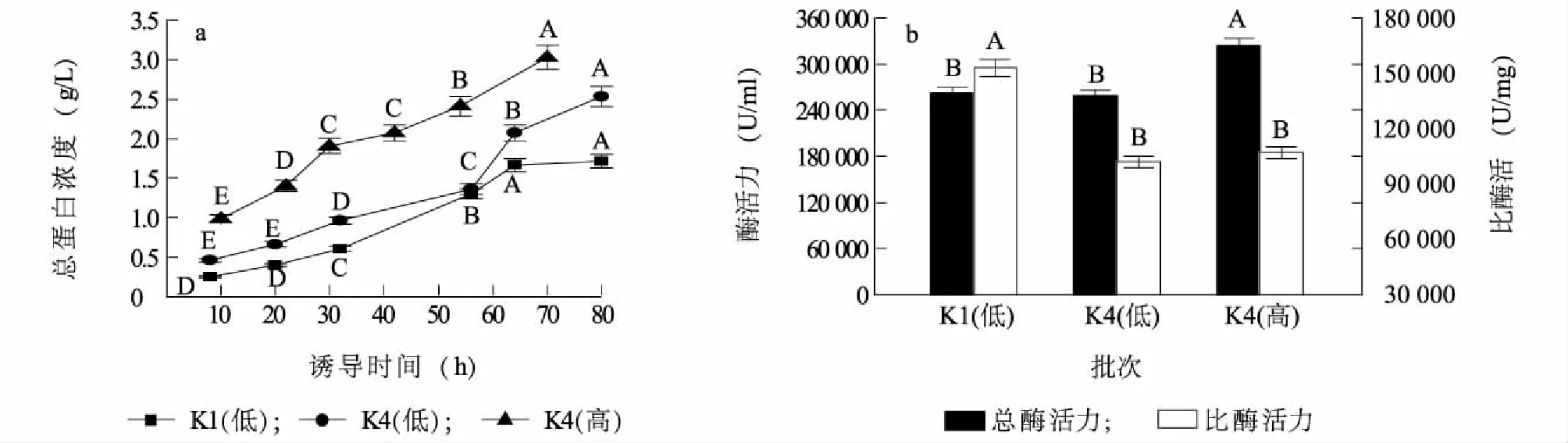
a: 3个发酵批次总蛋白浓度随时间变化趋势;b:3个发酵批次最终总酶活力及比酶活力。K1(低)、K4(低):K1、K4重组子低密度(OD600=200)甲醇诱导;K4(高):K4重组子高密度(OD600=400)甲醇诱导。不同大写字母表示差异极显著(P<0.01)。图8 不同批次最终总蛋白及酶活力Fig.8 Total protein and enzyme activities at different fermentation batches
3 讨 论
目前,已有500多种外源蛋白在毕赤酵母系统成功表达,但绝大多数外源蛋白的表达量并不是很高。人源溶菌酶在医药、食品、畜牧等行业具有广泛的应用前景,虽然通过基因工程的手段解决了原料来源、纯化成本等限制因素,但其在外源表达系统中表达量和单位体积发酵液中酶活总量并不高。因此,提高人源溶菌酶的表达量及酶活力是将其向市场推广的根本途径。许多研究人员根据毕赤酵母密码子偏爱性,对溶菌酶基因进行密码子优化,使溶菌酶蛋白表达量和酶活力总量得到一定程度提高[18,20,29]。但影响毕赤酵母表达外源蛋白的因素有很多,存在于转录、翻译、折叠修饰、细胞分泌等各个环节,因此,仅通过优化外源基因序列密码子对蛋白质表达量的影响程度非常有限。信号肽是分泌型蛋白质N端的一段富含疏水性氨基酸残基的短肽,其残基性质对于蛋白质的分泌效率和后续信号肽切割具有重要影响。陈熙等[22]利用PCR法将人源溶菌酶成熟肽与载体信号肽连接处的氨基酸残基进行定点突变,结果表明突变体人源溶菌酶表达量和活力较突变前均有显著提高。Xiong等[30]在优化植酸酶基因序列密码子的同时,使用经密码子优化的酿酒酵母α信号肽序列替换原有信号肽,整体转入毕赤酵母进行表达,相比使用原始信号肽的菌株,植酸酶产量提高了14.5倍。
本研究将α信号肽和溶菌酶基因作为整体进行密码子优化,再转入毕赤酵母进行表达。结果显示,5 L发酵罐诱导培养80 h后,总蛋白质表达量为1.71 g/L(人源溶菌酶占比超过85%),单位发酵液的总酶活力达到262 152.0 U/ml。相比之下,前期仅针对人源溶菌酶基因序列进行密码子优化的报道中,几乎没有见到总蛋白表达量到克级、单位发酵液总酶活力达到100 000.0 U/ml以上的。上述结果表明,将α信号肽和外源基因作为整体进行基因序列的密码子优化,可显著提高外源蛋白的分泌表达量。在α信号肽和溶菌酶基因碱基序列整体优化的基础上,我们又针对α信号肽序列做进一步优化,在α信号肽起始密码子ATG后增加毕赤酵母Aox1基因ATG后编码3个氨基酸(AIP)的碱基,另外,在信号肽序列第64位氨基酸后面,插入10个氨基酸(氨基酸序列为E E A E A E A E P K)。上述2种信号肽的改造曾应用于毕赤酵母表达植酸酶和胰岛素,外源蛋白分泌表达量分别提高5倍[21]和2[31]倍多。5 L发酵罐诱导培养80 h后,携带增长型α信号肽和溶菌酶基因的毕赤酵母重组子K4表达蛋白总量达到2.54 g/L,相比未增长信号肽前的重组子K1提高了48.5%。但其单位发酵液的总酶活力仅为258 712.0 U/ml,相比增长信号肽前的水平还略有降低。这可能是由于增长α信号肽的引入使毕赤酵母蛋白质分泌效率大幅提高,而毕赤酵母自身蛋白质折叠和修饰的能力有限,无法将大量分泌表达的溶菌酶酶原激活成为有活性的酶,造成了比酶活力的下降。为验证这一推论,在5 L发酵罐下采用了高密度诱导策略。诱导54 h后重组子K4的总蛋白质表达量达到3.2 g/L,单位发酵液的总酶活力为324 072.0 U/ml,对应的比酶活力与低密度诱导条件下获得的比酶活力水平相当。该结果基本佐证了上述推论。
本研究通过整体优化α信号肽和人源溶菌酶基因,实现了人源溶菌酶在毕赤酵母中的高效表达。在α信号肽和人源溶菌酶基因整体优化后又整合增长α信号肽后,人源溶菌酶在毕赤酵母中的表达量进一步提高,但受限于酵母自身蛋白质折叠修饰的能力范围,人源溶菌酶的比酶活力有所下降。在后续研究中我们将着眼于提高毕赤酵母的蛋白质折叠和修饰效率,以期在毕赤酵母高表达人源溶菌酶的基础上,实现更高的比酶活力。
[1] ZHAO H, TANG J Y, CAO L, et al. Characterization of bioactive recombinant antimicrobial peptide parasin I fused with human lysozyme expressed in the yeastPichiapastorissystem[J]. Enzyme and Microbial Technology, 2015, 77: 61-67.
[2] OZOREN N, KIM K H, BURNS T F, et al. The caspase 9 inhibitor Z-LEHD-FMK protects human liver cells while permitting death of cancer cells exposed to tumor necrosis factor-related apoptosis-inducing ligand[J]. Cancer Research, 2000, 60(22): 6259-6265.
[3] SWAMINATHAN R, RAVI V K, KUMAR S, et al. Lysozyme: a model protein for amyloid research[M]. San Diego: Elsevier Academic Press Inc, 2011: 63-111.
[4] 邱伟海,潘宏涛,蒋宏伟. 溶菌酶对断奶仔猪生产性能的影响[J]. 饲料博览, 2006 (2): 39-41.
[5] SOTIROV L, KOINARSKI V. Lysozyme and complement activities in broiler-chickens with coccidiosis[J]. Revue De Medecine Veterinaire, 2003, 154(12): 780-784.
[6] 花 城,陈立祥. 溶菌酶的功能及在畜牧业中的应用[J]. 湖南饲料, 2008 (4): 31-33.
[7] OGUNDELE M O. A novel anti-inflammatory activity of lysozyme: modulation of serum complement activation[J]. Mediators of Inflammation, 1998, 7(5): 363-365.
[8] LEE-HUANG S, MAIOROV V, HUANG P L, et al. Structural and functional modeling of human lysozyme reveals a unique nonapeptide, HL9, with anti-HIV activity[J]. Biochemistry, 2005, 44(12): 4648-4655.
[9] LEMARBRE P, RINEHART J J, KAY N E, et al. Lysozyme enhances monocyte-mediated tumoricidal activity: a potential amplifying mechanism of tumor killing[J]. Blood, 1981, 58(5): 994-999.
[10] GUO T K, ZHAO X H, XIE X D, et al. The anti-proliferative effects of recombinant human lysozyme on human gastric cancer cells[J]. Journal of International Medical Research, 2007, 35(3): 353-360.
[11] WEI J T, TANG C D, WU M C, et al. Cloning and functional expression of a human lysozyme gene (hly) from human leukocytes inPichiapastoris[J]. Molecular Medicine Reports, 2012, 6(1): 173-178.
[12] MATANO M, NAKAJIMA K, KASHIWAGI Y, et al. Sweetness characterization of recombinant human lysozyme[J]. Comparative Biochemistry and Physiology B-Biochemistry & Molecular Biology, 2015, 188: 8-14.
[13] MASUDA T, UENO Y, KITABATAKE N. High yield secretion of the sweet-tasting protein lysozyme from the yeastPichiapastoris[J]. Protein Expression and Purification, 2005, 39(1): 35-42.
[14] 刘仲敏,何伯安. 溶菌酶及其在食品工业中的应用[J]. 食品与发酵工业, 1995(5): 80-82.
[15] PING O, LIAN-CHENG L E I, SHUANG L V. Prokaryotic expression and biological activity of human lysozyme[J]. Chinese Journal of Biologicals, 2009, 22(6): 544-547.
[16] ARIMA H, KINOSHITA T, IBRAHIM H R, et al. Enhanced secretion of hydrophobic peptide fused lysozyme by the introduction of N-glycosylation signal and the disruption of calnexin gene inSaccharomycescerevisiae[J]. Febs Letters, 1998, 440(1/2): 89-92.
[17] YAMAMOTO Y, TANIYAMA Y, KIKUCHI M, et al. Engineering of the hydrophobic segment of the signal sequence for efficient secretion of human lysozyme bySaccharomycescerevisiae[J]. Biochemical and Biophysical Research Communications, 1987, 149(2): 431-436.
[18] ZHOU X Y, YU Y, TAO J J, et al. Production of LYZL6, a novel human c-type lysozyme, in recombinantPichiapastorisemploying high cell density fed-batch fermentation[J]. Journal of Bioscience and Bioengineering, 2014, 118(4): 420-425.
[19] PARRA R, ALDRED D, MAGAN N. A novel immobilised design for the production of the heterologous protein lysozyme by a genetically engineeredAspergillusnigerstrain[J]. Applied Microbiology and Biotechnology, 2005, 67(3): 336-344.
[20] 刘真英,李文利. 密码子优化后的柞蚕溶菌酶在酵母中的表达及活性测定[J]. 微生物学通报, 2016, 43(2): 292-300.
[21] 熊爱生,彭日荷,李 贤,等. 信号肽序列对毕赤酵母表达外源蛋白质的影响[J]. 生物化学与生物物理学报, 2003, 35(2): 154-160.
[22] 陈 熙,陈 毓,齐小雨,等. 人溶菌酶定点突变基因在毕赤酵母中的表达及活性分析[J]. 江苏农业学报, 2014, 30(6): 1396-1401.
[23] 齐小雨,陈 熙,张 炜. 人溶菌酶重组酵母工程菌的构建和活性干粉的制备[J].江苏农业学报,2016,32(5):1122-1127.
[24] 丁 健. 基于人工智能和代谢调控的典型好氧发酵过程在线控制和故障诊断[D].无锡:江南大学, 2014.
[25] ZHANG W H, BEVINS M A, PLANTZ B A, et al. ModelingPichiapastorisgrowth on methanol and optimizing the production of a recombinant protein, the heavy-chain fragment C of botulinum neurotoxin, serotype A[J]. Biotechnology and Bioengineering, 2000, 70(1): 1-8.
[26] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72: 248-254.
[27] 裘娟萍. 用管碟法测定碱性蛋白酶活力[J]. 氨基酸和生物资源, 1996, 18(2): 20-24.
[28] 赵玉萍,张 灏,杨严俊. 溶菌酶测定方法的改进[J]. 食品科学, 2002, 23(3): 116-119.
[29] 李新新,陶建军,余 龙. 人源溶菌酶基因LYZL4在毕赤酵母中的重组表达及活性测定[J]. 中国生物工程杂志, 2014, 34(1): 79-85.
[30] XIONG A S, YAO Q H, PENG R H, et al. High level expression of a recombinant acid phytase gene inPichiapastoris[J]. Journal of Applied Microbiology, 2005, 98(2): 418-428.
[31] KJELDSEN T, PETTERSSON A F, HACH M. Secretory expression and characterization of insulin inPichiapastoris[J]. Biotechnology and Applied Biochemistry, 1999, 29: 79-86.

