番鸭IGF-I基因克隆及其在肌肉组织发育中的表达规律
董 飚, 王 健, 段修军, 孙国波
(江苏农牧科技职业学院,江苏 泰州 225300)
采用性状独立淘汰法、综合指数法等传统的育种方法使畜禽生产性能得到了较大幅度的提升,但是生产性能到达一定水平后很难继续取得较大成效。随着分子生物学技术的出现和快速发展,一些基因的功能得到了验证,基于功能基因的现代育种手段可以快速、有效地提升畜禽生产性能。畜禽动物的生长受到神经内分泌生长轴的调控,其中起主导作用的是下丘脑-垂体-靶器官途径,此生长轴涉及胰岛素样生长因子、肌肉生长抑制因子、生长激素及其受体等一些功能基因。
胰岛素样生长因子(insulin like growth factors,IGF)最先在大鼠体内发现,其介导生长激素的促生长作用,与胰岛素许多结构高度相似,能与胰岛素受体竞争性结合,有类似胰岛素的作用,因此获得其名称。胰岛素样生长因子-I(IGF-I)是胰岛素样生长因子家族成员之一,是细胞生长增殖的调控信号之一,对机体细胞增殖、分化具有重要调控作用,在畜禽生长过程中发挥调控瘦肉率的作用。IGF-I基因在组织中的表达量和其功能有着密切的关系,对其进行研究具有重要的意义。在对大围山微型鸡、武定鸡和艾维茵肉鸡的研究中发现,鸡肝脏中IGF-I基因的表达量与体质量、体尺呈显著正相关[1]。在孵化13 d的鸭胚肝脏组织中就可以检测到IGF-I基因的mRNA表达,在早期生长发育过程中肝脏组织中IGF-I基因mRNA表达量与体质量的变化趋势一致,呈现极显著正相关[2]。同样,IGF-I在鸭肝脏组织中表达量有特定的发育模式且在品种之间存在差异[3]。在孵化7~17 d的鸡、鹌鹑及杂交后代胚胎肌肉中就可以检测到IGF-I基因mRNA表达,在孵化10 d时达到第一次峰值,孵化 15~16 d时达到第二次峰值,而且IGF-I基因mRNA表达规律与成肌细胞增殖和肌管融合规律一致[4]。鸡胚胎孵化中期(孵化9 d和孵化13 d)腿部肌肉组织IGF-I基因mRNA表达量显著高于孵化后期(孵化20 d),这可能与胚胎腿部肌肉的发育速度有关,中期发育速度较快,后期发育速度相对迟缓[5]。高邮鸭和金定鸭胚胎胸肌和腿肌成肌细胞中IGF-I基因mRNA表达规律基本一致[6]。在家禽胚胎期和早期生长发育过程中,IGF-I基因在组织中的表达研究已经取得一定的成绩。
在家禽生长发育过程中,IGF-I基因在肌肉组织中又是如何表达的。鉴于此,本研究根据GenBank上公布的禽类IGF-I基因序列设计引物,通过克隆、测序获得番鸭IGF-I基因序列,并采用生物学软件进行分析。同时采集番鸭早期第2、4、6、8、10、13周龄的肌肉组织,采用实时荧光定量PCR方法检测IGF-I基因在番鸭肌肉生长过程中的mRNA表达规律,为开展IGF-I基因功能研究增加资料。
1 材料与方法
1.1 试验材料
在番鸭2、4、6、8、10、13周龄时,各个时期末随机抽取10只鸭,公母各半。屠宰放血后,采集胸肌、腿肌组织置于液氮速冻,-80 ℃冻存备用。
1.2 试验方法
1.2.1 引物的设计 根据GenBank中公布的禽类IGF-I基因序列,用DNAMAN软件寻找该基因保守区并设计引物,引物由上海桑尼生物技术有限公司进行合成。引物序列及信息见表1,其中引物A1是用于IGF-I基因克隆,A2、A3分别用于实时荧光定量PCR时用于扩增IGF-I、β-actin基因。
表1基因克隆和mRNA表达所用引物信息表
Table1ThebasicinformationofprimersusedingenecloningandmRANexpression

引物名称 引物序列(5'→3')扩增产物(bp)退火温度(℃)A1F:TGCCCTCAACATCTCA-CATC56355R:TGGCACATTCATTCT-TCATTCTA2F:TGCTTCCAGAGTTGTGAC-CT15660R:TCCTGTGTTCCCTCTACT-TGA3F:CTATGTCGCCCTG-GATTTCG14760R:AAAGATGGCTG-GAAGAGGGC
1.2.2 RNA提取及反转录 采用Trizol试剂提取肌肉组织中总RNA,用核酸浓度测定仪检测RNA浓度和纯度,并用琼脂糖凝胶快速电泳检测RNA的质量。检测完成按照TaKaRa逆转录试剂盒说明书进行操作,以适量RNA为模板、Oligo(DT)为引物在逆转录酶的作用下合成cDNA。
1.3 PCR扩增
以cDNA为模板,引物A1进行PCR扩增获得IGF-I片段。PCR反应体系为25 μl:10×PCR 缓冲液 (无Mg2+) 2.5 μl,dNTP (2.5 mmol/L)2.0 μl,MgCl2(25 mmol/L) 1.5 μl,上、下游引物 (10 μmol/L)各 1.0 μl,Taq聚合酶 (5 U/μl) 0.2 μl,cDNA模板 1.0 μl,dH2O 16.8 μl。
1.4 克隆测序
将纯化后的PCR产物与pMD19-T载体连接,然后转化到感受态细胞DH5-α中,在含有氨苄青霉素的LB培养基平板上划线,37 ℃培养12 h。随机挑取菌落,用菌液PCR法和酶切质粒法筛选阳性克隆,每对引物挑选2个阳性克隆送上海桑尼生物技术有限公司测序。
1.5 实时荧光定量PCR检测
反应体系为:UltraSYBR Mixture (2×) 10.0 μl,上、下游引物(10 μmol/L)各 0.4 μl,模板 2.0 μl,加入灭菌蒸馏水至20.0 μl。反应程序:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 60 s,40个循环。
1.6 统计分析
基因测序结果用NCBI上的BLAST进行序列比对(http://www.ncbi.nlm.nih.gov.BLAST/),序列的翻译和不同物种之间序列进化关系作图用DNAMAN 6.0软件进行分析。不同组别之间基因表达差异性采用SPSS17.0统计分析软件进行数据分析。
2 结果与分析
2.1 IGF-I基因PCR扩增结果
取任意1个番鸭胸肌组织提取总RNA,然后进行反转录合成cDNA,以引物A1进行PCR扩增,扩增产物用1%的琼脂糖凝胶电泳检测,结果如图1所示,PCR扩增产物处于 500~750 bp,与预期的结果较为相似,初步断定其可能是IGF-I基因的序列。

1:分子量标准,DL2000;2、3:引物A1的PCR扩增产物。图1 番鸭IGF-I基因PCR产物琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis of IGF-I gene PCR products about Muscovy duck
2.2 序列分析结果
通过克隆测序获得563 bp的cDNA序列(图2)。运用软件分析发现这段序列包括了91 bp的5′端、462 bp的编码区、10 bp的3′端,编码153个氨基酸。

图2 番鸭IGF-I基因核苷酸序列及其编码的氨基酸序列Fig.2 Nucleotide and amino acid sequence of IGF-I gene on Muscovy duck
2.3 物种间序列同源性比较
不同物种之间IGF-I基因编码区核苷酸序列及其编码的氨基酸序列同源性见表2、表3。由表2可知,番鸭与野鸭(EU031044)、鹅(DQ662932)、鸡(FJ977570)、人(NM_000618)、小鼠(NM_001111275)、牛(HQ324241)、猪(JX827417)等物种IGF-I基因核苷酸序列同源性达 76.8%~99.1%,其中与鹅同源性最高,与小鼠的同源性最低。由表3可知,番鸭与野鸭、鹅、鸡的氨基酸序列同源性较高,均在98.7%以上,与小鼠、牛、猪的同源性为 77.8%~83.7%。
表2不同物种IGF-I基因核苷酸序列的相似性
Table2SimilaritycomparisonofnucleotidesequenceofIGF-Igeneindifferentanimals

动物相似度(%)番鸭野鸭鹅鸡人小鼠牛野鸭98.9鹅99.199.4鸡98.198.398.1人80.580.781.080.7小鼠76.876.876.877.388.7牛79.479.979.980.193.586.8猪80.380.780.780.793.588.394.4
表3不同物种IGF-I基因编码的氨基酸序列的相似性
Table3SimilaritycomparisonofaminoacidsequenceofIGF-Igeneindifferentanimals
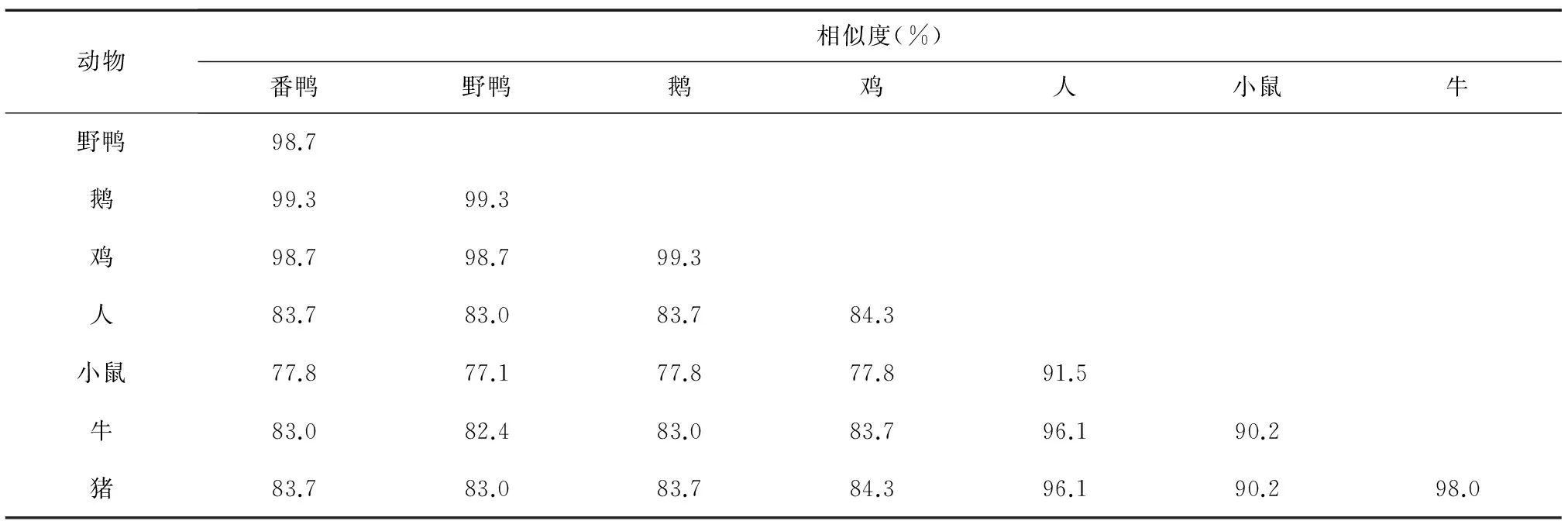
动物相似度(%)番鸭野鸭鹅鸡人小鼠牛野鸭98.7鹅99.399.3鸡98.798.799.3人83.783.083.784.3小鼠77.877.177.877.891.5牛83.082.483.083.796.190.2猪83.783.083.784.396.190.298.0
根据IGF-I基因编码的氨基酸序列同源性构建关系树(图3),主要分为两大类,一类是番鸭、野鸭、鹅和鸡禽类聚在一起,另外一类是哺乳动物聚在一起,其中猪和牛先聚在一起,然后再与人、小鼠聚在一起。

图3 不同物种IGF-I基因编码的氨基酸序列同源关系树Fig.3 Homologous relationship tree of IGF-I gene amino acid sequence in different animals
2.4 肌肉组织IGF-I基因mRNA表达
本试验采用qRT-PCR方法检测了番鸭生长过程中IGF-I基因在胸、腿肌组织中mRNA表达规律,详细见表4。在公鸭胸肌组织中,第2周龄IGF-I基因mRNA表达量显著性高于其他周龄;第6、8、10周龄间基因mRNA表达量无显著性差异,均显著性高于第4、13周龄;第4、13周龄间表达量无显著差异。在母鸭胸肌组织中,同样第2周龄表达量显著性高于其他周龄;第6、8周龄间表达量无显著差异,显著性高于第4、10、13周龄;第4、10、13周龄间表达量无显著差异。
在公鸭腿肌组织中,第2周龄IGF-I基因mRNA表达量最高,显著性高于其他周龄;第8、10周龄间表达量无显著性差异,显著性高于第4、6、13周龄;第6、13周龄间表达量无显著性差异,显著性高于第4周龄。在母鸭腿肌组织中,第2周龄IGF-I基因mRNA表达量最大,显著高于其他周龄;第13周龄表达量显著高于第4、6周龄,第4、6、10周龄间表达量无显著差异。
在肌肉组织中IGF-I基因mRNA的表达量均表现为第2周龄最高,然后下降,在第4周龄出现最低点,不同性别、组织中回升的速度不同,在最后阶段,除母鸭腿肌外,其他肌肉组织中IGF-I基因mRNA表达量再次下降。
表4番鸭不同时期IGF-I基因表达量
Table4IGF-IgeneexpressionofMuscovyduckatdifferentstages

周龄公鸭胸肌腿肌母鸭胸肌腿肌20.74±0.11a0.46±0.04a1.14±0.14a0.28±0.09a40.24±0.04c0.13±0.02d0.16±0.03c0.02±0.01c60.52±0.02b0.21±0.02c0.74±0.03b0.05±0.01c80.61±0.04b0.33±0.03b0.71±0.05b0.07±0.02bc100.61±0.04b0.34±0.04b0.17±0.03c0.09±0.02bc130.21±0.03c0.24±0.04c0.21±0.02c0.14±0.02b
同一列数据后不同字母表示差异显著(P<0.0.5)。
3 讨 论
随着人类基因组计划的顺利实施完成,生物技术的快速发展,测序效率的提升,成本的降低等,促进了其他动物基因组测序工作。动物基因组测序结果有利于开展相关基因后续研究工作。在禽类,鸡的基因组序列早已公开,鸭和鹅基因组测序工作已经结束,但是序列未公开发布。本试验对番鸭IGF-I基因进行克隆和序列分析,获得了1个cDNA序列,其中编码区序列包括了462 bp,编码153个氨基酸,番鸭与野鸭、鹅、鸡IGF-I基因核苷酸序列的同源性比较高,在98.1%以上,而与人和哺乳动物的同源性在80%左右,物种间的进化关系结果表明鸭IGF-I基因的功能与其他家禽更为相似。
IGF-I是一种高效能因子,通过影响动物蛋白沉积、肌细胞增殖、成肌细胞分化以及肌管融合等方式促进动物骨骼肌生长发育[7]。史旭升等[8]在28日龄、56日龄鹅的胸肌、腿肌组织中均可以检测到IGF-I基因mRNA表达,且28日龄的肌肉中表达量要高于56日龄,这说明IGF-I基因可能参与调控鹅肌肉的生长发育。Serrano等[9]在第12-16 d的鸡胚大脑、胰腺组织中可以检测到IGF-I基因mRNA的表达,在肝脏中没有检测到,出壳后肝脏组织中IGF-I基因的mRNA表达量才逐渐升高,说明胚胎期间所有的IGF-I均来自肝外组织。Richards等[10]发现火鸡孵化第14 d就可以在脑和肝脏组织中检测到IGF-I基因mRNA表达,但是在整个孵化期间IGF-I基因mRNA表达量都比较低,在出壳后快速上升,第3周龄时组织中IGF-I基因表达量是胚胎期的8倍,脑组织中IGF-I基因mRNA表达量比肝脏组织中高,而且脑组织中的表达量随着生长逐步上升,在3周龄时达到最高值。试验结果显示,肌肉组织中IGF-I基因mRNA表达量在第2周龄最高,这与Yun等在肉鸡上的研究结果[11]较为相似。但是番鸭在第4~6周龄时表达量出现了反弹现象,这又与在鸡上的表达存在差异,说明IGF-I基因在家禽早期生长发育过程所起的作用是相似的,但是会受到物种因素的影响而不同。公番鸭胸肌组织中IGF-I基因mRNA表达量在第8~10周龄出现下降,而母鸭在10~13周龄出现下降;公鸭腿肌组织中IGF-I基因mRNA表达量在第10周龄出现反弹高峰,而母鸭在13周龄还在反弹。IGF-I基因在公、母鸭肌肉组织中表达规律的差异可能与公、母番鸭的生长速度不同有关,在前期的工作中可发现刚出雏时公、母番鸭的体质量较为接近,但是公鸭的生长速度要比母鸭快,在第2周龄开始差异就已经达到了显著性水平,在10周龄左右公鸭的体质量一般是母鸭的1.5倍[12]。胸肌组织中IGF-I基因mRNA表达量要比腿肌组织中高,这是否与胸肌组织发育比褪肌组织发育迟、发育时间长有关,还需进一步认证。通过本试验,阐述了番鸭IGF-I基因在肌肉生长发育过程中的表达规律,为进一步研究IGF-I基因的功能以及通过日粮营养调控其表达提供了资料。
[1] 荣 华,豆腾飞,张丽春,等. 大围山微型鸡IGF-I基因表达量与生长性状的相关性分析[J]. 中国家禽, 2015, 37(4):5-8.
[2] 胡 艳,宋 迟,宋卫涛,等. 鸭发育早期肝脏IGF-ImRNA的表达特异性及其与体质量的相关性分析[J]. 南京农业大学学报, 2013, 36(6):95-99.
[3] 常明雪,朱文奇,章玲玲,等. 不同日龄鸭肝脏中IGF-I及IGF-IR基因表达规律的研究[J]. 扬州大学学报(农业与生命科学版),2013, 34(1):23-27.
[4] 梁耀伟,赵宗胜,陈丹盈,等.IGF-I在不同鸡与鹌鹑杂交禽胚胎肌肉发育过程中的表达规律与差异[J]. 新疆农业科学, 2012,49(9):1717-1722.
[5] 商 鹏,张 浩,张 博,等.IGF-I及其受体IGF-IR基因在鸡胚胎腿肌发育过程中表达模式分析[J]. 中国农业大学学报, 2017,22(1):48-51.
[6] 姬改革,陶志云,朱春红,等. 不同品种鸭胚胎期骨骼肌成肌细胞GHR核IGF-ImRNA表达差异分析[J].浙江农业学报, 2016,28(3):406-411.
[7]FROST R A, LANG C H. Multifaceted role of insulin-like growth factors and mammalian target of rapamycin in skeletal muscle[J]. Endocrinology and Metabolism Clinics of North America, 2012, 41(2):297-322.
[8] 史旭升,孙永峰,杨童奥,等. 胰岛素样生长因子I基因在鹅不同发育时期肌肉组织中的表达[J]. 吉林农业大学学报, 2011, 33(2):214-217.
[9] SERRANO J, SHULDINER A R, ROBERTS C T, et al.The insulin-like growth factor I (IGF-I) gene is expressed in chick embryos during early organogenesis[J]. Endocrinology, 1990, 127(3):1547-1549.
[10] RICHARDS M P, POCH S M, MCMURTRY J P. Expression of insulin-like growth factor system genes in liver and brain tissue during embryonic and post-hatch development of the turkey[J]. Comp Biochem Physiol Part A Mol Integr Physiol, 2005, 141(1):76-86.
[11] YUN J S, SEO D S, KIM W K, et al. Expression and relationship of the insulin-like growth factor system with posthatch growth in the Korean Native Ogol chicken [J]. Poultry Sci, 2005, 84(1):83-90.
[12] 吉文林,段修军,孙国波,等. 黑羽番鸭2个品系生长发育规律及体尺比较[J]. 江苏农业科学,2012, 40(12):205-207.

