生物起搏中的病毒载体
张健 综述 黄从新 审校
(武汉大学人民医院心内科 武汉大学心血管病研究所 心血管病湖北省重点实验室,湖北 武汉 430060)
心脏生物起搏是指通过利用基因过表达、基因抑制、干细胞基因修饰等相关技术对机体受损的自律性节律点或传导系统进行修复,从而构建一个“生物起搏器”,使心脏的起搏和传导功能得以恢复,从心脏的生理功能和人体适应性的角度,避免了传统电子起搏器的缺陷和严重并发症,是更理想的治疗方式[1]。基因治疗是构建“生物起搏器”的有效方法,即将目的基因导入受损的自律性节律点或传导系统的靶细胞中,通过导入目的基因表达相应蛋白质或抑制体内某基因的表达,从而达到恢复心脏起搏或传导功能的目的[2]。而通过病毒载体进行有效的基因转染是基因治疗的先决条件。良好的病毒载体系统必须具备三要素[3]:安全性(病毒基因组的拆分与去除)、转导高效性和相对特异性(受体-配体介导的主动转染)、基因组类型与宿主依赖性(不同病毒的感染表达特性与应用)。虽然现今所用的病毒载体有不错的效果,但均存在一定的局限性,现就当前生物起搏研究所涉及的病毒载体做一综述。
1 生物起搏中常用病毒载体的结构特性
病毒宿主范围广,可以高效转染分裂细胞与非分裂细胞,几乎适用于所有细胞系、原代细胞和部分组织,因此作为基因治疗的有利工具,广泛应用于实验研究和临床治疗;但病毒是病原体,在利用病毒时,通常去除其中多个和病毒活性相关的序列结构,再引入实验所需要的目的基因的序列和表达结构,而制备出具有感染力的病毒,通过感染细胞或活体组织,实现目的基因在细胞或活体组织中表达。目前生物起搏中常用的病毒是慢病毒、腺病毒和腺相关病毒(adeno-associated virus,AAV )(见表1)。
1.1 慢病毒
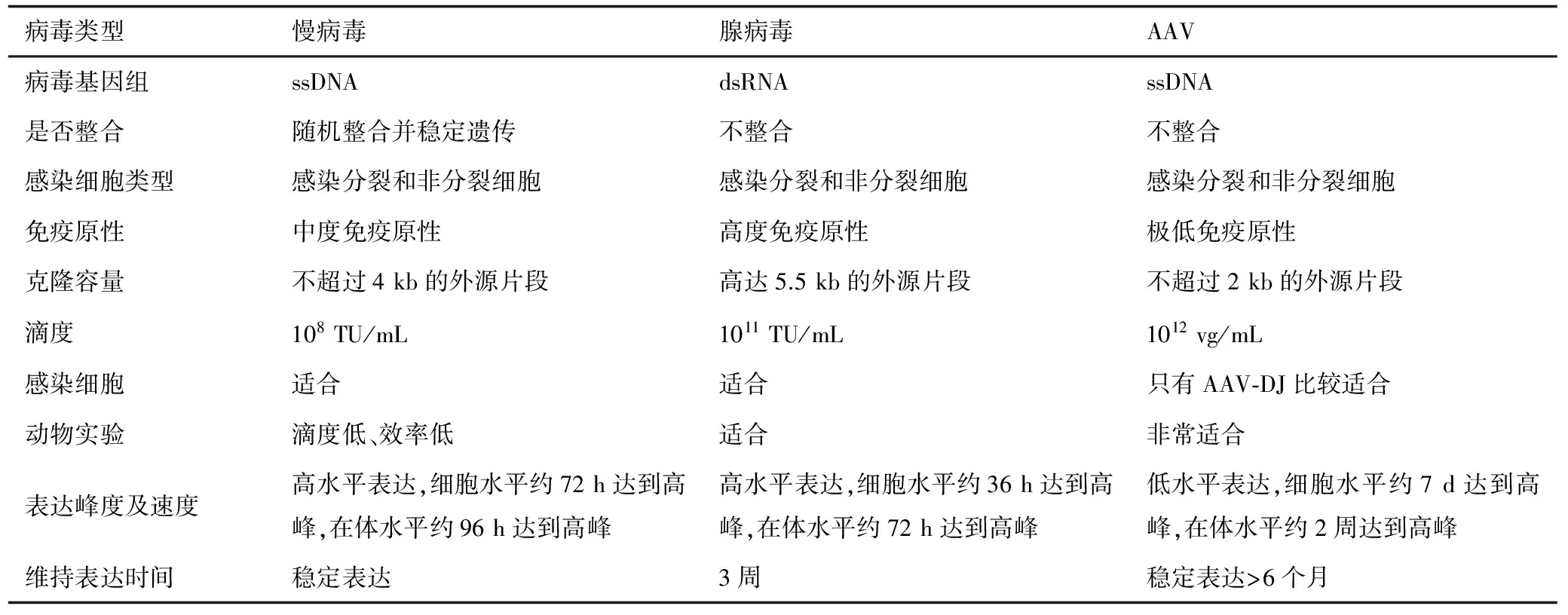
表1 不同病毒载体的主要特性
慢病毒属于逆转录病毒属,由两条相同的正链RNA组成的有包膜的球形病毒,通过DNA中间体复制,并与宿主细胞的染色体随机整合。现应用最广泛的慢病毒载体是以人类免疫缺陷Ⅰ型病毒为基础发展起来的。其主要优势如下[4-5]:(1)慢病毒载体系统宿主范围广,能够有效感染分裂细胞和非分裂细胞;(2)慢病毒载体能承载不超过4 kb的外源片段,滴度随插入片段长度增加而降低;(3)慢病毒能随机整合至宿主染色体上并对转录沉默作用有一定的抵抗力,形成稳定转染细胞系,持续高水平表达;(4)慢病毒载体中可以插入组织细胞特异性的启动子和增强子,提高转入基因的转录靶向性,使慢病毒载体中的目的基因在特定的组织细胞中表达。主要的局限[6-7]:(1)在体水平表达较差、转染动物滴度低、效率低,滴度一般为108TU/mL;(2)中度免疫原性、细胞毒性大、有致瘤致突变的危险,生物安全性较低;(3)表达周期长,约需96 h表达,作用起效缓慢。慢病毒载体的发展经历了4个阶段,从第一代的两质粒系统到第四代的四质粒系统[8],载体系统不断完善,生物安全性不断提高,使其实现在多种类型的细胞和动物中特异而稳定的基因表达和基因敲除都成为可能,并且继续保留了自身失活的优势,在基因工程的研究中发挥着非常重要的作用。
1.2 腺病毒
腺病毒是直径为65~80 nm的线性无包膜的双链 DNA 病毒。其中纤维突起长度不同,血清型也各不相同。因此纤维突起具有血清特异性,且含有负责体外血细胞凝集的种属特异性抗原决定位点[9]。腺病毒通过受体介导的内吞作用进入细胞内,然后腺病毒基因组转移至细胞核内,保持在染色体外,不整合进入宿主细胞基因组中,经过一系列剪切和转录过程,最终包装成新的病毒颗粒[10]。腺病毒载体经过第一代的复制区域缺失到第三代病毒基因的完全清除,不断利用更强的启动子及调控序列来提高腺病毒携带的外源基因在细胞内的表达水平[11]。目前,用于基因治疗是以5型腺病毒为代表的腺病毒载体,主要具有以下优势[12-14]:(1)腺病毒载体转基因效率高,体外实验通常接近100%的转导效率;(2)可高效转染不同类型的人组织细胞,不受靶细胞是否为分裂细胞所限;(3)外源基因容量大(7~8 kb),滴度随插入片段长度增加而降低;(4)通过细胞内复制可达到较髙的滴度,在细胞培养物中重组病毒滴度可达1011TU/mL;(5)安全性高,无插入突变激活癌基因的危险;(6)腺病毒载体生产工艺简便、制备纯化相对容易。由于这些突出的优势,腺病毒载体在基因治疗和临床试验方面有了越来越多的应用,成为继逆转录病毒载体之后广泛应用的病毒载体;但在应用过程中仍存在细胞难稳定转染、表达持续时间仅2~3周,动物上表达效率低、免疫原性高、易引起炎症反应和系统毒性等局限[15]。近几年,复制型、低抗原性和靶向腺病毒载体的出现,预示着随着对腺病毒的深入研究,对于腺病毒的应用会更加安全有效,在基因治疗中发挥更加重要的作用。
1.3 AAV
AAV是基因组为4.7 kb的线状单链无包膜DNA病毒,直径为20~26 nm,属于微小病毒科的依赖性病毒类,完整的感染周期需要腺病毒或者疱疹病毒参与,因此名为AAV。因此潜在的AAV基因组主要保持静止状态,直到有利的辅助条件才进行基因组切除和复制,从而实现病毒基因组表达。重组腺相关病毒载体(recombinant adeno-associated virus,rAAV) 源于非致病的野生型AAV,包括代替rep和cap基因的目的基因、启动子和多聚腺苷酸化序列。rAAV载体倾向于定点整合至宿主基因组,即核糖体DNA序列和回文序列,有利于维持治疗基因在分裂细胞的长期表达,并且减少了其他病毒随机整合可能导致插入突变的风险[16]。AAV主要优势如下[17-18]:(1)安全性最高(RK1级别),目前无报道其参与任何疾病的发生;(2)感染宿主范围广,感染分裂细胞与非分裂细胞;(3)相对特异性高,不同血清型可靶向不同器官;(4)免疫原性和宿主炎症反应极低;(5)表达时程长(可稳定表达半年以上);(6)超高的在体感染效率,滴度可达1012vg/mL;(7)具有较好的热稳定性和抗酸碱性;但也存在一定的局限[19-20]:(1)片段容量小:整个AAV基因组4 kb,引入启动子、荧光基团等固定元件后,外源插入片段在2 kb以内;(2)瞬时表达量较低,感染后需要较长时间才能达到表达高峰;(3)低水平表达,细胞水平需要表达7 d左右,动物水平需要表达2周左右;(4)感染体外细胞能力不强,细胞水平转染效率不高;(5)人类接触多种AAV血清型,体内中和抗体不断上升。从以上看,AAV作为基因治疗的基因递送载体在基础试验和临床研究方面都具有非常广阔的前景。
2 生物起搏中病毒载体的应用选择
目前生物起搏尚处于基础研究阶段,以病毒为载体进行基因治疗,从病毒载体的制备和选择,到表达时间的不断延长,均取得了不错的进展,但随之而来的致心律失常性、细胞毒性和致瘤性等安全问题也亟待解决。在基础基因治疗可细分为“体内” 基因传递与“体外”基因传递两种形式。
2.1 生物起搏的体外实验
体外实验是指在体外使用从其通常的生物学环境中分离的生物体组分进行研究,包括细胞试验、体外器官试验等,离开了体内的内环境调控,影响因素比较单一,且可人为控制,可实现物种特异性,可进行更简单、更方便和更详细的分析。生物起搏中的体外实验主要是细胞实验,将外源基因导入靶细胞,研究基因的表达调控、突变分析和蛋白质生产。细胞转染技术常规上可分为瞬时转染和稳定转染两大类。
瞬时转染,即外源基因进入靶细胞后,存在于游离的载体上,不整合在细胞的染色体上。典型代表就是腺病毒载体,因其体外转染效率高、外源容量大、无插入突变危险等上述优点,因而是目前在国内外生物起搏研究中应用最多的病毒载体,常作为携带目的基因的载体介导目的基因转染至靶细胞,从而诱导靶细胞向起搏细胞分化。例如将携带Tbx18的重组腺病毒载体转染脂肪干细胞,与新生大鼠心室心肌细胞共同培养,窦房结特异基因HCN4表达明显高于对照组,并可检测到超极化激活的内向离子电流(If)[21]。近年来研究者致力于胚胎发育通路的再激活,诱导出生后的心肌细胞向起搏样细胞转化,即心肌重编程,一旦心肌细胞重编程,将不再需要诱导基因的持续表达[22]。窦房结的发育机制十分复杂,是Tbx3、Tbx5、Tbx18、Shox2、Isl1等多种基因的多重调控和相互作用的结果。因此联合不同基因共表达,模拟窦房结发育过程,或许能从根本上实现形态和功能起搏。已有研究证明联合基因转染能提高重编程效率,3个转录因子即可诱导心肌重编程[23]。而腺病毒的外源片段容量较大,可以容纳较多基因片段,为实现心肌重编程提供了前提条件。
稳定转染即目的基因整合至宿主细胞的染色体上,生物起搏中的典型代表为慢病毒。例如,Zhou等[24]将携带HCN2的慢病毒转染至兔骨髓间充质干细胞,与新生兔心室肌细胞共同培养后,HCN2转染的骨髓干细胞的兔心肌细胞的平均搏动频率为(149±14)次/min,明显高于对照组(87±11)次/min,并且可记录到明显的If电流。Feng等[25]将携带Shox2的慢病毒载体转染犬骨髓间充质干细胞并与新生大鼠心肌细胞共同培养,与对照组相比心肌细胞搏动频率明显增加,发现Tbx3、HCN4和Cx45表达上调,而Nkx2.3和Cx43表达下调,结果表明,Shox2的过表达可以调节骨髓间充质干细胞在起搏器样细胞中的分化。慢病毒载体可实现目的基因在细胞中的高水平表达,为生物起搏的前期筛选提供了有利的工具。
2.2 生物起搏的体内实验
体内实验是指在生物(微生物、动物、人类)中进行的研究,能够真实反映受内环境(主要是神经系统、内分泌系统和免疫系统等的复杂网络)调控下干预措施的作用,是走向临床必经的阶段。生物起搏的体内实验主要是动物实验,目前有效的体内基因递送方式包括心肌局部注射、心外膜下注射和心包腔注射。
前期研究者试图通过腺病毒介导的离子通道基因的表达来诱导异位自律性。最常用的是心肌直接局部注射病毒载体,主要位点是左束支和希氏束,例如Boink等[26]将携带HCN2+AC1的腺病毒植入房室传导阻滞狗的左束支,在7 d内,犬的心率达到了(129±28.9)次/min,表明HCN2+AC1过表达比HCN2单基因表达具有更高效的生物起搏和更高的自主调节灵敏度。Cingolani等[27]将携带Kir2.1AAA+HCN2基因的腺病毒载体混合物通过导管注入三度房室传导阻滞猪的希氏束,转染基因的猪在14 d内心率(93.5±7)次/min明显高于安装电子起搏器猪的心率(59.4±4)次/min,注射部位有明显的自发起搏活动;但转基因表达易直接局限在注射位点周围,转染效率不佳。而心包腔注射,可以实现100%跨壁基因转染心房,可以考虑应用于生物起搏[28]。同时也发现了腺病毒作为载体携带基因构建生物起搏点有显著的局限性,即相对短暂的起搏活性和较高的免疫原性。因为腺病毒并不像其他病毒一样整合到宿主细胞的基因中,而是作为DNA游离体外存在于细胞核中,所以其介导的基因不能稳定表达,并且腺病毒一般于第2~3天开始表达,第6~7天稳定表达,最长持续28 d,可见腺病毒诱导的基因表达呈现短暂、瞬时、高效的特点,随着时间的流逝目的基因渐渐的丢失,这使得起搏功能并不能长期稳定地维持。
慢病毒载体与宿主细胞染色体随机整合并能实现稳定遗传,因此能实现心肌细胞在体内和体外的长期基因转染和表达,使构建稳定的生物起搏点成为了可能。例如,Lu等[29]将HCN4修饰的骨髓干细胞通过慢病毒载体注射三度房室传导阻滞狗的希氏束,结果发现体内表达功能性HCN4通道至少可以维持6周,产生生物起搏器活动,导致起始于注射部位的休息和运动心率明显高于对照组犬。然而慢病毒载体投入临床使用,由于存在启动子插入激活癌基因或导致抑癌基因的失活,易诱发肿瘤的可能性,因此其生物安全性仍存在很大的问题。但心脏组织主要由非分裂细胞组成,基因治疗不需要转染细胞的细胞分裂,治疗基因不参与细胞增殖,插入突变基因也从未证实在HIV阳性患者出现,所以,这种情况下,肿瘤形成的风险较低,慢病毒因此普遍认为是一个安全载体[30]。研究者应不断改进慢病毒载体系统,提高其生物安全性,进一步提高其病毒滴度,构建一个长期稳定的生物起搏点。
AAV是迄今为止最安全、 最良好、 最有前景的基因治疗工具。迄今为止,已有超过150种突变体,13种人类和非人类血清型,可以特异性靶向不同的组织或器官[31]。在众多血清型中,只有AAV-DJ比较适宜感染细胞,其余血清型表达效率较弱,但动物在体感染表达效率高,因此多用于动物实验。对心肌组织亲和力较强的有AAV1、AAV6、AAV7、AAV8和AAV9五种血清型[32]。其中,AAV9在心脏可实现高效稳定的基因转移且足够安全不影响心脏其他正常功能,表明AAV9可能是实现心脏基因转移载体的理想选择[33]。Chan等[34]提议用rAAV9实现hHCN1ΔΔΔ(S3-S4连接被删除,表达If电流生物学活性)在病态窦房结综合征和完全性心脏传导阻滞的猪模型中过表达,使心肌细胞转变为窦房结样细胞,增加起搏频率。由于其片段容量小、体外感染效率低等局限,迄今为止,在生物起搏中的应用仍较少。但AAV作为基因载体有着非常明显的优势,随着对其结构和生物特性的研究深入,AAV载体系统的不断完善,将在生物起搏的研究中发挥非常重要的作用。
综上所述,理想的病毒载体应是高滴度,具有优先的预先形成的免疫力,并能逃避宿主免疫反应,以预防与剂量相关的不良反应。除上述载体系统外,在基因的递送过程中,还有逆转录病毒、泡沫病毒等病毒载体和非病毒载体。另外,随着干细胞的研究发现,有学者联合应用基因生物起搏和细胞生物起搏技术,最终得到了高水平的类似If的电流,产生自发搏动心律[35-36]。研究者可根据不同的实验目的和条件选择不同的载体,然而到现在为止,只有一个基因载体应用于临床,表明在基因治疗中系统的靶向定位比预想中更复杂。日后关于生物起搏中病毒载体的研究,主要解决其免疫原性、细胞毒性和稳定性等问题,随着研究的深入和技术与方法的不断完善,生物起搏有着非常广阔的应用前景,将成为人们治疗缓慢性心律失常的新技术,造福于人类。
[1] Boink GJ,Christoffels VM,Robinson RB,et al.The past,present,and future of pacemaker therapies[J].Trends Cardiovasc Med,2015,25(8):661-673.
[2] Li RA.Gene-and cell-based bio-artificial pacemaker: what basic and translational lessons have we learned?[J].Gene Ther,2012,19(6):588-595.
[3] Chira S,Jackson CS,Oprea I,et al.Progresses towards safe and efficient gene therapy vectors[J].Oncotarget,2015,6(31):30675-30703.
[4] Ronen K,Negre O,Roth S,et al.Distribution of lentiviral vector integration sites in mice following therapeutic gene transfer to treat beta-thalassemia[J].Mol Ther,2011,19(7):1273-1286.
[5] Ambrosi A,Glad IK,Pellin D,et al.Estimated comparative integration hotspots identify different behaviors of retroviral gene transfer vectors[J].PLoS Comput Biol,2011,7(12):e1002292.
[6] Wang Z,Tang Z,Zheng Y,et al.Development of a nonintegrating Rev-dependent lentiviral vector carrying diphtheria toxin A chain and human TRAF6 to target HIV reservoirs[J].Gene Ther,2010,17(9):1063-1076.
[7] Torres R,Garcia A,Jimenez M,et al.An integration-defective lentivirus-based resource for site-specific targeting of an edited safe-harbour locus in the human genome[J].Gene Ther,2014,21(4):343-352.
[8] Groth AC,Liu M,Wang H,et al.Identification and characterization of enhancer-blocking insulators to reduce retroviral vector genotoxicity[J].PLoS One,2013,8(10):e76528.
[9] Miravet S,Ontiveros M,Piedra J,et al.Construction,production,and purification of recombinant adenovirus vectors[J].Methods Mol Biol,2014,1089:159-173.
[10] Alba R,Baker AH,Nicklin SA.Vector systems for prenatal gene therapy: principles of adenovirus design and production[J].Methods Mol Biol,2012,891(891):55-84.
[11] Dormond E,Perrier M,Kamen A.From the first to the third generation adenoviral vector: what parameters are governing the production yield?[J].Biotechnol Adv,2009,27(2):133-144.
[12] Raus S,Coin S,Monsurro V.Adenovirus as a new agent for multiple myeloma therapies: opportunities and restrictions[J].Korean J Hematol,2011,46(4):229-238.
[13] Huang GH,Xu WB.Recent advance in new types of human adenovirus[J].Bing Du Xue Bao,2013,29(3):342-348.
[14] Ehrke-Schulz E,Zhang W,Schiwon M,et al.Cloning and large-scale production of high-capacity adenoviral vectors based on the human adenovirus type 5[J].J Vis Exp,2016,107:e52894.
[15] Thaci B,Ulasov IV,Wainwright DA,et al.The challenge for gene therapy: innate immune response to adenoviruses[J].Oncotarget,2011,2(3):113-121.
[16] Qu W,Wang M,Wu Y,et al.Scalable downstream strategies for purification of recombinant adeno-associated virus vectors in light of the properties[J].Curr Pharm Biotechnol,2015,16(8):684-695
[17] Mingozzi F,High KA.Therapeutic in vivo gene transfer for genetic disease using AAV: progress and challenges[J].Nat Rev Genet,2011,12(5):341-355.
[18] Drouin LM,Agbandje-McKenna M.Adeno-associated virus structural biology as a tool in vector development[J].Future Virol,2013,8(12):1183-1199.
[19] Salganik M,Hirsch ML,Samulski RJ.Adeno-associated virus as a mammalian DNA vector[J].Microbiol Spectr,2015,3(4):1128-1136.
[20] Hastie E,Samulski RJ.Adeno-associated virus at 50: a golden anniversary of discovery,research,and gene therapy success—a personal perspective[J].Hum Gene Ther,2015,26(5):257-265.
[21] Yang M,Zhang GG,Wang T,et al.TBX18 gene induces adipose-derived stem cells to differentiate into pacemaker-like cells in the myocardial microenvironment[J].Int J Mol Med,2016,38(5):1403-1410.
[22] Talkhabi M,Razavi SM,Salari A.Global transcriptomic analysis of induced cardiomyocytes predicts novel regulators for direct cardiac reprogramming[J].J Cell Commun Signal,2017,11(2):193-204.
[23] Addis RC,Ifkovits JL,Pinto F,et al.Optimization of direct fibroblast reprogramming to cardiomyocytes using calcium activity as a functional measure of success[J].J Mol Cell Cardiol,2013,60 (1):97-106.
[24] Zhou YF,Yang XJ,Li HX,et al.Mesenchymal stem cells transfected with HCN2 genes by LentiV can be modified to be cardiac pacemaker cells[J].Med Hypotheses,2007,69(5):1093-1097.
[25] Feng Y,Yang P,Luo S,et al.Shox2 influences mesenchymal stem cell fate in a co-culture model in vitro[J].Mol Med Rep,2016,14(1):637-642.
[26] Boink GJ,Nearing BD,Shlapakova IN,et al.Ca(2+)-stimulated adenylyl cyclase AC1 generates efficient biological pacing as single gene therapy and in combination with HCN2[J].Circulation,2012,126(5):528-536.
[27] Cingolani E,Yee K,Shehata M,et al.Biological pacemaker created by percutaneous gene delivery via venous catheters in a porcine model of complete heart block[J].Heart Rhythm,2012,9(8):1310-1318
[28] Blazquez R,Sanchez-Margallo FM,Crisostomo V,et al.Intrapericardial delivery of cardiosphere-derived cells: an immunological study in a clinically relevant large animal model[J].PLoS One,2016,11(2):e149001.
[29] Lu W,Yaoming N,Boli R,et al.mHCN4 genetically modified canine mesenchymal stem cells provide biological pacemaking function in complete dogs with atrioventricular block[J].Pacing Clin Electrophysiol,2013,36(9):1138-1149.
[30] Schlimgen R,Howard J,Wooley D,et al.Risks associated with lentiviral vector exposures and prevention strategies[J].J Occup Environ Med,2016,58(12):1159-1166.
[31] Huang LY,Halder S,Agbandje-McKenna M.Parvovirus glycan interactions[J].Curr Opin Virol,2014,7:108-118.
[32] Yang L,Jiang J,Drouin LM,et al.A myocardium tropic adeno-associated virus (AAV) evolved by DNA shuffling and in vivo selection[J].Proc Natl Acad Sci USA,2009,106(10):3946-3951.
[33] Fang H,Lai NC,Gao MH,et al.Comparison of adeno-associated virus serotypes and delivery methods for cardiac gene transfer[J].Hum Gene Ther Methods,2012,23(4):234-241.
[34] Chan PK,Li RA.Gene delivery for the generation of bioartificial pacemaker[J].Methods Mol Biol,2017,1521:293.
[35] Bruzauskaite I,Bironaite D,Bagdonas E,et al.Relevance of HCN2-expressing human mesenchymal stem cells for the generation of biological pacemakers[J].Stem Cell Res Ther,2016,7(1):67.
[36] Saito Y,Nakamura K,Yoshida M,et al.Enhancement of spontaneous activity by HCN4 overexpression in mouse embryonic stem cell-derived cardiomyocytes - a possible biological pacemaker[J].PLoS One,2015,10(9):e138193.

