外加CO2对盐藻生长及碳酸酐酶活性的影响
穆富香,杨代宇,白飞妮,汪 莹,杨海波,于 媛,詹世平
(大连大学 环境与化学工程学院,辽宁 大连 116622)
温室效应是21世纪人类面临的最严峻的环境危机之一,人类燃烧化石燃料所产生的CO2是引起全球温室效应的最主要物质[1]。目前,全球每年排放CO2超过2.5×1010t,中国已达6×109t,居世界第一位[2],因此,研究CO2的转化和利用具有重要的现实意义。
盐藻(Dunaliellasalina)光合作用强、生长速度快、适应范围广,细胞内不仅含有包括人体必需8种氨基酸在内的18种氨基酸,同时含有丰富的蛋白质、多糖以及较多的Ca、P、Zn等矿物质。在适当条件下,累积油脂可达细胞干质量的40%~50%,合成的β-胡萝卜素可达细胞干质量的10%,因此,盐藻不仅用作鱼、虾、贝等幼体的饵料,而且在食品、医疗保健、液体燃料、环境保护等领域具有重要的应用价值[3-4]。
1 材料与方法
1.1 藻种来源
试验所用盐藻藻种为大连大学环境与化学工程学院海洋微藻课题组保存的藻种。
1.2 仪器和药品
EL204电子天平[梅特勒—托利多仪器(上海)有限公司],80-2离心沉淀机(上海荣泰生化工程有限公司),LD5-2A台式离心机(北京医用离心机厂),UV-5200型紫外可见分光光度计(上海元析仪器有限公司),HH-S恒温水浴锅(江苏金坛市医疗仪器厂),pHS-2C型精密酸度计(上海精密科学仪器有限公司),WY100Y手持式盐度计[麦科仪(北京)科技有限公司]等;无水乙醇(天津市科密欧化学试剂有限公司),巴比妥(上海笃玛生物科技有限公司),巴比妥钠(上海笃玛生物科技有限公司),均为分析纯。
1.3 试验方法
1.3.1 微藻培养及CO2通入
取5 L锥形瓶,分别加入2700 mL灭菌海水(加入氯化钠调节盐度为65,pH 8.10)和900 mL处在对数生长期的盐藻藻液(A650nm=0.106),按1‰的比例加入2.7 mL的康维方营养液[8]。在25 ℃、1800 lx、光暗比为12∶12的条件下培养盐藻。每天光照阶段开始和光照阶段结束时各摇瓶1次。
根据亨利定律,25 ℃时CO2在纯水中的溶解度为1.24×10-5mol/L,pH 5.67[9]。为研究海水中CO2溶解度最大时盐藻生长及碳酸酐酶活性变化趋势,以此为依据每天在光照阶段开始前向盐藻培养体系中通入CO2至pH恒定不变(测得此时pH 6.00,表明CO2饱和)。
试验开始时,每天在光照阶段开始前向盐藻培养液中通入CO2至pH 6.00,开始12 h光照,再继续12 h黑暗,直至培养结束。以未加CO2的灭菌海水中接种的盐藻培养液为对照。每组试验培养3个平行样。
1.3.2 测定指标
为探究盐藻对CO2的利用程度及其对盐藻生长和碳酸酐酶活性的影响,每天分别在光照阶段结束时取样测定培养液pH、吸光度、盐藻细胞叶绿素含量和碳酸酐酶活性;在黑暗阶段结束时取样测定pH和吸光度。
pH测定:每次取培养藻液30 mL,用pHS-2C型精密酸度计测定pH值。平行3次。
生物量测定:试验开始前,先用UV-5200型紫外可见分光光度计进行全波长扫描,确定盐藻培养液的最大吸收波长为650 nm。试验过程中,每次取培养藻液10 mL,于650 nm波长测定藻液的吸光值,以间接反映盐藻细胞的生长。平行测定3次。
叶绿素含量的测定:参照文献[10]的方法,每日取光照阶段结束时的盐藻培养液500 mL,3000 r/min离心3 min,弃上清液,收集藻泥,分成3份,1份用于测定叶绿素,另外2份用于测定细胞内、外的碳酸酐酶活性。将用于测定叶绿素的藻泥用去离子水清洗3次后按质量平均分成3份,用85%的乙醇提取叶绿素,并测定提取液在波长649 nm和665 nm处的吸光度值。按照公式(1)、(2)分别计算待测液中叶绿素a和叶绿素b的质量浓度,按照公式(3)计算盐藻细胞内的叶绿素含量。
Ca=13.95A665-6.88A649
(1)
Cb=24.96A649-7.32A665
(2)
式中,Ca、Cb分别为待测液中叶绿素a、叶绿素b的质量浓度(mg/L),A649、A665分别为649 nm、665 nm处的吸光度值。
叶绿素含量(湿质量)/mg·g-1=CV/m
(3)
式中,C为叶绿素质量浓度(mg/L),V为藻液体积(L),m为藻泥湿质量(g)。
细胞内外碳酸酐酶活性的测定:参照文献[11]测定碳酸酐酶活性。取上述操作中获得的另外2份藻泥,首先将其中的1份按质量平均分成3份,立即悬浮于pH为8.30的12 mL巴比妥—巴比妥钠缓冲溶液中,再加入6 mL在4 ℃冷藏的CO2饱和蒸馏水,用pH计测量反应体系中pH的变化,记录pH从8.30降至7.30时所用的时间,测定细胞外碳酸酐酶活性。将另外一份藻泥冻融3次破碎细胞后,再按质量平均分成3份,重复胞外碳酸酐酶测定过程,用于测定细胞总的碳酸酐酶活性。按照下式计算碳酸酐酶比活性。
碳酸酐酶比活性(湿质量)/EU·g-1=10×(t0/t1-1)/m
(4)
式中,t0为反应体系未加藻泥时pH下降所用的时间(min),t1是反应体系中加入藻泥后pH下降所用的时间(min),m为藻泥湿质量(g)。
细胞内碳酸酐酶比活性(湿质量)/EU·g-1=细胞总碳酸酐酶比活性-细胞外碳酸酐酶比活性
(5)
1.4 数据统计与方法
试验数据用Excel统计、处理,结果以平均值±标准差表示。在采用SPSS 18.0软件进行单因素方差分析的基础上进行Duncan多重比较,显著水平为P<0.05。
2 结果与分析
2.1 外加CO2对盐藻培养体系pH的影响
按照1.3.1,在灭菌海水中接种处于对数生长期的盐藻藻液(A650 nm=0.106),分别测定光照阶段结束和黑暗阶段结束时培养液的pH,并与未通入CO2的对照组比较,结果见表1。
由表1可见,未通入CO2的对照组盐藻培养液,在整个培养过程中,光照阶段结束时和黑暗阶段结束时的pH均在8.10~8.20,说明盐藻通过光合作用吸收的CO2和通过呼吸作用释放的CO2基本处于平衡状态。而每天光照阶段开始前通入CO2至pH 6.00的盐藻培养液,第1 d光照阶段结束时的pH为6.26,随着培养时间的延长,pH缓慢增大。培养3 d后,pH显著增加(P<0.05),至培养结束时pH约7.04。黑暗阶段结束时培养液的pH变化与光照阶段结束时的pH变化趋势基本一致,且同一天内黑暗阶段结束时的pH比光照阶段结束时的pH稍有增加。

表1 外加CO2对盐藻培养体系pH的影响(平均值±标准差)
注:各组数据之间,同一字母表示差异不显著(P>0.05),不同字母间表示差异显著(P<0.05).
光合作用包括光反应和暗反应两个过程。前者是在叶绿素类囊体膜上高效吸收和传递光能,并将其转化为生物能和还原势能;后者是利用光反应转化的生物能及还原势能固定CO2,并产生碳水化合物[12]。光反应必须在光照条件下进行,暗反应是否有光均可进行。
在前3 d培养时间内,生物量增加少,光反应较弱,转化的生物能和还原势能少,导致暗反应对CO2的利用少,故培养液的pH上升得少。随着培养时间的延长,盐藻生物量逐渐增多,光反应增强,为暗反应提供了更多的生物能和还原势能,使其对CO2的利用增强,进而pH增加明显。
由于光合作用的限速步骤是暗反应过程的固碳反应,光反应过程通过快速反应获得生物能和还原势能,而暗反应过程通过相对的慢速反应固定CO2并释放生物能。因此,在黑暗过程中CO2被继续吸收和转化,使培养液的pH继续有所升高。
2.2 外加CO2对盐藻生长的影响
碳是构成微藻细胞组分的重要元素,试验中培养盐藻所用的康维方营养液中不含有碳元素,盐藻通过光合作用的暗反应过程利用外环境提供的CO2转化为碳水化合物,促进生长繁殖。外加CO2至pH 6.00达到饱和时盐藻培养液的吸光度值随培养时间的变化趋势见图1。
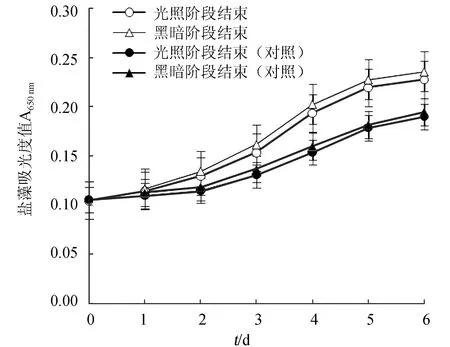
图1 外加CO2对盐藻生长的影响
由图1可见,在通入CO2培养的第1 d内,盐藻细胞处于适应阶段,吸光度基本没有增加;2~5 d,培养液的吸光度基本上均呈直线上升,表明盐藻细胞处于指数生长期。未通入CO2时,在培养的前2 d,盐藻细胞处于适应阶段,吸光度基本没有增加,3~5 d,培养液的吸光度基本上均呈直线上升,盐藻细胞处于指数生长期。培养至第6 d时,两种体系的盐藻培养液均进入稳定期,但通入CO2的吸光度值显著高于未通入CO2的吸光度值。
培养1 d后,后一天光照阶段结束时的吸光度值显著高于前一天光照阶段结束时的吸光度值,而同一天黑暗阶段(比光照阶段推迟12 h)结束时的吸光度值仅比光照阶段结束时的吸光度值略有增加,表明盐藻主要在光照阶段通过光合作用的暗反应将CO2固定并转化为细胞组分,促进细胞分裂和繁殖,增加生物量。这一变化过程与表1中光照阶段结束和黑暗阶段结束时的pH变化趋势相一致。
2.3 外加CO2对盐藻叶绿素含量的影响
叶绿素是光合作用的主要色素,在光合作用的光吸收中起核心作用,其含量高低一方面反映微藻光合作用能力的强弱,另一方面可以用来估算浮游植物的生物量[13]。盐藻中主要含有叶绿素a和叶绿素b[10],试验中测定其含量随培养时间的变化,结果见图2。
由图2可见,随培养时间延长,通入CO2和未通入CO2的培养体系中盐藻细胞的叶绿素含量均逐渐增加,但通入CO2的盐藻细胞中的叶绿素a和叶绿素b含量分别显著高于未通入CO2的对照组的叶绿素a、b的含量。这与图1中吸光度增加的趋势一致。表明CO2的通入,能够促进盐藻细胞产生更多的叶绿素进行光合作用吸收转化CO2,加快细胞生长。通入CO2体系和对照体系在同一培养时间时叶绿素a含量显著大于叶绿素b含量。叶绿素a主要吸收红光,而叶绿素b主要吸收蓝紫光,说明盐藻细胞更倾向于吸收红光。

图2 外加CO2对盐藻叶绿素含量的影响
2.4 外加 CO2对盐藻碳酸酐酶活性的影响
自然海域的海水中CO2浓度约为10 μmol/L[14],为了适应水中低CO2环境并保持较高的光合作用,藻类自身形成了提高CO2浓度的特有途径,即藻类的CO2浓缩机制。碳酸酐酶是CO2浓缩机制的重要组成部分之一,在藻类光合作用中起着重要作用[15]。除对照组的胞内碳酸酐酶比活性在培养前3 d基本不变、之后显著增加外,通入CO2体系的胞内、外碳酸酐酶比活性和对照组的胞外碳酸酐酶比活性均随培养时间延长而逐渐增多;同一培养时间两体系的胞外碳酸酐酶比活性分别高于各自的胞内碳酸酐酶比活性。此外,通入CO2的盐藻培养液中,细胞内、外的碳酸酐酶比活性均显著高于未通入CO2的对照组中相应的碳酸酐酶比活性(图3)。
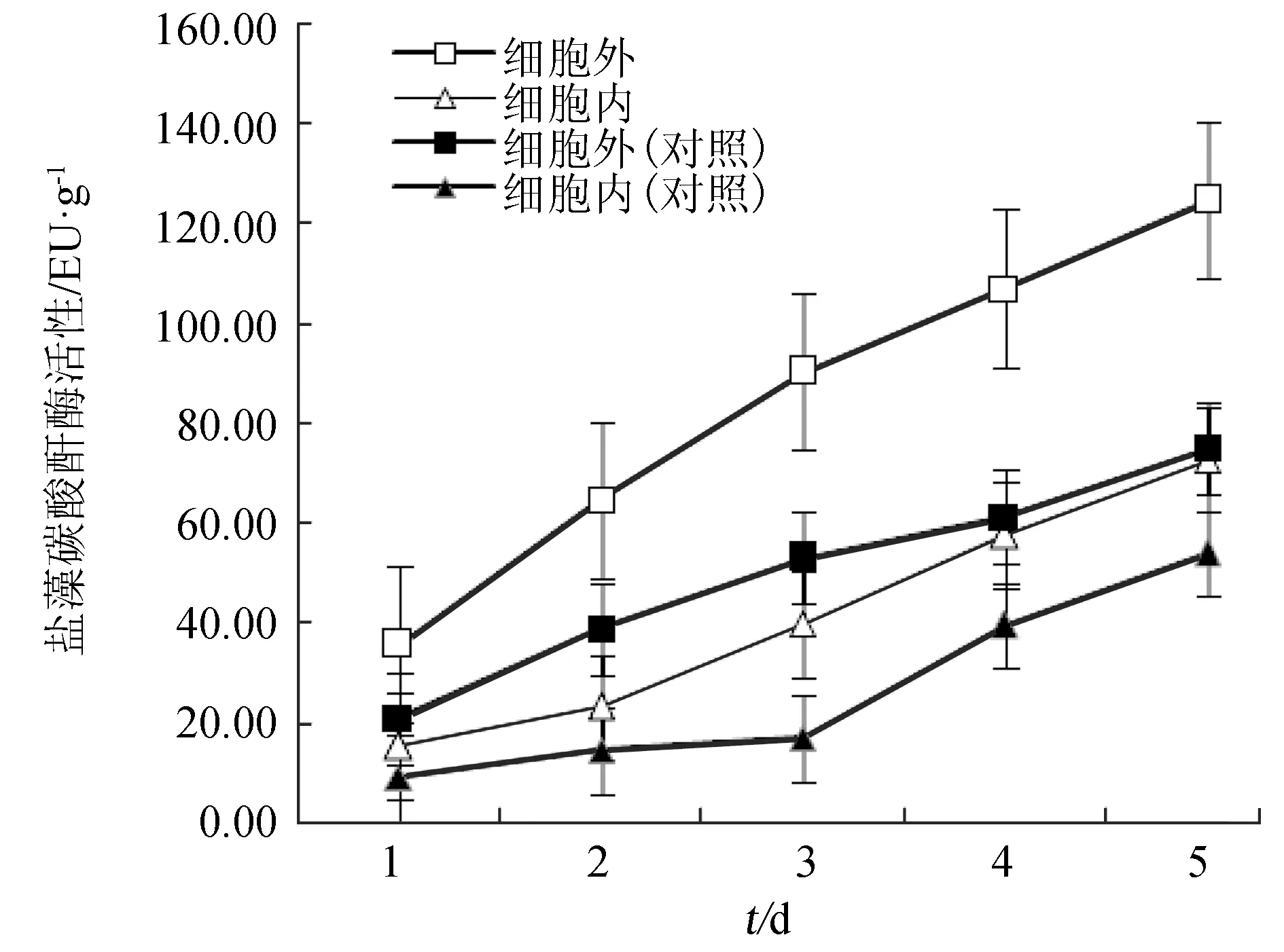
图3 外加CO2对盐藻碳酸酐酶的影响
由表1可知,未通入CO2的对照组盐藻培养液的pH一直为8.10~8.20,而通入CO2的盐藻培养液,在每天光照阶段开始前通入CO2至溶液pH为6.00,光照阶段结束时的pH随着培养时间的延长,从第1 d的6.26逐渐上升至培养结束时的7.04。参考碳酸和HCO3-在水溶液中的分布系数计算公式(6)~(7)[16],计算盐藻培养液pH在6.00、6.26、7.04、8.20时碳酸、HCO3-的分布系数,结果见表2。
(6)
(7)
式中,Ka1=4.5×10-7,Ka2=4.7×10-11。

表2 不同pH时碳酸和的分布系数
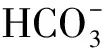



3 讨 论
CO2是微藻光合自养的唯一碳源,但不同微藻所需的最适CO2含量不同,改变其含量会影响微藻生长和细胞组分的变化[17]。De Morais等[18]发现,凯氏小球藻(Chlorellakessleri)、斜生栅藻(Scenedesmusobliquus)、螺旋藻属(Spirulina)和普通小球藻(C.vulgaris)4种微藻均在CO2含量为6%时生长最好;Tang等[19]的研究表明,斜生栅藻在10%的CO2含量下生长最好。范金凤等[20]研究结果显示,二形栅藻(S.dimorphus)可在10%~20%的CO2含量下生长,且CO2含量为10%时二形栅藻生长最好,此时pH为6.0~7.0。本试验中外加CO2至饱和时,盐藻培养液的pH由最初的6.0升至培养结束7.0,与范金凤等[20]通入10% CO2的培养液的pH范围一致,所得结果也一致,表明盐藻能够利用的CO2含量约为10%。


火电厂烟道气中的CO2一般为10%~20%[28],因此在盐藻培养液中通入CO2至饱和,不仅可转化吸收烟道气中的CO2,为降低大气中CO2的含量探究有效的利用途径,而且能提高盐藻生长速率,进而产生更多的生物量用在水产饵料、医疗保健、食品添加剂、精细化工品和液体燃料等领域。因此,利用盐藻转化吸收CO2无论从环境保护还是资源利用角度均有重要应用价值。
[1] 杨改.微藻固定实际烟道气中CO2的研究[D].武汉:武汉科技大学,2011:1-4.
[2] Joe J G O,Greet J M,Jeroen A H W P.Trends in global CO2emissions[R].The Hague/Bilthoven: PBL Netherlands Environment Assessment Agency,2012.
[3] 杨晓玲,郭金耀,王志龙.VB6对盐藻色素形成、细胞生长和蛋白积累的影响[J].水产科学,2013,32(3):171-174.
[4] Kao C Y,Chiu S Y,Huang T T,et al.A mutant strain of microalgaChlorellasp.for the carbon dioxide capture from biogas[J].Biomass and Bioenergy,2012,36(328):132-140.
[5] Tsuzuki M,Miyachi S.The function of carbonic anhydrase in aquatic photosynthesis[J].Aquatic Botany,1989,34(1):85-104.
[6] 曾晓鹏,夏建荣.光强对两种硅藻光合作用、碳酸酐酶和RubisCO活性的影响[J].水生生物学报,2015,39(2):368-374.
[7] Colman B,Huertas I E,Bhatti S,et al.The diversity of inorganic carbon acquisition mechanisms in eukaryotic microalgae[J].Functional Plant Biology,2002,29(2/3):261-270.
[8] 王友利.氮磷交互作用对两种海洋微藻生长及细胞组分的影响[D].大连:大连大学,2015:13-14.
[9] 戴树桂.环境化学[M].北京:高等教育出版社,2002:102-105.
[10] 杨代宇,穆富香,白飞妮,等.盐藻中叶绿素的提取方法比较及条件优化[J].安徽农业科学,2016,44(25):7-9,20.
[11] Wilbur K M,Anderson N G.Electronic and colorimetric determination of carbonic anhydrase [J].Journal of Biological Chemistry,1948,176(1):147-154.
[12] 杨春虹.关于光合机器的合成生物学研究的几点思考[J].生物产业技术,2012(4):20-22.
[13] 徐冉,侯和胜,佟少明.藻类叶绿素a/叶绿素b型捕光蛋白复合体结构与功能的研究进展[J].天津农业科学,2016,22(2):31-34.
[14] Badger M R,Price G D.The role of carbonic anhydrase in photosynthesis[J].Annual Review of Plant Biology,2003,45(1):369-392.
[15] Axelsson L,Ryberg H,Beer S.Two modes of bicarbonate utilization in the marine green macroalgaUlvalacturca[J].Plant Cell and Environment,1995,18(4): 439-445.
[16] 李发美.分析化学[M].7版.北京:人民卫生出版社,2014:39-42.
[17] Kumar A,Ergas S,Yuan X,et al.Enhanced CO2fixation and biofuel production via microalgae:recent developments and future directions[J].Trends Biotechnology,2010,28(7):371-380.
[18] De Morais M G,Costa J A.Carbon dioxide fixation byChlorellakessleri,C.vulgaris,ScenedesmusobliquusandSpirulinasp.cultivated in flasks and vertical tubular photobioreactors[J].Biotechnology Letters,2007,29(9):1349-1352.
[19] Tang D H,Han W,Li P L,et al.CO2biofixation and fatty acid composition ofScenedesmusobliquusandChlorellapyrenoidosain response to different CO2levels[J].Bioresource Technology,2011,102(3):3071-3076.
[20] 范金凤,张姗姗,于红,等.CO2对产油微藻Scenedesmusdimorphus生长和产油特性的影响[J].太阳能学报,2013,34(6):1103-1108.
[21] Chiu S Y,Kao C Y,Tsai M T ,et al.Lipid accumulation and CO2utilization ofNannochloropsisoculatain response to CO2aeration[J].Bioresource Technology,2009,100(2):833-838.
[22] 孙新健,罗生军,范晓蕾,等.产油藻株Scenedesmussp.胞外碳酸酐酶活性及光合作用活性的研究[J].可再生能源,2012,30(11):99-103.
[23] 陈雄文,高冲山.CO2浓度对中肋骨条藻的光合无机碳吸收和胞外碳酸酐酶活性的影响[J].科学通报,2003,8(21):2275-2279.
[24] 刘洪霞.环境因子对球等鞭金藻胞外碳酸酐酶活性的影响[D].烟台:烟台大学,2007:40.
[25] 夏建荣,黄瑾.氮、磷对小新月菱形藻无机碳利用与碳酸酐酶活性的影响[J].生态学报,2010,30(15):4085-4092.
[26] Martin C L,Tortell P D.Bicarbonate transport and extracellular carbonic anhydrase in marine diatoms[J].Physiologia Plantarum,2008,133(1):106-116.
[27] Nimer N A,Warren M,Merrett M J.The regulation of photosynthetic rate and activation of extracellular carbonic anhydrase under CO2-limiting conditions in the marine diatomSkeletonemacostatum[J].Plant Cell and Environment,1998,21(8):805-812.
[28] 刘玉环,阮榕生,孔庆学,等.利用市政废水和火电厂烟道气大规模培养高油微藻[J].生物加工过程,2008,6(3):29-33.

