胶原诱导性关节炎大鼠18F-NaF micro-PET/CT和μCT评分与组织病理学的相关性分析
黄 禾,卢 苇,刘 勤,曾一飞,邹同恩,陈 跃
(1.泸州市人民医院核医学科,四川 泸州 646000;2.西南医科大学附属医院核医学科,四川 泸州 646000)
类风湿性关节炎(rheumatoid arthritis, RA)是一种以炎性细胞浸润、滑膜增生、软骨侵蚀及骨丢失为特征的慢性炎症性疾病,患病率约0.32%~0.36%,2年致残率约50%[1]。RA不仅可引起局部骨质破坏,还可导致全身骨质丢失,是骨质疏松性骨折的独立危险因素。RA患者骨质疏松发生率较高,为健康对照人群的2倍[2]。RA初期可因关节肿胀、游走性疼痛而影响患者生活及工作,治疗效果不佳者病情逐渐进展,可因关节畸形、僵硬而丧失功能[3]。18F-NaF经静脉注射后立即分解为Na+和18F-,18F-大部分在血液中直接被红细胞转运,仅较少与血浆白蛋白结合,18F-与骨组织无机盐中二磷酸盐的羟基发生离子交换,羟基磷灰石晶体由Ca10(PO4)6(OH)2转化为Ca10(PO4)6F2。因而18F-NaF PET/CT可用于诊断引起骨质改变的自身免疫性疾病,如RA[4]及其他良性骨质病变[5]。本研究探讨18F-NaF micro-PET/CT的最小标准化摄取值(minimum standardized uptake value, SUVmin)、最大标准化摄取值(maximum standardized uptake value, SUVmax)及平均标准化摄取值(mean standardized uptake value, SUVmean)与胶原诱导性关节炎(collagen induced arthritis, CIA)大鼠模型组织病理学的相关性,并与μCT评分与组织病理学的相关性进行比较。
1 材料与方法
1.1 实验动物与分组健康清洁级雌性SD大鼠70只,8周龄,体质量160~200 g,随机分为模型组(n=50)、对照组(n=20)。模型组:将牛Ⅱ型胶原30 mg溶于15 ml 0.1 mol/L醋酸中,使胶原浓度为2 mg/ml,4℃过夜后取20 ml胶原溶液与15 ml完全弗氏佐剂制备成胶原乳剂;在距大鼠尾根部2~3 cm处皮下注射胶原乳剂,0.1 ml/只,初次注射7天后再次皮下注射等量胶原乳剂。对照组:采用已氟烷气体麻醉(2%浓度,氧流量0.6 L/min),麻醉成功后分别称重,与模型组相同时间点皮下注射等体积的生理盐水。2组均于造模后10天行micro-PET/CT检查。实验过程均按动物研究伦理学要求进行。
1.2 仪器与方法采用Siemens InveonTMmicro-PET/CT机;18F-NaF注射液由Siemens Eclipse HP/RD加速器生产;采用LABORLUX 11光学显微镜(Leica公司)。对2组均采用异氟烷气体维持麻醉,行俯卧位足先进扫描。经尾静脉注射18F-NaF,剂量0.1 mCi/kg体质量。PET模块视野中心的横向、纵向和轴向分辨力为1.5 mm,采集时间窗3.4 ns、能窗350~650 keV,采集时间10 min,在注射显像剂后50 min开始采集,重建方法为FBP。PET/CT检查后,处死实验鼠,对左、右踝关节行μCT扫描,电压80 kV,电流500 μA,曝光时间1 000 ms,像素3 072×2 048。
1.3 图像分析采用Siemens Inveon Acquisition Workplace图像采集软件和ASI Pro VM图像分析软件。PET值区间均为1.8~9.9,CT窗宽-500~1 900 HU。由2名住院医师及1名主治医师观察踝关节放射性同位素的摄取情况(图1)并勾画ROI(体积2 mm3),计算SUVmin、SUVmax及SUVmean。
μCT评分采用Pfeil等[6]评分标准:0分为正常;1分为轻度异常,1处或多处关节周围软组织肿胀,骨质疏松和轻微关节间隙狭窄;2分为明确的早期异常,包括明显骨质侵蚀改变有或无关节间隙狭窄;3分为中度关节破坏,关节间隙狭窄≤正常50%;4分为重度关节破坏,关节间隙狭窄>正常50%,但未消失;5分为多个异常,关节间隙消失。由2名放射科主治医师及1名主任医师观察图像,软组织窗宽-1 000~4.8 HU,骨窗窗宽2 000~12 000 HU(图2、3),进行踝关节μCT评分,并取均值。
1.4 病理学分析μCT扫描后,分离左、右踝关节表皮,固定、脱钙、冲洗、脱水、透明、浸蜡、包埋、切片、HE染色。对每个踝关节获取3张组织切片,每张切片由3名病理学医师评分(表1),取平均值。根据踝关节组织病理形态学,评价踝关节细胞渗出、软骨破坏及骨侵蚀程度[7]。

表1 CIA大鼠踝关节炎细胞渗出、软骨破坏及骨侵蚀程度评分标准
1.5 统计学分析采用SPSS 22.0统计分析软件,计量资料以±s表示,2组实验鼠体质量、SUVmin、SUVmax及SUVmean、μCT评分均符合正态分布,采用两独立样本t检验比较。采用Pearson相关性分析评价模型组μCT评分和各SUV值与组织病理学评分的相关性,P<0.05为差异有统计学意义。
2 结果
造模前2组大鼠体质量增长速度正常,差异无统计学意义(t=0.90,P=0.37),造模成功后部分出现不同程度摄食及活动减少、体质量减轻、毛发枯燥、反应迟钝,2组大鼠体质量差异有统计学意义(t=12.44,P<0.01)。
2.118F-NaF PET/CT各指标、μCT评分及病理评分比较模型组SUVmin、SUVmean、SUVmax、μCT评分及病理评分均高于对照组(P均<0.01),见表2。
2.2 病理学表现对照组踝关节面完整,无水肿及充血,滑膜无增生,踝关节表面被覆薄层透明软骨,排列整齐、表面光滑,关节囊由结缔组织组成,表面有完整的滑膜细胞,骨组织无破坏,结构完整(图4A、4B);模型组病理示46只大鼠出现关节炎改变,发病率为92.00%(46/50);发病踝关节区滑膜细胞有轻、中至重度增生、变性或坏死;滑膜组织内有轻、中至重度的纤维组织增生和炎细胞渗出,踝关节软骨面塌陷、髓腔消失,代以大量的纤维结缔组织及肉芽组织,骨和软骨受到不同程度破坏(图4C、4D)。
表2 2组大鼠SUVmin、SUVmean、SUVmax和μCT评分比较(±s)
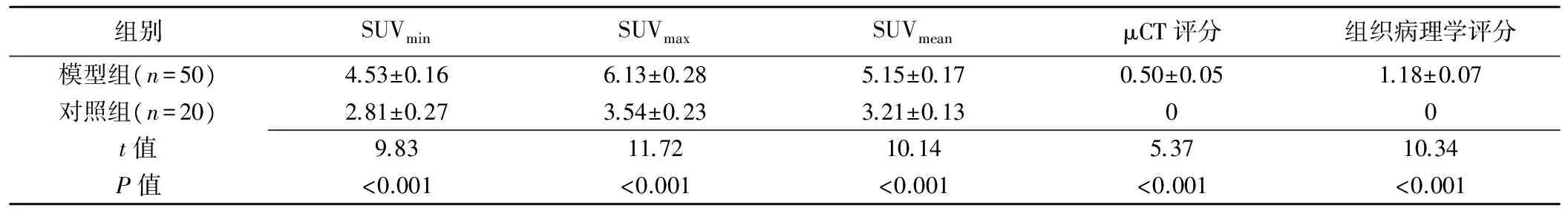
表2 2组大鼠SUVmin、SUVmean、SUVmax和μCT评分比较(±s)
组别SUVminSUVmaxSUVmeanμCT评分组织病理学评分模型组(n=50)4.53±0.166.13±0.285.15±0.170.50±0.051.18±0.07对照组(n=20)2.81±0.273.54±0.233.21±0.1300t值9.8311.7210.145.3710.34P值<0.001<0.001<0.001<0.001<0.001

图1 注射18F-NaF 50 min后行大鼠micro-PET/CT显像 A.对照组正常图像; B.模型组踝关节骨代谢增高; C.模型组踝关节及跗骨骨代谢增高; D、E.模型组踝关节、跗骨及跖趾关节骨代谢不同程度增高
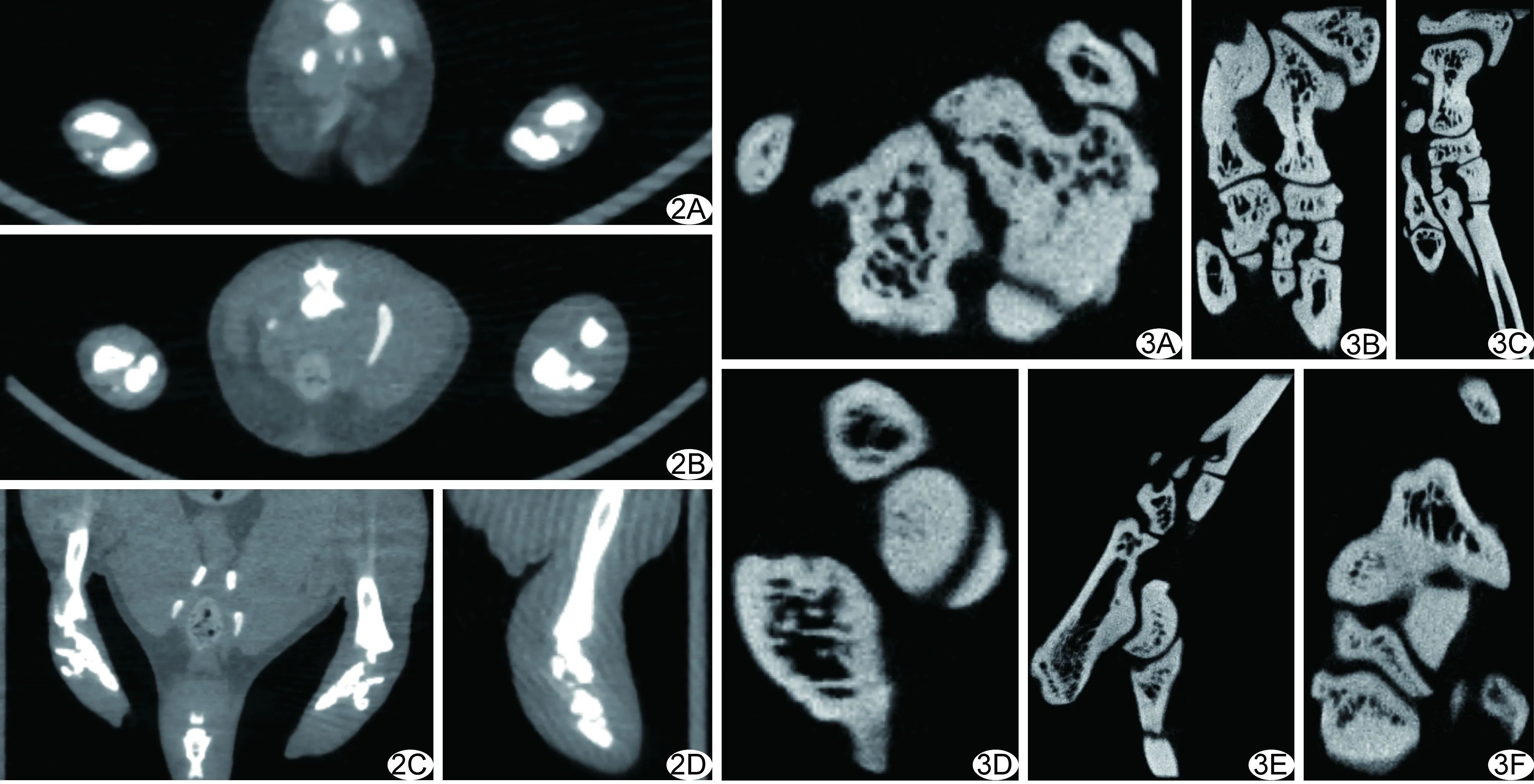
图2 大鼠μCT图像,软组织窗 A.对照组正常图像; B~D.模型组轴位、冠状位及矢状位图像,表现为左后肢明显软组织肿胀 图3 大鼠 μCT 骨窗 A~C.分别为对照组轴位、冠状位及矢状位的正常图像; D~F.分别为模型组轴位、冠状位及矢状位图像,表现为骨密度稍降低,骨关节面毛糙
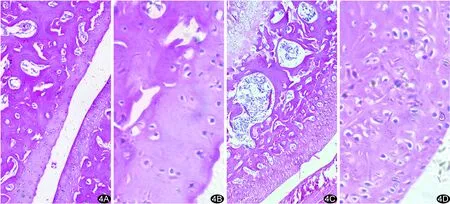
图4 病理图 A、B.对照组(A.HE,×100;B.HE,×400); C、D.模型组(C.HE,×100;D.HE,×400)
图5 SUVmin(A)、SUVmean(B)、SUVmax(C)值及μCT评分(D)与组织病理学评分相关性分析散点图
2.3 相关性分析18F-NaF PET/CT的SUVmin、SUVmax、SUVmean、μCT评分与组织病理学评分均呈正相关(r=0.920、0.943、0.923、0.768,P均<0.001),见图5。
3 讨论
已有大量研究[8-10]采用18F-NaF作为放射性示踪剂检测原发性骨肿瘤及成骨性、溶骨性或混合性骨骼转移,将18F-NaF用于骨良性疾病如隐匿性骨折、骶髂关节炎、青少年退变等的报道[11]也日渐增多。因PET/CT高空间分辨率、高灵敏度及三维层析图像重建技术,被广泛应用于临床。本研究采用18F-NaF PET/CT评估胶原诱导的关节炎大鼠关节的病理骨代谢征象。
放射性同位素显像是评估局部骨代谢和全身半定量、定量分析最适用的成像模式之一。与用于骨成像的其他放射性药物(如99Tcm)相比,18F-NaF对骨具有高亲和力并有良好的骨动力学效应,在静脉注射60 min后,仅10%的剂量留于血液循环,因此,18F-NaF被快速骨吸收和快速血浆清除的同时可产生较高的骨与背景比值,且18F-NaF不在炎性软组织中累积,仅最低限度地与血清蛋白结合[12];此外,18F-NaF PET/CT在测量骨疾病的动物模型中具有极好的重现性。研究[13-14]表明99Tcm-MDP或其他99Tcm-二磷酸盐骨显像剂对骨的亲和力明显不及18F-NaF,且骨外摄取时有发生。
RA骨和软骨的侵蚀、修复过程与血流量密切相关,在不同阶段炎症部位骨面积和矿物质结合能力也相应变化。因此,通过血流量增加并提高矿物质结合能力可导致关节炎关节中的18F-NaF被特异性吸收增加,使18F-NaF micro-PET/CT能可视化评估疾病严重程度,且能非侵入性量化病理性骨代谢。18F-NaF PET/CT的SUV值与骨代谢的标记物具有良好的相关性,通过测量18F-NaF在骨骼矿物质中的净吸收(Ki),结果显示Ki和SUV有显著的相关性[15]。
Ingo等[16]研究表明,在造模成功后14天大鼠出现急性期改变,28天后逐步转入慢性期,本实验选取造模成功后10天大鼠,病理示46只大鼠出现早期关节炎病理改变,μCT扫描曝光时间1 000 ms,像素为3 072×2 048,远高于常规CT,可清晰显示骨小梁结构,RA轻微骨质破坏即可显示。本研究发现18F-NaF Micro-PET/CT显像与RA组织病理学改变有较高的相关性,且呈正相关,SUVmin、SUVmax及SUVmean均随着组织病理学评分的增高而增高,且相关系数高于μCT,表明18F-NaF Micro-PET/CT可用于定量分析CIA大鼠骨破坏,且优于μCT评分。
综上所述,18F-NaF Micro-PET/CT能可靠定量评价CIA大鼠模型骨侵蚀和骨畸形,优于μCT评分。
[参考文献]
[1]Wu H, Wang K, Wang H, et al. Novel self-assembled tacrolimus nanoparticles cross-linking thermosensitivehydrogels for local rheumatoid arthritis therapy. Colloids Surf B Biointerfaces, 2017,14(9):97-104.
[2]张江林.类风湿关节炎的骨质疏松研究进展.中华风湿病学杂志,2005,9(8):503-505.
[3]Ikeda K, Sanayama Y, Nakagomi D, et al. Evaluation of joint damage with conventional radiograph and synovitis with musculoskeletal ultrasonography in rheumatoid arthritis. Nihon Rinsho, 2013,71(7):1185-1192.
[4]Kim Y, Lee HY, Yoon HJ, et al. Utility of18F-fluorodeoxy glucose and18F-sodium fluoride positron emission tomography/computed tomography in the diagnosis of medication-related osteonecrosis of the jaw: A preclinical study in a rat model. J Craniomaxillofac Surg, 2016,44(4):357-363.
[5]Raynor W, Houshmand S, Gholami S, et al. Evolving role of molecular imaging with (18)F-sodium fluoride PET as a biomarker for calcium metabolism. Curr Osteoporos Rep, 2016,14(4):115-125.
[6]Pfeil A, Haugeberg G, Renz DM, et al. Digital X-ray radiogrammetry and its sensitivity and specificity for the identification of rheumatoid arthritis-related cortical hand bone loss. J Bone Miner Metab, 2016,77(18):1207-1216.
[7]Hildebrandt G, Jahns J, Hindemith M, et al. Effects of low dose radiation therapy on adjuvant induced arthritis in rats. Int J Radiat Biol, 2000,76(8):1143-1153.
[8]Frost ML, Blake GM, Park-Holohan SJ, et al. Long-term precision of18F-fluoride PET skeletal kinetic studies in the assessment of bone metabolism. J Nucl Med, 2008,49(5):700-707.
[9]Hsu WK, Virk MS, Feeley BT, et al. Characterization of osteolytic, osteoblastic, and mixed lesions in a prostate cancer mouse model using18F-FDG and18F-fluoride PET/CT. J Nucl Med, 2008,49(3):414-421.
[10]Grant FD, Fahey FH, Packard AB, et al. Skeletal PET with18F-fluoride: Applying new technology to an old tracer. J Nucl Med, 2008,49(1):68-78.
[11]黄禾,陈跃.18F-NaF PET/CT在骨良性病变中的临床应用于研究进展.中国医学影像技术,2016,32(3):457-460.
[12]Even-Sapir E, Metser U, Mishani E, et al. The detection of bone metastases in patients with high-risk prostate cancer:99mTc-MDP Planar bone scintigraphy, single-and multi-field-of-view SPECT,18F-fluoride PET, and18F-fluoride PET/CT. J Nucl Med, 2006,47(2):287-297.
[13]Assaf AT, Zrnc TA, Remus CC, et al. Intraindividual comparison of preoperative (99m)Tc-MDP SPECT/CT and intraoperative and histopathological findings in patients with bisphosphonate-or denosumab-related osteonecrosis of the jaw. J Craniomaxillofac Surg, 2015,43(8):1461-1469.
[14]Huang H, Chen Y. Recurrent alveolar soft part sarcoma on bone scintigraphy. Clin Nucl Med, 2016,41(3):251-252.
[15]Ng SF, Tan LS, Buang F. Transdermal anti-inflammatory activity of bilayer film containing olive compound hydroxytyrosol: Physical assessment, in vivo dermal safety and efficacy study in Freund's adjuvant-induced arthritic rat model. Drug Dev Ind Pharm, 2017,43(1):108-119.
[16]Ingo M, Peter G, Bianca H, et al.18F-Fluoride positron emission tomography/computed tomography for noninvasive in vivo quantification of pathophysiological bone metabolism in experimental murine arthritis. Arthr Res Ther, 2014,16(4):2-9.

