姜黄素在大鼠创伤性脑损伤模型中的抗氧化应激作用
梁 岚,韦会平,孙 妍,田金凤
(攀枝花学院医学院基础整合医学教研室,四川 攀枝花 617000)
姜黄素是一种从姜科姜黄属植物—姜黄的根茎提取物中分离得到的天然色素,纯品姜黄素为黄色结晶状的粉末,其分子量大小为368.38,用分子式C21H20O6来表示。姜黄素属于多酚类化合物,其脂溶性好,易通过血脑屏障,性质稳定[1-2]。在我国姜黄素的临床药用历史悠久,临床上常用于治疗鼻炎、鼻窦炎、呼吸道疾病等[2]。近年来对姜黄的活性成分研究显示:姜黄素具有抗氧化、抗肿瘤、抗炎等作用,姜黄素可显著抑制大脑因缺血或再灌注引起的黄嘌呤氧化酶、过氧化阴离子、过氧化歧化酶、乳酸脱氢酶等的生成,且该过程与核因子E2转录相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)-抗氧化反应元件(antioxidant response element,ARE)通路的激活密切相关,姜黄素的抗氧化应激作用可降低脑组织所受的损伤及二次损伤起到保护脑组织的作用[3-6],但是姜黄素在创伤性脑损伤中是否也有抗氧应激的作用,目前尚不明确。创伤性脑损伤又称脑外伤或脑损伤(traumatic brain injury,TBI),是指由于机械性冲击(穿透力、钝击力、加速力、减速力等)所致的颅脑外伤,包括原发性脑损伤和继发性脑损伤。继发性脑损伤常引起体内的氧化应激、炎症反应和细胞凋亡等,促使继发性生化降解发生,进一步加重脑损伤程度[7]。脑外伤常引起患者的严重瘫痪或智力损伤,其致伤率、致残率和致死率都很高[8]。鉴于姜黄素在缺血或再灌注脑损伤中的保护作用,本研究拟通过构建大鼠脑创伤模型,研究姜黄素对脑损伤组织中Nrf2以及抗氧化应激相关因子的表达、含量或活性的影响,以期望阐明姜黄素发挥脑损伤保护作用的分子机制,为姜黄素用于创伤性脑损伤的临床治疗提供更多的理论支持。
1 材料和方法
1.1 实验动物
SPF级SD雄性大鼠20只,体重260~280 g,4~8周龄,由成都达硕实验动物有限公司提供[SCXK(川)2013-024],实验在攀枝花学院医学院实验室完成[SYXK(川)2011-178]。本动物实验的研究方案已获得攀枝花学院医学院伦理委员会的批准,批准文号:201504523,且所有实验过程均符合动物伦理学和动物福利。
1.2 主要试剂及仪器
姜黄素液(美国,Sigma公司)按2 g/mL溶于二甲基亚砜(DMSO)后保存于4℃冰箱,使用时应用生理盐水稀释2000倍成1 mg/mL[9];Trizol试剂(美国,Invitrogen公司);TaqMan逆转录试剂盒(美国,Life Technologies公司);定量反转录聚合酶连锁反应(quantitative real-time polymerase chain reaction,QRT-PCR)试剂盒(美国,GeneCopoeia公司);免疫组化检测试剂盒、DAB显色试剂盒(武汉,博士德公司);水合氯醛(天津,永大化学制剂公司);兔抗鼠Nrf2多克隆抗体、兔抗鼠β-catin抗体(美国,CST公司);超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒、过氧化氢酶(catalase,CAT)活性检测试剂盒、丙二醛(malondialdehyde,MDA)含量测定试剂盒、还原型谷胱甘肽(glutathione,GSH)含量检测试剂盒(南京,建成生物工程研究所);血红素氧合酶-1(heme oxygenase-1,HO-1)ELISA检测试剂盒、诱导型一氧化氮合酶(inductive nitric oxide synthase,iNOS)酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)检测试剂盒(上海,上海沪震生物科技)。
紫外可见分光光度计(美国,Thermo公司,Nanodrop 2000);FS-1型电动匀浆器(江苏,新瑞仪器);自由落体式脑外伤造模装置(上海,医用仪器厂);分析天平(上海,光学仪器厂);Bio Rad IQ5实时荧光定量PCR仪(美国,Bio Rad);Epoch超微量微孔板分光光度计(美国,BioTek);高级研究型显微镜NIKON Eclipse 80i(日本,尼康)。
1.3 实验方法
1.3.1 动物分组
将SPF级SD雄性大鼠20只随机分成四组,分别为正常对照组,脑损伤模型组(TBI),脑损伤溶剂组(TBI+S),脑损伤姜黄素处理组(TBI+C),每组各5只。
1.3.2 大鼠创伤性脑损伤模型的建立
在大鼠脑外伤动物模型制作前,将大鼠放入乙醚麻醉罐中麻醉,将大鼠俯卧捆绑并固定。其中大鼠头部置于海绵垫上,在大鼠苏醒有肢体活动时,使用500 g砝码从造模装置的55 cm立柱标尺处自由坠落(砝码方向竖直、对准大鼠头部正中)[10]。大鼠脑外伤模型造模成功的标准为大鼠四肢活动不协调,行动迟缓,部分大鼠出现鼻/口腔出血,经观察和鉴定,该实验中所用的脑损伤大鼠均造模成功,继续进行后续实验。
正常对照组仅给予麻醉和生理盐水处理。TBI组、TBI+S组和TBI+C组均采用自由落体式脑外伤造模装置进行造模,造模成功后,TBI+C组腹腔注射姜黄素5 mg/kg(2 g/mL的母液用生理盐水稀释成1 mg/mL),TBI+S组腹腔注射DMSO溶剂(DMSO原液用生理盐水稀释2000倍,即0.05%),TBI组给予等量的生理盐水处理。1 d后处死所有大鼠并取脑组织,迅速于-80℃冻存,以用于后续的RNA和蛋白提取。另外取大鼠大脑皮层脑组织标本保存于4%多聚甲醛中,4℃冰箱保存以用于后续免疫组化检测。
1.3.3 RNA提取和纯度/浓度检测
操作中使用的所有器皿、试剂和材料均经160℃高温消毒。取液氮中保存的组织样品,于分析天平上各称取100 mg,置于2 mL的EP管中,每份样本中分别加入700 μL的TRIzol试剂,研磨充分后室温放置5 min,加入140 μL的氯仿,剧烈震荡15 s,室温放置5 min 后12 000 r/min,4℃离心15 min。将上层液体吸出并转移至新的EP管中,加入Trizol试剂2倍体积的异丙醇,混匀后静置10 min,离心去上清。1 mL 75%乙醇洗涤沉淀,转速7500 r/min,4℃离心5 min,弃上清,室温干燥,加入30 μL无酶双蒸水溶解,取1 μL测RNA浓度和纯度,剩余RNA立即放入-20℃保存备用。
将分装出的1 μL总RNA用于浓度测定,紫外可见分光光度计用于检测A260/A280值,其中取1 μL无酶水用作空白校对,当A260/A280<3时,可进行RNA浓度检测。样本RNA浓度检测前可简单离心,分别记录所测的RNA浓度值和A260/280值。当A260/A280=1.8~2.0时,RNA浓度适中,可用于后续qRT-PCR实验。
1.3.4 qRT-PCR检测
以1.3.3中提取的组织RNA为模板,按TaqMan的逆转录试剂盒说明书进行操作,逆转录生成cDNA,以cDNA为模板,按GeneCopoeia公司的qRT-PCR试剂盒说明书进行操作,检测设备为Bio Rad IQ5实时荧光定量PCR仪。所有引物均由美国Invitrogen公司合成。Nrf2上游引物:5′-TTCCTCT GCTGCCATTAGTCAGT-3′,下游引物:5′-GCTCTTC CATTTCCGAGTCACT-3′,扩增片段长度为215 bp,以β-actin为检测内参,2-ΔΔCT用于计算相对表达量。反应体系为20 μL,每组实验设置3个复孔。
1.3.5 组织蛋白的提取
将切除的大鼠脑组织块迅速置于预冷生理盐水中漂洗,将组织切成小块(200 mg~1 g之间),分析天平上称重,加入组织质量数值10倍的哺乳动物组织总蛋白提取试剂(提前按比例加入酶抑制剂),在组织匀浆器中均浆,将组织研磨完全。随后进行超声处理,冰上裂解4~5 h,10 000 r/min离心10 min,取中层溶液,加入等体积的蛋白上样缓冲液(稀释2倍),随后置于100℃水浴箱沸水浴中变性5 min,分装到-80℃中保存。
1.3.6 Western Blot检测
按照BCA蛋白浓度测定试剂盒的说明书进行操作,鉴定蛋白浓度。每组分别取30 μg样本,进行10%的SDS-PAGE凝胶电泳实验。将蛋白转移至PVDF膜上,5% BSA室温封闭1~2 h,加入1∶2000的兔抗鼠Nrf2多克隆抗体和1∶1000兔抗鼠β-catin抗体,4℃过夜。TBST洗膜3次,每次10 min,加入1∶10 000的辣根过氧化物酶标记的羊抗兔的二抗,室温孵育1 h,TBST洗膜3次,每次10 min。加入ECL发光剂并用X片曝光、显影、定影、扫描并保存条带图片。Quantity One软件分析,以目的蛋白的条带的灰度值和内参β-actin的蛋白灰度值比值来确定目的蛋白的相对表达水平,每组实验设置三个复孔。
1.3.7 氧化应激相关指标的检测
分析天平上分别称取各组大鼠脑组织100 mg,放入干净的匀浆管中,加入预冷的生理盐水(0.9%,脑组织体积的10倍),迅速用眼科剪将组织剪碎,匀浆器上匀浆(冰上),2000 r/min离心5~10 min,收集上清液,-20℃中保存备用。分别按南京建成生物工程研究所提供的试剂盒说明书进行操作,通过化学比色法检测大鼠脑组织中MDA和GSH的含量、SOD和CAT的活力。
1.3.8 脑组织中HO-1和iNOS活力检测
分析天平上称取大鼠脑组织100 mg,加入10倍体积预冷0.9%生理盐水,迅速用眼科剪将组织剪碎,匀浆器上匀浆(冰上),2000 r/min离心10 min,收集上清液。按照HO-1和iNOS的ELISA试剂盒说明书进行操作,首先对标准品进行稀释,分别设置标准孔、空白孔(无酶标试剂)、样品孔。分别为标准品50 μL加入酶标包被板,40 μL样品稀释液加入待测样品孔,待测样品10 μL,封板后37℃恒温培养箱中孵育5 min。将浓缩洗涤液稀释30倍以备用,揭去封板膜,弃液体甩干,加洗涤液静置30 s,弃洗涤液,重复5次,甩干,加酶标试剂,每孔500 μL,空白孔,不加,37℃孵育3 min,洗涤液洗涤,加入显色剂(A液50 μL,B液50 μL,将A液和B液混匀)。37℃锡箔纸避光后显色15 min。显色结束后向每孔加入50 μL的反应终止液。超微量微孔板分光光度计用以检测吸光度(OD值,波长450 nm),并设置空白调零孔。实验数据处理:绘制标准曲线,其中横坐标-标准物浓度,纵坐标-OD值。根据标准曲线查出所测的样品OD值所对应的浓度,实际浓度为对应浓度值乘以稀释倍数,根据说明书提供的公式计算大鼠脑组织匀浆液中HO-1、iNOS的活力。
1.3.9 免疫组化检测Nrf2的表达
PBS冲洗,共3次,每次5 min,加显色剂(配置方法:1 mL水中1滴显色剂A,1滴显色剂B,1滴显色剂C)混匀,清水冲洗10 min后,苏木精复染,水中冲洗干净切片,依次放入70%无水乙醇,80%无水乙醇,95%无水乙醇,100%无水乙醇-二甲苯,二甲苯。各2 min,将切片置于通风橱中,中性树胶封片晾干,显微镜下采集图像(×200),Nrf2蛋白表达的定性研究采用直接观察是否核表达,根据阳性细胞在全部组织细胞中所占比例和阳性细胞染色强度判定实验结果∶A∶按显色细胞数记分,阳性细胞数<1/3为1分,阳性细胞数1/3~2/3为2分,阳性细胞数>2/3为3分。 B∶按细胞显色深浅记分,无阳性反应细胞为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。积分数=A×B。A×B=0判断为(-),A×B=1~2判断为(+),A×B=3~4为(++),A×B=5~9为(+++),该半定量评分由我院三位病理科技术人员共同阅片打分,取平均值。
1.4 统计学方法

2 结果
2.1 Nrf2在脑组织中的mRNA和蛋白表达
四组脑组织中Nrf2的mRNA和蛋白表达水平整体比较,差异均有显著性(P<0.05)。与正常对照组比较,TBI 组、TBI+S 组脑组织中Nrf2 mRNA和蛋白表达水平明显升高(P<0.05);与TBI组及TBI+S组比较,TBI+C组脑组织中Nrf2mRNA和蛋白表达水平则明显降低(P<0.05),而TBI组与TBI+S组比较差异无显著性(P>0.05)。Nrf2 蛋白表达水平见图1A,Nrf2 mRNA表达水平见图1B,数据详见表1。
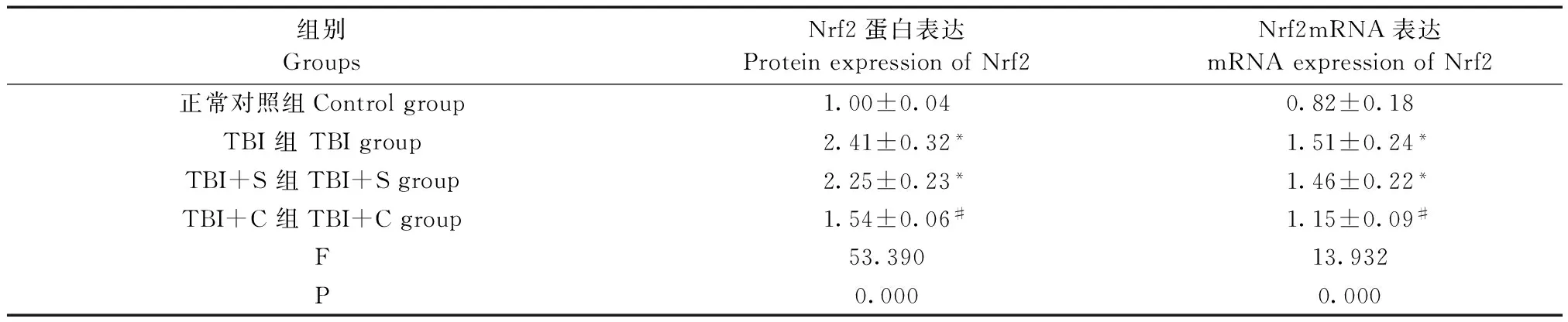
表1 Nrf2在脑组织中的mRNA和蛋白表达(n=5)Tab.1 Expressions of Nrf2 mRNA and protein in the brain tissues
注:与正常对照组比较,*P<0.05;与TBI组、TBI+S组比较,#P<0.05。
Note.Compared with the control group,*P<0.05. Compared with the TBI group and TBI+S group,#P<0.05.
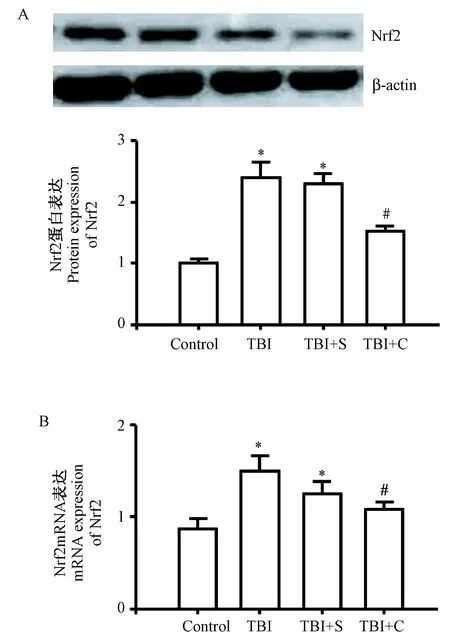
注:与正常对照组比较,*P<0.05;与TBI组、TBI+S组比较,#P<0.05。图1 QRT-PCR和West Blot检测Nrf2的mRNA和蛋白表达水平 Note.Compared with the control group,*P<0.05. Compared with the TBI group and TBI+S group, #P<0.05.Fig.1 Expresssion levels of Nrf2 mRNA and protein detected by qRT-PCR and West blot
2.2 脑组织中MDA、GSH、SOD、CAT含量/活性变化
四组脑组织中MDA、GSH、SOD、CAT含量/活性整体比较,差异均有显著性(P<0.05)。与正常对照组比较,TBI组和TBI+S组脑组织中SOD、CAT活性,GSH的含量显著降低,而MDA的含量显著增加(P<0.05)。与TBI组、TBI+S组比较,TBI+C组的脑组织中SOD、CAT活性,GSH的含量显著增加(P<0.05),而MDA的含量显著降低(P<0.05),而TBI组与TBI+S组比较差异无显著性(P>0.05)。见图2和表2。即姜黄素治疗可使脑损伤组织中SOD和CAT活性,GSH含量增加,MDA含量降低,逆转脑损伤所致的抗氧化应激相关因子的改变趋势。
2.3 脑组织中HO-1和iNOS含量变化
四组脑组织中HO-1和iNOS含量整体比较,差异均有显著性(P<0.05)。与正常对照组相比,TBI组和TBI+S组脑组织中HO-1和iNOS的含量均显著增加(P<0.05)。与TBI组、TBI+S组比较,TBI+C组脑组织的HO-1和iNOS含量显著降低(P<0.05),而TBI组与TBI+S组比较差异无显著性(P>0.05)。见图3和表3。即姜黄素可逆转脑外伤所致的HO-1和iNOS的含量增加。
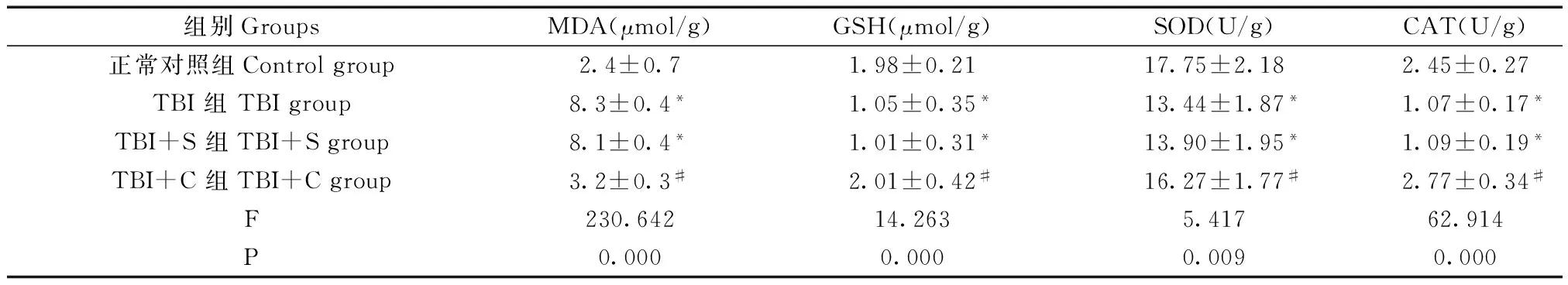
表2 脑外伤对大鼠脑组织中MDA、GSH、SOD、CAT含量/活性的影响(n=5)Tab.2 Effects of traumatic brain injury on the content/activity of MDA, GSH,SOD and CAT in the rat brain tissues
注:与正常对照组比较,*P<0.05;与 TBI组、TBI+S组比较,#P<0.05。
Note.Compared with the control group,*P<0.05. Compared with the TBI group and TBI+S group,#P<0.05.
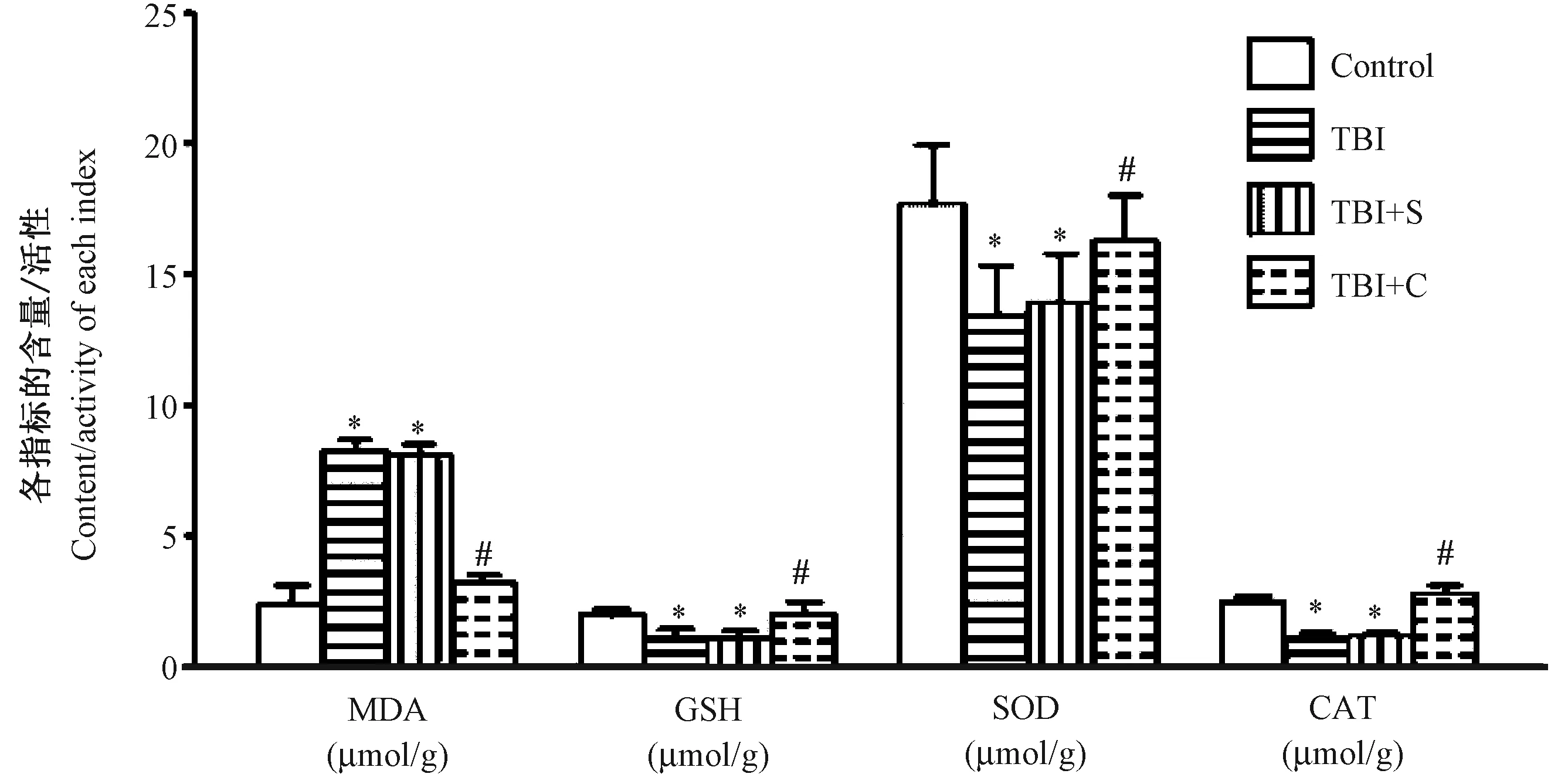
注:与正常对照组比较,*P<0.05;与 TBI组、TBI+S组比较,#P<0.05。图2 脑组织中MDA、GSH、SOD、CAT含量/活性比较Note.Compared with the control group,*P<0.05. Compared with the TBI group and TBI+S group, #P<0.05.Fig.2 Comparison of the contents of MDA, SOD and CAT in the brain tissues
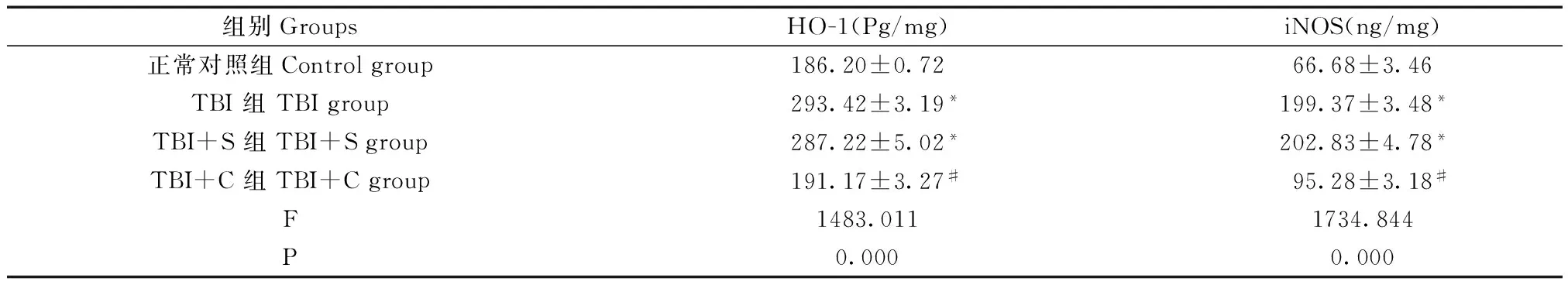
组别GroupsHO-1(Pg/mg)iNOS(ng/mg)正常对照组Controlgroup186.20±0.7266.68±3.46TBI组TBIgroup293.42±3.19*199.37±3.48*TBI+S组TBI+Sgroup287.22±5.02*202.83±4.78*TBI+C组TBI+Cgroup191.17±3.27#95.28±3.18#F1483.0111734.844P0.0000.000
注:与正常对照组比较,*P<0.05;与 TBI组、TBI+S组比较,#P<0.05。
Note.Compared with the control group,*P<0.05. Compared with the TBI group and TBI+S group,#P<0.05.
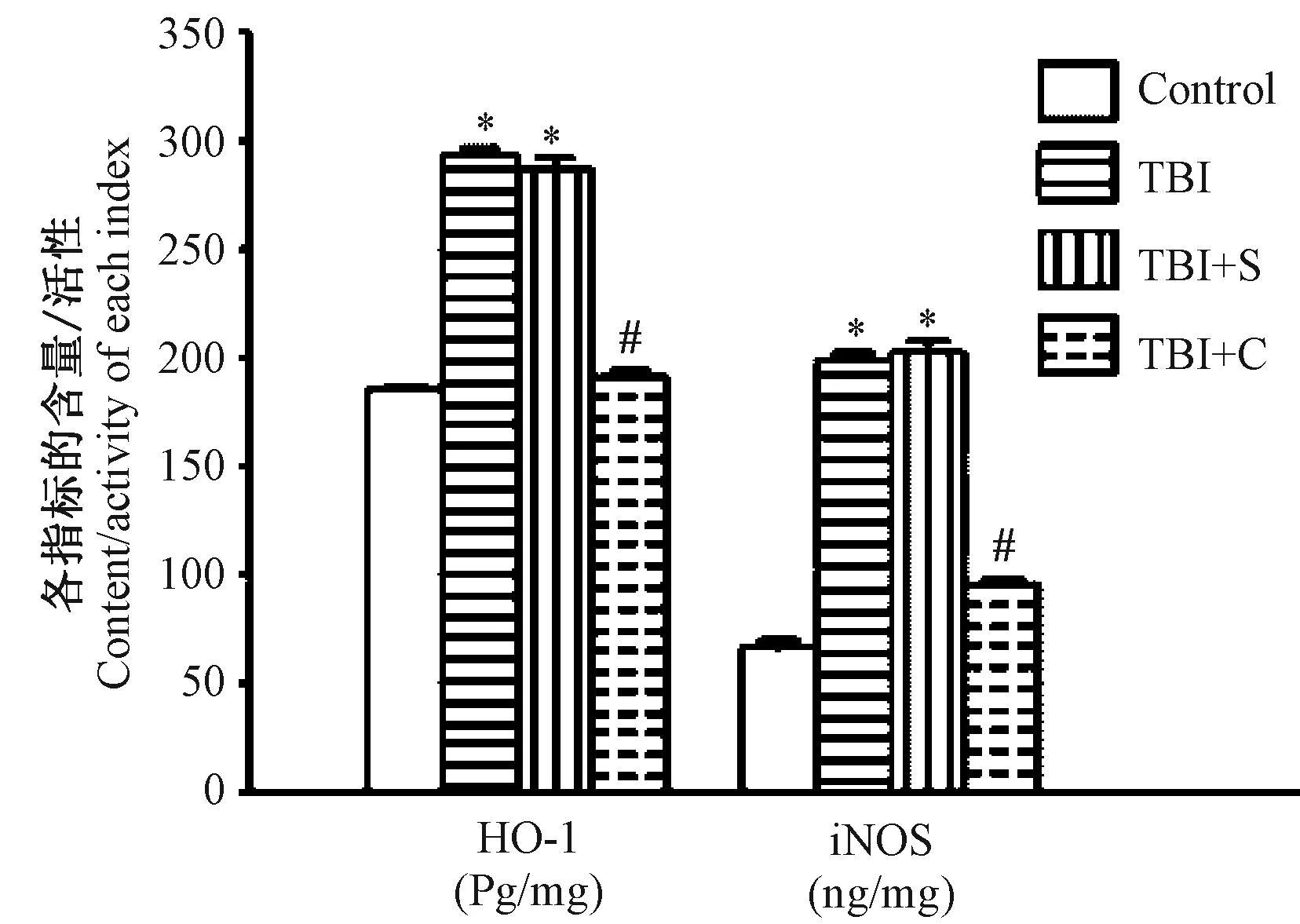
注:与正常对照组比较,*P<0.05;与 TBI组、TBI+S组比较,#P<0.05。图3 脑组织中HO-1和iNOS含量变化Note.Compared with the control group,*P<0.05. Compared with the TBI group and TBI+S group,#P<0.05.Fig.3 Changes of HO-1 and iNOS contents in the brain tissues
2.4 免疫组化检测Nrf2表达
四组脑组织中Nrf2的蛋白表达整体比较,差异有显著性(P<0.05)。与正常对照组相比,TBI组和TBI+S组脑组织中Nrf2的蛋白表达显著增强(P<0.05);与TBI组、TBI+S组相比,TBI+C组的Nrf2的蛋白表达则明显降低(P<0.05),而TBI组与TBI+S组比较差异无显著性(P>0.05)。见表4及图4。
客户服务代表、销售代表、供应链专业人员、市场专员,他们从“数据分析”中获得的信息都是不一样的,据此安排的活动和获得的结果也是因人而异。当为商业问题提供一个“数据分析”解决方案时,需要将客户作为考虑的和规划优化用户重点。
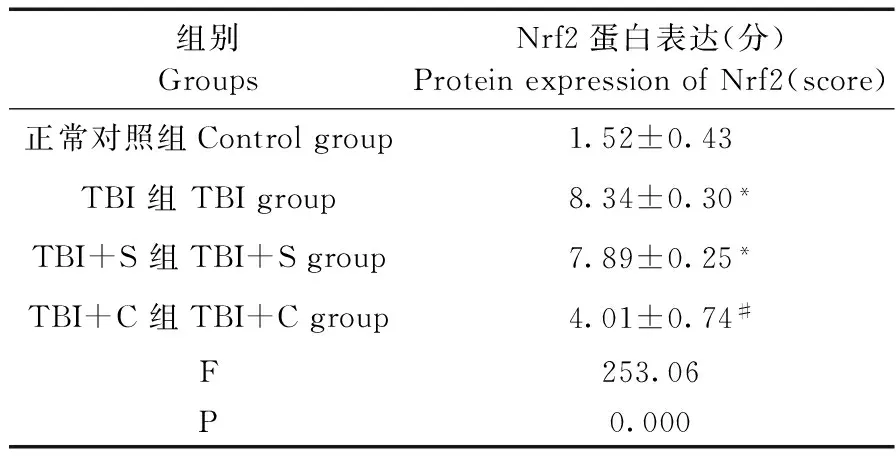
表4 免疫组化检测脑组织中的Nrf2表达(n=5)Tab.4 Immunohistochemical detection of Nrf2 expression in the brain tissues
注:与正常对照组比较,*P<0.05;与 TBI组、TBI+S组比较,#P<0.05。
Note.Compared with the control group,*P<0.05. Compared with the TBI group and TBI+S group,#P<0.05.
3 讨论
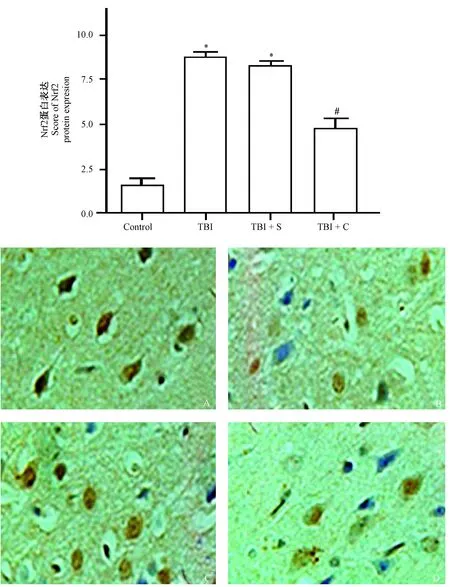
注:脑组织切片:A:正常对照组,B:TBI组,C:TBI+S组,D:TBI+C组4组大鼠的切片。浅黄色、棕黄色或棕褐色部位为Nrf2核表达的阳性细胞,蓝色部位为细胞核染色。与正常对照组比较,*P<0.05;与 TBI组、TBI+S组比较,#P<0.05。图4 免疫组织化学检测Nrf2蛋白的表达水平(×400)Note.Brain tissues from a rat of the control group (A), TBI group (B), TBI+S group (C) and TBI+C group (D). Pale yellow, pale brown and brown colors indicate the positive cells with nuclear expression of Nrf2. Compared with the control group,*P<0.05. Compared with the TBI group and TBI+S group, #P<0.05.Fig.4 Immunohistochemical detection of expression levels of Nrf2 protein in the brain tissues
姜黄素是从姜黄和莪术等植物根茎中分离纯化后得到的一种黄色粉末,其结构稳定,脂溶性强,体内代谢迅速,药理作用广泛,具有抗氧化、抗肿瘤、抗炎等作用,临床常用于治疗鼻炎,鼻窦炎,呼吸道疾病等[3-6]。由于姜黄素口服时存在首关效应及代谢迅速的现象,其生物利用度较低,因此临床上姜黄素多用于治疗肠道疾病[11]。近年来,有大量研究报道显示姜黄素对改善急性肾损伤、缺氧或缺血性脑损伤、脑损伤后的炎症反应、大脑因缺血或再灌注引起的脑损伤等有很好的疗效,但姜黄素发挥脑损伤保护作用的分子机制仍不明确[12-13]。
脑外伤是机械性外力所致的颅脑创伤,可对患者的生理和心理造成严重损伤,其致死和致残率极高[14]。研究显示氧化应激在脑外伤康复中发挥着重要的作用,脑外伤导致脑组织缺血、缺氧,期间活性氧(reactive oxygen species,ROS)大量产生,ROS产生量大于机体可承受的抗氧化能力后,机体产生氧化应激,保护损坏组织[15-16]。人体中枢神经系统易发生脂质过氧化,使神经元受损伤,此时中枢神经系统可调用内源性抗氧化酶防御体系,维持细胞内氧化还原平衡,保护神经元免受损伤[17-18]。人体内的抗氧化系统分两种。一种为抗氧化酶类,如SOD、CAT等。一种为非酶性抗氧化剂,如还原性GSH、MDA等[19-20]。本研究中我们检测了脑组织中MDA、GSH、SOD、CAT的含量/活力变化,发现与正常对照组相比,TBI组和TBI+S组脑组织中SOD和CAT活性,GSH的含量显著降低,而MDA的含量显著增加(P<0.05),而姜黄素可逆转该变化。即姜黄素可使脑损伤后机体抗氧损伤的酶SOD和CAT的活性增加,而脂质氧化损伤后的产物MDA的含量减少,GSH的含量增加,该研究结果与已有研究一致[21]。
Nrf2为含有碱性亮氨酸拉链结构的核转录因子,机体未受损伤时,常存在于细胞浆中。研究显示细胞质接头蛋白(kelch-like ECH-associated protein 1,Keap1)可与Nrf2的氨基端特异性结合,抑制Nrf2活性,机体受刺激时,Nrf2经磷酸化转移至细胞核,磷酸化的Nrf2可通过ERK、P38等通路与Maf家族蛋白结合形成二聚物,随后Nrf2与ARE相结合,激活下游抗氧化应激相关酶的表达,诱导多种抗氧化酶及解毒酶基因的协同表达,例如iNOS和HO-1,从而发挥对组织/细胞的保护作用[22-23]。本研究中我们发现,与正常对照组相比,TBI组、TBI+S组脑组织中Nrf2的mRNA和蛋白表达明显增加(P<0.05),iNOS和HO-1的含量也显著增加(P<0.05);与TBI组、TBI+S组相比,姜黄素治疗后脑损伤脑组织中Nrf2的mRNA和蛋白表达明显降低(P<0.05),iNOS和HO-1的含量也显著减少(P<0.05),即姜黄素可逆转Nrf2、iNOS和iNOS的变化。表明姜黄素能够下调Nrf2的mRNA和蛋白表达,通过抑制Nrf2的表达,激活和诱导下游抗氧化应激相关酶iNOS和HO-1的表达,发挥脑损伤的保护作用,实验结果与已有研究相一致[24]。
此外,本研究采用采用DMSO作为姜黄素的溶剂。为排除DMSO所产生的影响,特增加溶剂对照组(即文中TBI+S组)。试验结果表明,该组的mRNA和蛋白表达水平和TBI组相近(P>0.05),其它指标如脑组织中MDA、GSH、SOD、CAT、HO-1和iNOS含量/活性变化或免疫组化所测得Nrf2表达水平,都和TBI组差别不大。即提示其可能的脑保护功能并未出现。究其原因,是因为一则DMSO的脑保护功能可能相对有限,且和阳性组(即TBI+C组)同样加入,即使存在有限的脑保护作用,其误导干扰影响也是均衡的;二则本实验中最终姜黄素的溶解溶剂并不是纯DMSO,其中DMSO的量非常较少,几乎可以忽略不计。具体为:姜黄素先配置成2 g/mL的母液(溶剂为DMSO),实验时用生理盐水稀释2000倍成1 mg/mL,其中DMSO的量非常少,体积百分浓度约为1/2000,起不到明显的脑保护作用。但在今后的研究中,还将进一步关注此问题。
综上,姜黄素可促进脑损伤大鼠脑组织的抗氧化应激作用,它能够通过降低Nrf2的表达,激活下游抗氧应激相关的通路,使下游抗氧应激相关的指标发生改变,从而起到对脑组织的保护作用。
参考文献:
[1] Nayak AP, Mills T, Norton I. Lipid based nanosystems for curcumin: past, present and future [J]. Curr Pharm Des, 2016, 22(7): 4247-4256.
[2] 李伟锋,蒋建兰.姜黄素药理作用的研究现状[J].中国临床药理学杂志,2017,(10):957-960.
[3] Lin C, Wu X. Curcumin protects trabecular meshwork cells from oxidative stress [J]. Invest Ophthalmol Vis Sci, 2016, 57(10): 4327-4332.
[4] Yu X, Zhong J, Yan L, et al. Curcumin exerts antitumor effects in retinoblastoma cells by regulating the JNK and p38 MAPK pathways [J]. Int J Mol Med, 2016, 38(3): 861-868.
[5] Daily JW, Yang M, Park S. Efficacy of turmeric extracts and curcumin for alleviating the symptoms of joint arthritis: a systematic review and meta-analysis of randomized clinical trials [J].J Med Food, 2016, 19(8): 717-729.
[6] 王沛坚, 黄鸣清, 蒲春华, 等. 姜黄素激活AMPK抑制高糖介导的氧化应激水平升高致血管内皮功能障碍 [J]. 现代生物医学进展, 2015, 15(7): 1237-1240.
[7] Reis C, Wang Y, Akyol O, et al. What’s new in traumatic brain injury: update on tracking, monitoring and treatment [J]. Int J Mol Sci, 2015, 16(6): 11903-11965.
[8] 王菊香, 朱新波. 姜黄素对缺血缺氧性脑损伤新生鼠脑组织SOD和MDA含量的影响 [J]. 中国药理学通报, 2013, 29(9): 1327-1328.
[9] Wang W, Li M, Wang Y, et al. GSK-3β as a target for protection against transient cerebral ischemia [J]. Int J Med Sci, 2017, 14(4): 333-339.
[10] 郭梦凡, 王彩霞, 刁为英, 等. 姜黄素对于大鼠创伤性脑损伤后Bcl-2,Caspase-3蛋白表达的影响 [J]. 牡丹江医学院学报, 2016, 37(1): 6-9.
[11] Liu W, Zhai Y, Heng X, et al. Oral bioavailability of curcumin: problems and advancements [J]. J Drug Target, 2016, 24(8): 694-702.
[12] Yu L, Fan Y, Ye G, et al. Curcumin inhibits apoptosis and brain edema induced by hypoxia-hypercapnia brain damage in rat models [J]. Am J Med Sci, 2015, 349(6): 521-525.
[13] 赵荣,刘江伟,许永华, 等. 姜黄素对沙漠干热环境中暑大鼠脑损伤的保护作用研究 [J]. 实验动物科学, 2016, 33(6): 21-24.
[14] 龙鸿川, 阚奇伟, 刘泗军, 等. 高压氧治疗脑外伤后综合征213例疗效观察 [J]. 海南医学, 2012, 23(8): 49-51.
[15] Lvovskaya EI, Derginskyi NV, Sadova VA, et al. Prognostic value of the parameters of free radical oxidation in traumatic brain injury [J]. Biomed Khim, 2016, 62(1): 107-111.
[16] Yuan Y, Zhang X, Zheng Y, et al. Regulation of mitophagy in ischemic brain injury [J]. Neurosci Bull, 2015, 31(4): 395-406.
[17] Apostolova N, Victor VM. Molecular strategies for targeting antioxidants to mitochondria: therapeutic implications [J]. Antioxid Redox Signal, 2015, 22(8): 686-729.
[18] Hassan W, Noreen H, Khalil S, et al. Ethanolic extract of Nigella sativa protects Fe(II) induced lipid peroxidation in rat’s brain, kidney and liver homogenates [J]. Pak J Pharm Sci, 2016, 29(1): 231-237.
[19] Dudek H, Farbiszewski R, Rydzewska M, et al. Evaluation of antioxidant enzymes activity and concentration of non-enzymatic antioxidants in human brain tumours [J]. Wiad Lek, 2004, 57(1-2): 16-19.
[20] Dudek H, Farbiszewski R, Rydzewska M, et al. Concentration of glutathione (GSH), ascorbic acid (vitamin C) and substances reacting with thiobarbituric acid (TBA-rs) in single human brain metastases [J]. Wiad Lek, 2005, 58(7-8): 379-381.
[21] McLafferty FS, Barmparas G, Ortega A, et al. Predictors of improved functional outcome following inpatient rehabilitation for patients with traumatic brain injury [J]. Neuro Rehab, 2016, 39(3): 423-430.
[22] Wu H, Kong L, Tan Y, et al. C66 ameliorates diabetic nephropathy in mice by both upregulating NRF2 function via increase in miR-200a and inhibiting miR-21 [J]. Diabetologia, 2016, 59(7): 1558-1568.
[23] Tapia E, García-Arroyo F, Silverio O, et al. Mycophenolate mofetil and curcumin provide comparable therapeutic benefit in experimental chronic kidney disease: role of Nrf2-Keap1 and renal dopamine pathways [J]. Free Radic Res, 2016, 50(7): 781-792.
[24] Lu XY, Wang HD, Xu JG, et al. Deletion of Nrf2 exacerbates oxidative stress after traumatic brain injury in mice [J]. Cell Mol Neurobiol, 2015, 35(5): 713-721.

