六年实验动物病原菌检测能力验证结果分析
邢 进,冯育芳,王 洪,张雪清,付 瑞,岳秉飞
(中国食品药品检定研究院,实验动物资源研究所,北京 100050)
能力验证(proficiency testing, PT)是利用实验室间比对来判定实验室和检测机构能力的活动。作为一项重要的外部质量评价活动,利用实验室间的比对,按照预先制定的准则评价参加者的能力。参加能力验证活动,是实验室证明其技术能力的一种重要方式,也是认可机构加入和维持国际相互承认协议(MRA)的必要条件之一。寻求中国合格评定国家认可委员会(CNAS)认可和已获准认可的机构必须满足CNAS的能力验证相关政策,并按照CNAS能力验证领域、频次要求参加CNAS组织或承认的能力验证活动,包括能力验证计划、实验室间比对和测量审核活动。[1-2]。
近年来,我国实验动物领域不断发展,许多相关研究已达到国际领先水平。实验动物质量检测作为保障实验动物和动物实验质量的根本手段,开展能力验证活动势在必行。通过能力验证活动,可以增进实验动物检测实验室间的交流,发现自身不足,补充、完善内部质量控制技术,提高质量检测能力和水平。本院从2011年开始采用与CNAS联合举办能力验证活动,在病毒[3-5]、病原菌[6-8]和遗传[9-10]检测项目上积累了丰富的经验。2015年本院顺利通过了CNAS能力验证提供者(Proficiency Testing Provider,PTP)的现场评审,成为合格的能力验证提供者。
实验动物细菌检测是实验动物质量检测的重要内容,依据《实验动物微生物学检测方法(2)》[11],对常用实验动物的检测方法主要包含分离培养法和血清学方法。目标菌主要包括感染呼吸道和肠道的病原菌。本院作为能力验证活动的提供者,依据CNAS-RL02《能力验证规则》[1]和CNAS-RL03《能力验证提供者认可准则》[12]在2011、2013~2017年共开展了六次能力验证活动,包括对7种病原菌的检测。现将其汇总如下。
1 材料和方法
1.1 样品制备
1.1.1 血清样品
用标准菌株超声波破碎制备免疫抗原,免疫小鼠和大鼠,获得免疫血清。用ELISA和IFA方法分别测定支原体和泰泽病原体的抗体效价,制成强阳性、弱阳性的工作浓度和阴性样本后分装于螺口冻存管,至-20℃保存。
1.1.2 带菌样品
将目标菌株和干扰菌株复苏后分别采用生化鉴定和16SrDNA测序的方式进行鉴定,确认无误后开展下一步制备。用灭菌生理盐水制成菌悬液,然后按比例加入细菌保护液。与灭菌的或带菌清楚的动物样品均匀混合,制成带菌匀浆。样品分装于螺口1.5 mL无菌冻存管中。2014年开始,样品均采用冷冻干燥处理。见表1。
六次能力验证中设置了免疫血清和带菌样品。所用菌株和样品形式如表1。
1.2 样品检验
编号前,依据CNAS-GL03[13]文件要求,采用国家标准中的方法对制备好的样品进行均匀性、稳定性评价,确保样品符合要求。分别随机抽取已制备样品总数量的10%用于均匀性和稳定性检验。进行均匀性评价时,对血清样品采用OD值S≤0.3σ方法,对带菌样品定性观察培养出的目标菌落数。稳定性评价至少进行4℃、室温(23℃~25℃)和36℃温度下的存放稳定性检验,血清样品时间至少为2周,带菌样品时间至少为1个月。
1.3 样品编号
除2011年采用相同编号外,其他年份的比对样品均采用顺序编号,各样品随机组合,由软件自动分配,确保每个参与实验室随机得到3份或5份样品,见表1。2016年样品分组采用三种不同样品全部随机的方式编排,因此有可能出现各种组合,即可能存在3份阴性或3份阳性的极端情况。实验室无法通过样品编号判断组别,防止了实验室间对结果的相互沟通。
1.4 样品发放
2015年之前的样品通过EMS形式运输,外包装为泡沫塑料,内至冰袋和样品。2016年后除个别地区的限制,仍采用冰袋冷藏外,其他地区均采用干冰冷链运输。
1.5 评价方法
各实验室收到的所有样品的测定结果与标准结果完全一致时,被判定为满意结果;任何1份样品的测定结果与标准结果不一致时,即判定为不满意结果;实验室如果未按时限反馈结果,也将判定为不满意结果。
2 结果
2.1 参与单位统计
从2011年、2013~2017年,共有45家单位参与了能力验证活动,参与次数4次以上的有18家,见图1。参与单位类型主要分为实验动物检测机构、疾病预防控制中心、药监系统、科研院校和企业实验室,见图2。2011年只有实验动物检测机构参与。其中药检系统和科研院校的数量变化相对较大。

表1 实验动物病原菌检测能力验证所用菌株和样品形式Tab.1 Strains and sample forms of PT for detection of laboratory animal pathogenic bacteria

图2 参与单位类型Fig.2 Types of laboratories participating in PT
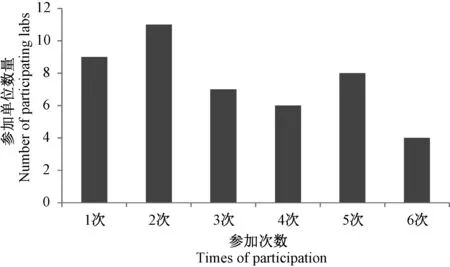
图1 单位参与次数Fig.1 Laboratory participation statistics
2.2 结果汇总
2011年开展了2项比对项目,检测血清中的抗体。2012年未开展。2013~2017年为检测动物样品中的病原菌。几项能力验证的满意率在75%~96.2%之间。见表2。其中获得不满意结果的实验室后续均通过了测量审核。
能力验证活动没有规定检测方法,参与单位可根据自身情况自行选择。参与单位多数按照国家标准中的方法进行检测,少数实验室采用PCR方法直接扩增样品中的特异片段,也可取得满意结果。
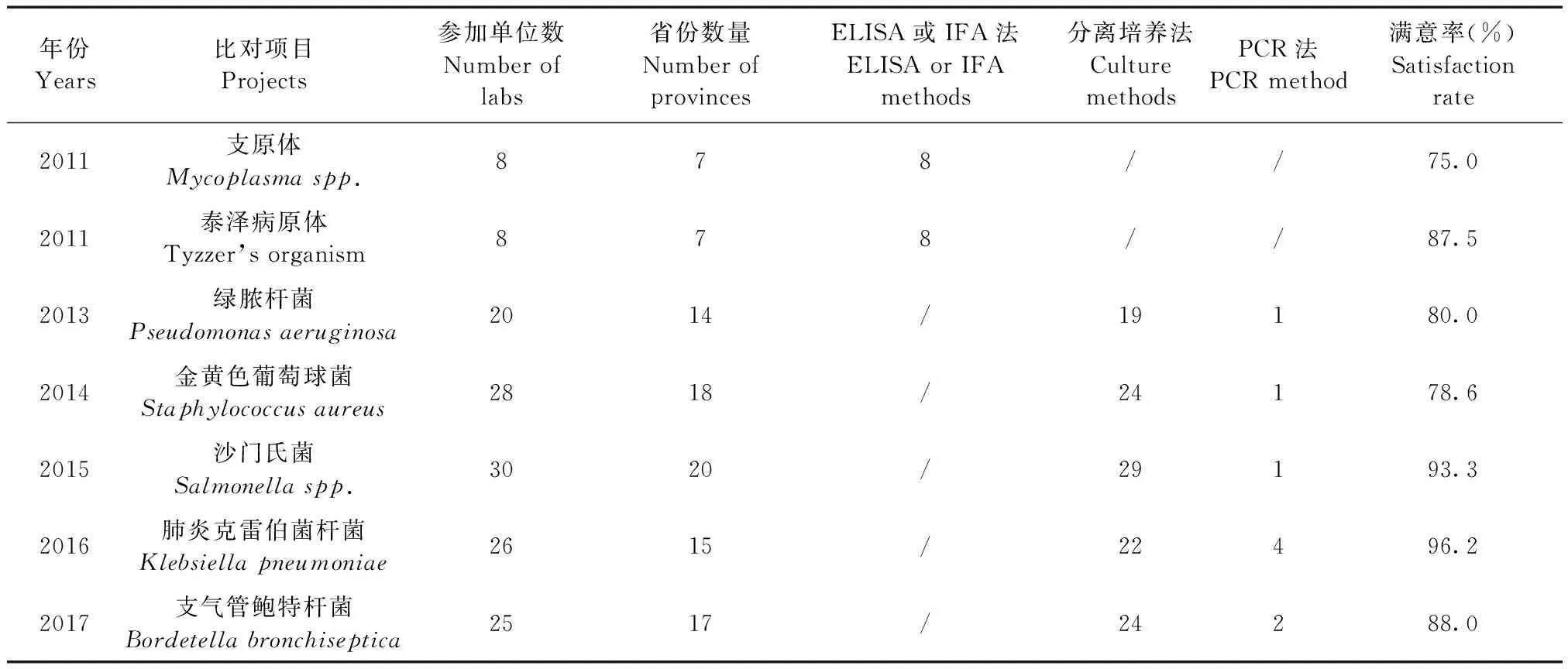
表2 2011年、2013~2017年实验动物细菌能力验证项目和结果Tab.2 Projects and results of PT for detection of laboratory animal pathogenic bacteria from 2011 and 2013-2017
3 讨论
3.1 项目的选择
2011年本院首次尝试性开展国内实验室比对工作。充分考虑样品制备和实验室比对的可操作性,在项目选择上遵循由易到难的原则,首先进行的是血清学检测项目。支原体和泰泽病原体是清洁级大、小鼠的必检项目,在国家标准中可采用血清学方法检测,对检测实验室软硬件要求不高,可以比较方便的购买到两种病原菌的检测试剂盒。通过对这两个项目的检测,能够直接考察参与实验室在实验动物病原菌血清学检测方面的基本能力。经过一年的准备,2013年开始连续开展了四年肠道细菌检测项目带菌样品的能力验证工作。分别是对绿脓杆菌、金黄色葡萄球菌、沙门氏菌和肺炎克雷伯杆菌的检测。选择这四种细菌主要有三方面原因:①易培养、保存和鉴定。这四种细菌对培养条件的要求相对较低,而且具有特征性的鉴别要点,样品制备时容易获得稳定的样品,便于后续比对实验的开展。②阳性率高。特别是绿脓杆菌和金黄色葡萄球菌,是实验动物中肠道细菌阳性率最高的两种病原菌,沙门氏菌和肺炎克雷伯杆菌次之,均严重影响动物实验和人员健康。③等级检测需要。沙门氏菌是国家标准中各级别动物首先要排除的病原菌,另外三种细菌均为SPF级啮齿类和兔中必须要排除的病原菌,通过对这几种常见的肠道病原菌的能力验证,能够比较全面的考察参加实验室在肠道病原菌检测方面的能力。经过连续几年的能力验证活动,反馈结果的满意率逐渐提高。2017年首次开展了呼吸道细菌的带菌样品的验证活动,在样品制备方面也提出了更高的要求。先期开展的项目是支气管鲍特杆菌,作为SPF级动物必检项目,该菌比其他呼吸道病原菌更易培养和保存,通过制备工艺的调整,样品均稳实验获得理想结果,为下一步呼吸道病原菌检测项目的扩展奠定了基础。
3.2 样品制备
目前实验动物病原菌能力验证的带菌样品中的基质,如粪便或回盲内容物等均经过严格的检测或灭菌处理,确保无待检目标菌的存在。同时,通过添加保护剂和冷冻干燥的方法,最大程度的保持样品中受试菌的稳定性,不受外界环境干扰。并且不断完善准确性、均匀性和稳定性的实验方法,建立实验动物细菌PT样品的质量控制程序,确保制备出合格的PT样品。
3.3 检测方法
2011年开展的支原体和泰泽病原体项目检测方法主要是酶联免疫吸附试验(ELISA)和间接免疫荧光试验(IFA)方法,使用设备和试剂相对单一,操作程序成熟。使用新鲜配制的试剂,按照常规检测方法操作均可检测准确。针对带菌样品的检测方法一方面可选择传统的分离培养法,对可疑菌进行生化鉴定;另一方面也可以采用快速的PCR方法,对样品直接提取DNA,采用特异性引物扩增其中的目的基因。根据5项带菌项目的检测结果,PCR方法均获得满意结果。对于非常规性的实验动物检测实验室而言,PCR是非常理想的方法。
3.4 不满意结果分析
通过对反馈结果和报告的分析,将不满意结果的原因总结为以下几个方面:(1)培养时间不足。比如绿脓杆菌在初代分离培养时应在NAC液体培养基中培养至72 h;金黄色葡萄球菌初代在高盐甘露醇琼脂培养基中培养至36~48 h,最有利于菌落形态的观察。(2)可疑菌落筛错误。从样品的初代分离培养物中筛选出可疑的目标菌需要有丰富的细菌学检测经验,初代可疑菌的挑取对后续的细菌鉴定至关重要。绿脓杆菌比对项目中设置了不产色素菌株,金黄色葡萄球菌项目中设置了浅黄色菌落的木糖葡萄球菌作为干扰项,沙门菌项目中设置了普通变形杆菌作为干扰项,支气管鲍特杆菌项目中设置了嗜肺巴斯德杆菌作为干扰项。当出现大量非典型菌落和相似菌落的情况时有可能出现漏检。(3)生化鉴定错误。生化鉴定是细菌鉴定的关键步骤。根据国家标准进行手工鉴定时容易造成主观判定的误差。当个别生化项目与标准不符时,容易得出假阴性结论。(4)报告书写错误。检测结果准确,原始记录中编号书写混淆导致最终报告错误。(5)未及时反馈结果。当能力验证样品发样时间有可能与高校或科研单位的暑假相冲突,造成未及时对样品进行处理和检测,造成结果反馈超期。
最初的从不满意结果的原因能够看出鉴定试剂有可能成为结果的决定。实验动物微生物检测试剂主要包括培养基、生化鉴定试剂、血清学检测试剂等。专门用于实验动物检测的试剂仍然比较匮乏。现有这些试剂的质量和判定标准存在一定差异。2011年的两项检测均为血清学方法,支原体采用ELISA方法,泰泽病原体采用ELISA或IFA方法。国内市场上支原体和泰泽病原体的抗体检测试剂非常少,进口试剂往往价格昂贵,订购周期长,很大程度上限制了检测工作的开展。在细菌培养基方面,国产培养基质量不断提高,从比对结果和原始记录分析,不同来源的国产或进口培养基对分离结果的没有显著影响。
实验动物细菌检测中,对可疑菌的生化鉴定是最关键内容。随着检测技术和检测条件的提高,自动化鉴定设备已经逐步应用于检测中。2013~2017年使用商品化鉴定试纸条或自动细菌鉴定仪的实验室所占比例分别为30%左右,均获得满意结果。采用手工生化鉴定时,常因试剂反应弱或反应滞后造成主观判断错误。
3.5 工作展望
开展能力验证的根本目的是为了提高实验动物检测机构的能力和水平。本院开展能力验证以来,参与单位数量从2011年的8家增加到最多时的30家,一共有45个单位参与了能力验证工作。前几年的实验动物病原菌检测能力验证满意率整体稳定,并且呈稳步升高的趋势。随着国内实验动物检测机构检测水平的不断提升,能力验证样品的难度设置也应相应增加,同时对PTP的要求也更高。虽然顺利的完成了此前的能力验证工作,但其中很多环节仍有待改进,比如完善样品制备工艺、增加检测项目,丰富样品设置等。希望在全国实验动物工作者的共同努力和支持下,能力验证工作能够助力国内实验动物质量检测整体水平的进一步提高。
参考文献:
[1] CNAS-RL02,能力验证规则[S].
[2] 中国合格评定国家认可委员会.能力验证简介[DB/OL]. https://www.cnas.org.cn/fwzl/nlyzzl/nlyzjj/2013/01/723096.shtml
[3] 李晓波,王洪,付瑞, 等. 实验大鼠细小病毒H-1株抗体检测能力验证结果评价 [J]. 中国药事,2014, 28(9):990-994.
[4] 王吉, 付瑞, 李晓波, 等. 实验小鼠呼肠孤病毒Ⅲ型抗体的实验室检测能力验证结果评价[J]. 中国实验动物学报, 2016, 24(2): 183-187.
[5] 付瑞, 王洪, 王淑菁, 等. 兔出血症病毒抗体的实验室检测能力验证结果评价 [J]. 中国实验动物学报, 2016, 24 (2): 188-190,198.
[6] 邢进, 冯育芳, 王洪, 等. 实验动物中绿脓杆菌检测能力验证的结果与分析 [J]. 中国药事, 2014, 28(9): 986-989.
[7] 冯育芳, 邢进,付瑞, 等. 实验动物金黄色葡萄球菌的实验室检测能力验证结果评价 [J]. 中国实验动物学报, 2016, 24(2): 195-198.
[8] 邢进, 冯育芳, 王洪, 等. 实验动物中沙门菌的实验室检测能力验证的结果与分析 [J]. 中国实验动物学报, 2016, 24(2): 191-194.
[9] 王洪, 魏杰, 李芳芳, 等. 实验动物质检机构碱性磷酸酶-1测定能力验证评价 [J]. 中国药事, 2014, 28(12): 1339-1341.
[10] 魏杰, 王洪, 李芳芳, 等. 实验室能力验证用酯酶-3标准样品的均匀性和稳定性研究 [J].中国药事, 2014, 28(9): 990-994.
[11] GB/T 14922.2-2011,实验动物微生物学等级及监测[S].
[12] CNAS-CL03,能力验证提供者认可准则[S].
[13] CNAS-GL03,能力验证样品均匀性和稳定性评价指南[S].

