雄激素对小鼠睾丸支持细胞Akt和MEK/Erk磷酸化水平的影响
毛登启, 邓 琼, 张建文, 植 凡,王 瑞, 张 颖, 方 维, 王宏亮, 梁 辉
(深圳市龙华区人民医院 泌尿外科,深圳 518109)
引 言
雄激素及其受体(Androgen receptor,AR)对精子发生和维持男性生育力具有非常重要的作用[1]。大鼠睾丸中睾酮的浓度为200~300nM,当睾酮浓度低于70nM时,精子发生无法正常进行[2]。缺少雄激素或者AR,会导致男性的生殖力受损,包括无法形成血睾屏障,精母细胞发育停滞在减数分裂前期,未成熟的精细胞从支持细胞解离,成熟的精子无法释放等[3]。睾丸组织不同细胞类型的条件性Ar基因敲除小鼠表现为不同程度的生精障碍。睾丸支持细胞选择性Ar基因敲除(SCARKO)小鼠和全身性Ar基因敲除(ARKO)小鼠,其生精过程分别停滞在减数分裂前期的粗线期和细线期[4],曲精细管内的生殖细胞中AR并不具有相应的功能作用[5]。这些研究数据表明,雄激素主要通过睾丸支持细胞中的AR调控精子发生的过程。
雄激素可以经典途径和非经典途径两种作用方式调控睾丸支持细胞内的基因转录水平以及代谢。经典途径是指细胞外的雄激素进入细胞内,与受体结合,复合体转移至细胞核,与雄激素反应元件(Androgen response element,ARE)结合调控基因的表达,然而,经典途径的效应涉及靶基因转录水平的改变及新的效应蛋白的合成和分泌,往往需要数个小时[6]。在睾丸支持细胞中,至少存在两条非经典途径:第一条是雄激素刺激导致Ca2+内流,引起Ca2+震荡,进而触发一系列细胞生理活动的改变,包括激活PKA和PKC等。在分离的睾丸支持细胞给予睾酮刺激,20~40秒内可观察到Ca2+内流现象[7]。第二条是与膜上的受体结合,快速触发一系列的磷酸化反应,最终引起cAMP反应元件结合蛋白转录因子的磷酸化,引起调控基因转录的激活或抑制[3]。有研究报道,雄激素的非经典途径可通过调节支持细胞和生殖细胞的粘附维持正常的精子发生[3]。有证据表明,AR与细胞膜上的脂筏(Lipid rafts)结合,促进激活AR信号通路[8],AR可能直接定位于细胞膜或者与膜上脂质双层结构中富含鞘脂,Caveolins,Src家族激酶,G蛋白和信号调节子的脂筏结合[9],细胞膜上的AR介导双氢睾酮(Dihydrotestosterone,DHT)诱导的PI3K/Akt,Ras/Raf和PKC通路的激活[8]。
本研究从小鼠睾丸中分离支持细胞原代培养,采用磷酸化抗体芯片寻找睾酮激活的信号通路,进一步在小鼠睾丸支持细胞系TM4细胞中验证芯片分析结果。本研究将进一步丰富睾丸支持细胞中雄激素/AR信号通路,为精子发生障碍引起的男性不育的临床诊断和治疗提供参考。
1 材料与方法
1.1 动物及试剂
C57BL/6J小鼠购自广东省医学实验动物中心,细胞分离培养用的胶原酶(C5138)、Deoxyribonuclease Ⅰ(DnaseⅠ,DN25)、透明质酸酶(H3506)及胰蛋白酶(T1426)购自Sigma-Aldrich,细胞培养用的培养基DMEM、F12(1:1)、双抗和胎牛血清均购自Gibco,支持细胞的标记物为Sox-9抗体(AB5355,Millipore),Hochest 33342(1:2000)购自Invitrogen。所有的动物实验经动物伦理委员会批准。EGFR、Akt、RTK及胞内信号通路蛋白磷酸化抗体芯片购自于CST(Cell Signaling Technology,USA)。实验中所用到的抗体其他抗体均来源于CST,均为兔源,且使用时按1:1000稀释,包括:Phospho-Akt(位点Ser473,货号4058),Akt(货号4685),Phospho-Erk1/2(位点Thr202/Tyr204,货号4370),Erk1/2(货号4695),Phospho-MEK1/2(位点Ser217/221,货号9154),MEK1/2(货号8727),Phospho-GSK-3α/β(位点Ser21/9,货号8566),GSK-3α/β(货号5676),Phospho-p70 S6 Kinase(位点Thr421/Ser424,货号9204),p70 S6 Kinase(货号2708)。
1.2 小鼠睾丸支持细胞的原代培养
方法如文献[10]所示,无菌条件下取出6~8周的健康雄鼠睾丸组织,剥离白膜后以5~10ml的PBS洗涤3次,加入37℃预热的消化液1(0.1%胶原酶和DnaseⅠ),水浴锅中震荡(37℃,60rpm)消化20min,静置1min,待组织缓慢沉降后弃上清,用冷的PBS洗涤3次。加消化液2(0.1%胶原酶,0.1%透明质酸酶和DnaseⅠ),水浴锅中震荡消化10min。500rpm离心1min,弃上清,加PBS清洗,重复3遍。加37℃预热的消化液3(含0.1%胶原酶,0.1%透明质酸酶,0.25%胰蛋白酶和DnaseⅠ),37℃水浴锅中震荡(60rpm)消化20min。加入与细胞悬液等量的细胞完全培养液终止消化,移液器轻轻吹打细胞悬液至单个细胞,将细胞悬液以40μm滤器(Corning)过滤,1000rpm离心3min,弃上清。重悬细胞,转入培养箱(37℃、5%CO2)培养。
1.3 蛋白免疫印迹
蛋白提取试剂盒(Pierce)提取总蛋白。BCA法测定样品浓度,并调整浓度为1μg/μL,加入5×SDS蛋白上样缓冲液,98℃蛋白变性5min。10%SDS聚丙烯酰胺凝胶电泳、转膜、5%脱脂牛奶封闭1h,加一抗4℃孵育过夜。TBST洗3遍,每次5min。室温孵育二抗1h,TBST洗3遍,每次5nin,ECL发光液孵育。用凝胶成像系统(Tanon-5520)拍照保存。蛋白的表达是采用软件ImageJ,对曝光的目的蛋白条带测定的数值,以持家蛋白条带数值为校准,计算得到的相对表达水平。
1.4 细胞培养及处理
小鼠睾丸支持细胞系TM4细胞购自ATCC,TM4细胞及原代培养的支持细胞的培养条件均为DMEM高糖培养基,添加10%FBS、100IU/ml青霉素及100IU/ml链霉素。原代细胞或TM4细胞培养的汇合度达60%-70%时,换含剥离血清的培养基孵育过夜;次日,换含0.1%BSA无血清培养液继续孵育6h。Flutamide给药实验中,需提前与细胞共孵育6h,即在0.1%BSA中添加,并孵育6h。10nM睾酮(大连美仑生物)给药刺激。
1.5 细胞免疫荧光
爬片的原代睾丸支持细胞稳定培养7天,弃培养基,PBS洗2次后甲醇-20℃固定30min。PBS洗1次,0.1%TritonX-100打孔10min。PBS洗两次后,以10%BSA室温封闭60min,兔IgG(阴性对照)或兔源一抗4℃孵育过夜(Sox-9,1:100)。加PBS(PBS加0.05%Trixon-100)洗3次,每次5min;加荧光二抗(羊抗兔IgG,1:500)室温孵育2h;加Hochest33342继续孵育10min;最后,PBST洗3次,每次10min;以防淬灭剂封片;荧光显微镜拍照。
1.6 数据分析
采用SigmaPlot进行数据统计分析。数据以平均值±标准误差表示,差异性检验采用t检验或One/Two way ANOVA分析,后以Fisher配对检验。P<0.05设置为差异有显著性。
2 实验结果
2.1 小鼠睾丸支持细胞培养体系的建立
采用三步酶消化分离法,成功建立并优化了小鼠睾丸支持细胞的分离和培养方法。如图1所示,A~F分别表示小鼠睾丸支持细胞分离培养1~6天生长和贴壁情况。第1天(图1A),部分支持细胞开始贴壁生长,精细胞则仍悬浮生长;第2天(图1B),换液后,大部分的精细胞被分离出去,更多的支持细胞贴壁生长;其后3~6天(图1C~1F),支持细胞开始增殖,图片显示支持细胞生长状态良好;第6天,取部分细胞进行鉴定,如图1H~1G显示,分离的支持细胞的纯度超过95%。
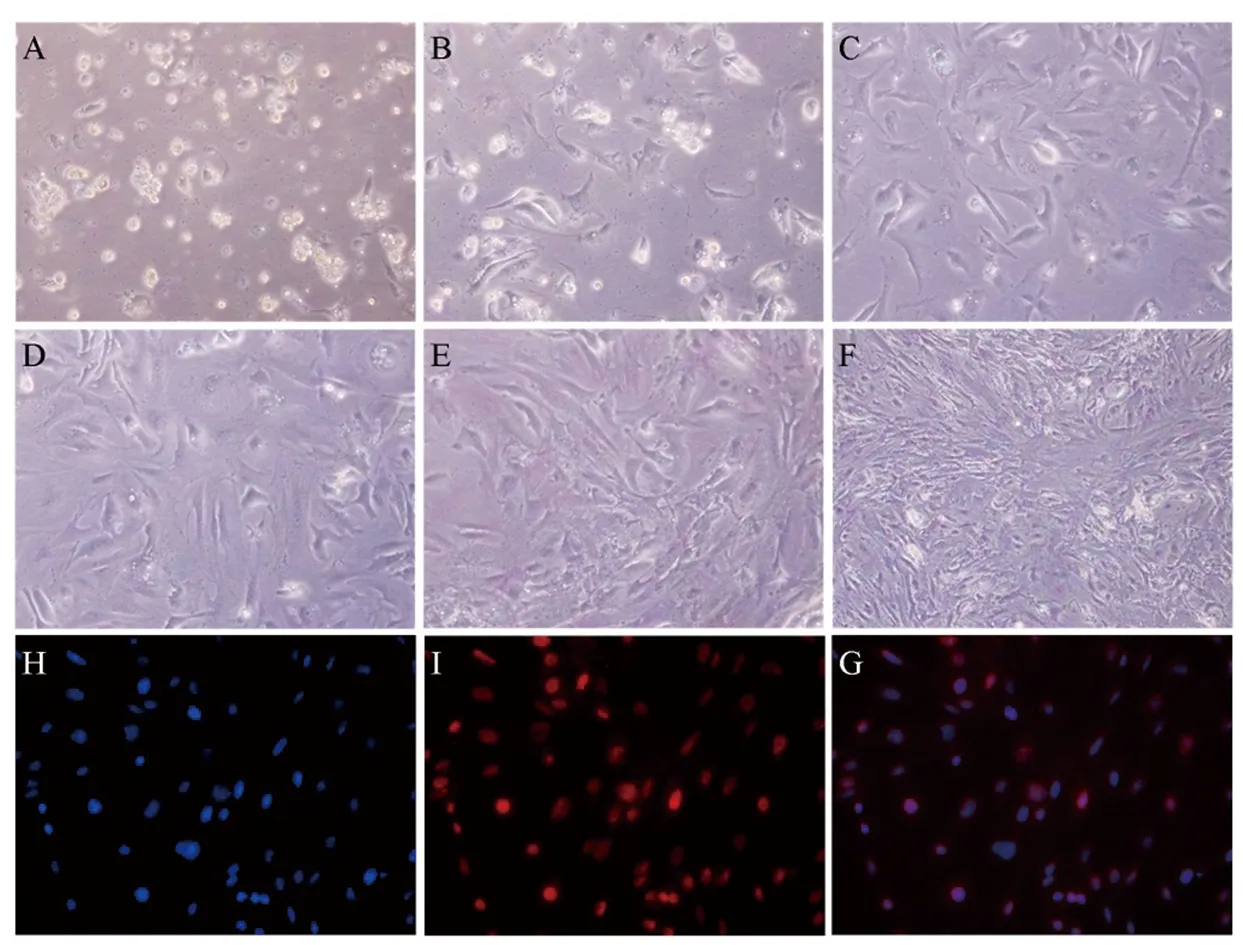
图1 小鼠睾丸支持细胞的培养与鉴定
2.2 磷酸化抗体芯片显示睾酮刺激迅速促进Akt和MEK/Erk磷酸化

图2 睾酮快速促进支持细胞激酶的磷酸化A:磷酸化抗体芯片结果显示,睾酮刺激快速诱导MEK/Erk及Akt激酶的磷酸化;B:蛋白免疫印迹验证芯片分析结果。Figure 2 Testosterone induces fast phosphorylation of the kinases in Sertoli cellsA:Results from phosphorylation signaling pathway antibody array showed that testosterone induces fast phosphorylation of kinase MEK/Erk and Akt.B:Results of the arrays were verified by Western blot
原代睾丸支持细胞稳定贴壁培养,长满培养板60%~70%时,含剥离血清的培养基培养过夜;10nM睾酮刺激后,提取细胞总蛋白。磷酸化抗体芯片结果显示(图2A),睾酮刺激5min后,MEK/Erk和Akt等位点的磷酸化水平快速升高,其后,开始下降并逐渐恢复至生理水平。其中,Akt信号通路下游多个位点也出现了快速磷酸化,如GSK-3以及p70S6激酶的磷酸化水平在睾酮刺激下迅速升高。我们采用小鼠睾丸支持细胞系TM4细胞进一步验证芯片分析结果,蛋白免疫印迹结果显示(图2B),与芯片分析结果一致,MEK/Erk和Akt激酶磷酸化水平在睾酮刺激下迅速升高。
2.3 MEK/Erk和Akt磷酸化的快速激活由AR介导
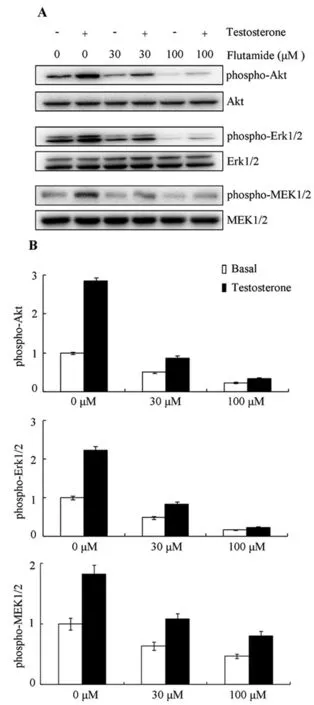
图3 AR介导Akt和MEK/Erk的快速磷酸化A:Flutamide对MEK/Erk和Akt磷酸化的影响;B:多个实验的数据统计结果(n=3)Figure 3 Fast phosphorylation of MEK/Erk and Akt were mediated by AR.A,The representative Western blot images showed the effect of flutamide on the phosphorylation of MEK/Erk and Akt.B,Statistic analysis of the data collected from several experiments(n=3)
为进一步确定Akt及MEK/Erk磷酸化快速激活是否由AR介导,TM4细胞以AR拮抗剂Flutamide孵育。TM4细胞以含剥离血清的培养基培养过夜,次日,更换以含Flutamide或DMSO的0.1%BSA孵育6h,10nM睾酮刺激5min,提取细胞总蛋白。蛋白免疫印迹显示(图3A),30μM和100μM的Flutamide不仅降低了对照组TM4细胞中Akt和MEK/Erk的磷酸化水平,也抑制了睾酮刺激诱导的Akt和MEK/Erk磷酸化水平的升高。多个重复实验的统计结果也表明Flutamide抑制了由睾酮刺激诱导的激酶磷酸化水平的升高(图3B)。
3 讨 论
精子发生是一个复杂而有序的生理过程,可以分为精原细胞有丝分裂、精母细胞减数分裂和精子形成三个阶段[11]。精子发生障碍会导致男性不育或精子活力降低,数据统计显示,男性不育人数呈逐年上升趋势,男性精液质量下降,男性生殖健康已成为社会关注的重要问题。世界卫生组织已将不孕不育症列为仅次于肿瘤和心脑血管的第三大疾病[12]。研究男性不育症的发病机理,寻找有效的诊断和治疗方法是当今生殖医学工作者的研究导向。大量的临床与实验研究资料表明,雄激素及其受体(AR)在精子发生过程中发挥重要作用[1]。
通过蛋白磷酸化抗体芯片,我们发现睾酮能快速诱导睾丸支持细胞中的Akt和MEK/Erk磷酸化。有研究表明,DHT介导的PI3K/Akt通路是AR依赖的[13],AR与PI3K的p85α调节亚基直接结合,激活PI3K/Akt通路[8]。Akt活化后,激活mTOR-Raptor复合体,进一步磷酸化下游靶标,4E-BP1和S6激酶等[14]。PI3K/Akt通路活化后,激活下游的mTOR,触发MAPK/Erk磷酸化级联反应,这一信号通路受PTEN调控。PTEN是一种蛋白磷酸酶,导致PIP3去磷酸化,从而抑制PI3K诱导的Akt活化[15,16]。
DHT刺激AR依赖的前列腺癌细胞,Erk磷酸化水平呈剂量依赖的方式在5min内显著升高。AR拮抗剂Casdex和Flutamide处理,不影响Erk的磷酸化[17]。Erk激酶的活性与血睾屏障的维持有关[18],AR一方面可以通过表皮生长因子受体(EGFR)途径,激活Ras/Raf,促进MEK磷酸化,活化Erk;另一方面,AR还可以通过PKC调节MAPK/Erk通路[17,19]。同时,PI3K/Akt也可在PTEN调节下,引起MAPK/Erk通路的活化[15]。
有研究指出,AR的非经典途径对于精子发生过程中生殖细胞与支持细胞的黏附是必要的[3]。由于睾丸组织中睾酮的浓度远高于ARE转录调控所需要的水平,研究者在睾丸支持细胞中所鉴定的受雄激素调控的靶基因数目远远低于预期,且这些基因中只有一部分是通过ARE调控的,而在缺少AR或者AR的功能被抑制时,这些所鉴定的雄激素调控的基因中大部分的表达都是下调的。这些都将研究者的研究重点转向雄激素诱导激活的激酶信号通路[20],它们可以快速改变不依赖AR启动子作用或者不含ARE的基因的表达水平,并且具有时效快,效果显著的特点。
4 结 论
本研究通过对原代培养的睾丸支持细胞以睾酮刺激,采用蛋白磷酸化抗体芯片分析发现Akt和MEK/Erk快速磷酸化,进一步采用Western Blot技术,验证了芯片分析结果,同时,采用AR拮抗剂,验证支持细胞中Akt和MEK/Erk磷酸化的激活是由AR介导的。而支持细胞中睾酮诱导的AR-Akt和AR-MEK/Erk通路的相关蛋白的磷酸化以及二者在小鼠精子发生过程中的作用及其分子机制,仍需要进一步的深入研究。本研究进一步丰富了雄激素作用“非经典途径”的科学内涵,对于阐明精子发生的分子机制具有重要的学术意义,也将为生精障碍的诊断和治疗提供新的思路。
参考文献:
[1] WALKER W H.Testosterone signaling and the regulation of spermatogenesis [J].Spermatogenesis,2011,1(2):116-120.
[2] AWONIYI C A,SANTULLI R,SPRANDO R L,et al.Maintenance of advanced spermatogenic cells in the adult rat testis:quantitative relationship to testosterone concentration within the testis [J].Endocrinology,1989,124(6):3043-3049.
[3] WALKER W H.Non-classical action of testosterone and spermatogenesis [J].Phil Trans R Soc B,2010,365(1546):1557-1569.
[4] TSAI M Y,YEH S D,WANG R S,et al.Differential effects of spermatogenesis and fertility in mice lacking androgen receptor in individual testis cells [J].Proc Natl Acad Sci USA,2006,103(50):18975-18980.
[5] SAR M,LUBAHN D B,FRENCH F S,et al.Immunohistochemical localization of the androgen receptor in rat and human tissues [J].Endocrinology,1990,127(6):3180-3186.
[6] SHANG Y,MYERS M,BROWN M.Formation of the androgen receptor transcription complex [J].Mol Cell,2002,9(3):601-610.
[7] GORCZYNSKA E,HANDELSMAN D J.Androgens rapidly increase the cytosolic calcium concentration in Sertoli cells [J].Endocrinology,1995,136(5):2052-2059.
[8] LU M L,SCHNEIDER M C,ZHENG Y,et al.Caveolin-1 interacts with androgen receptor.A positive modulator of androgen receptor mediated transactivation [J].J Biol Chem,2001,276(16):13442-13451.
[9] SIMONS K,TOOMRE D.Lipid rafts and signal transduction [J].Nat Rev Mol Cell Biol,2000,1(1):31-39.
[10] 邓琼,吴勇,张增,等.小鼠睾丸支持细胞的分离培养[J].黑龙江畜牧兽医,2017,7(上):37-39+294-295.
[11] 孙燕,张家骅.哺乳动物精子体外发生[J].生理科学进展,2004,35(4):338-341.
[12] 马用信.生物钟与男性生殖研究进展[J].生命科学2015,27(11):1462-1468.
[13] SUN M,YANG L,FELDMAN R I,et al.Activation of phosphatidylinositol 3-kinase/Akt pathway by androgen through interaction of p85alpha,androgen receptor,and Src [J].J Biol Chem,2003,278(44):42992-43000.
[14] GUERTIN D A,SABATINI D M.Defining the role of mTOR in cancer [J].Cancer Cell,2007,12(1):9-22.
[15] VIVANCO I,SAWYERS C L.The phosphatidylinositol 3-Kinase Akt pathway in human cancer [J].Nat Rev Cancer,2002,2(7):489-501.
[16] YUAN T L,CANTLEY L C.PI3K pathway alterations in cancer:variations on a theme [J].Oncogene,2008,27(41):5497-5510.
[17] PETERZIEL H,MINK S,SCHONERT A,et al.Rapid signaling by androgen receptor in prostate cancer cells [J].Oncogene,1999,18(46):6322-6329.
[18] LI M W,MRUK D D,LEE W M,et al.Disruption of the blood-testis barrier integrity by bisphenol A in vitro:is this a suitable model for studying blood-testis barrier dynamics [J].Int J Biochem Cell Biol,2009;41(11):2302-2314.
[19] TOULLEC D,PIANETTI P,COSTE H,et al.The bisindolylmaleimide GF 109203X is a potent and selective inhibitor of protein kinase C [J].J Biol Chem,1991,266(24):15771-15781.
[20] RAHMAN F,CHRISTIAN H C.Non-classical actions of testosterone:an update [J].Trends Endocrinol Metab,2007,18(10):371-378.

