黄海小黄鱼不同组织中δ15N的分布特征及其生态学意义*
谭鲁玉 王玉堃 唐学玺 戴芳群,3 孙 耀,3① 金显仕,3
(1. 中国海洋大学海洋生命学院 青岛 266003;2. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;3. 农业部海洋渔业可持续发展重点实验室中国水产科学研究院黄海水产研究所 青岛 266071)
稳定同位素作为一种天然的示踪物质,在海洋生态系统研究中的应用受到愈来愈广泛的重视。其中,氮稳定同位素的比值(δ15N)在相邻营养级之间具有较高的富集系数,随着营养级的增加而逐渐升高,平均为 3.4‰,被用来反映消费者在食物网中的营养级位置(Post, 2002),再结合碳稳定同位素的比值(δ13C),已成为研究海洋生态系统食物网营养结构的重要方法。由于稳定同位素技术检测精准灵敏,可以解决传统胃含物分析法费时、费力等诸多问题,被广泛用于分析鱼类等水生生物的食物来源、食物的贡献比例、营养级的确定、食物网结构的构建及洄游迁移路线等生态学问题(李忠义等, 2005)。
近年来,随着研究的深入、稳定同位素技术日益成熟,对鱼类营养级位置的确定不再只局限于肌肉中δ15N值的分析,如王玉玉等(2014)发现,鳙(Aristichthy nobilis)和鲢(Hypophthalmichthys molitrix)的鳞片与肌肉中 δ15N值有强烈的线性关系,认为在研究鱼类营养位置时,可采用鱼鳞作为肌肉的替代组织。相关研究也表明,不同组织器官中的 δ15N值存在显著的相关性(Suzuki et al, 2005; 曾庆飞等, 2012)。因此,鱼鳞和耳石等不同组织器官中 δ15N值的探讨已成为热点,尤其是耳石作为一种研究鱼类生态学问题的材料,已经受到越来越多学者的关注,如耳石非细胞性和代谢惰性(Campana et al, 1985),使沉积在耳石中的生境元素能永久性保存,利用这一特性揭示某一生长阶段生境特征,应用于鱼类混合群体识别、洄游路径的判断、深海鱼深度的回推以及出生地溯源等(Gao et al, 2010; Thresher et al, 1994; Longmore et al,2011)。因此,希望通过本研究了解不同组织器官间δ15N值的差异,为今后鱼类食性分析和营养级确定的材料选取提供借鉴。
小黄鱼(Larimichthys polyactis)广泛分布于中国东海、黄海和渤海以及朝鲜半岛西岸海域,含有丰富的蛋白质和人体所需的多种营养成分,食用价值高,属广食性鱼类,其优势饵料类群为甲壳类和鱼类,是位于水层底栖营养层次中的关键鱼种(黄昊, 2010;单秀娟等, 2011);由于过度捕捞和环境恶化等因素的影响,小黄鱼产量逐年减少,其群体面临日益衰退之势(张国政等, 2010)。因此,本研究应用稳定同位素技术分析 δ15N在小黄鱼不同组织器官的分布特征,探讨鳞片、背鳍、鱼鳃、内脏和耳石与肌肉中的δ15N值的相关性,为今后选用何种组织器官作为研究材料提供建议,也为渔业资源的合理利用与海洋经济的可持续发展提供依据和参考。
1 材料与方法
1.1 样品采集及预处理
小黄鱼于2014年10月以拖网方式采自黄海中部海域(33°~34°30′N, 121°30′~124°30′E)。样品采集后置于-20℃保存、备用。随机选取20尾小黄鱼样品,对其分别采集了6种不同组织:肌肉、内脏、耳石、鱼鳃、背鳍和鳞片。小黄鱼样品取适量背部白肌,内脏团样品清除胃含物部分,剪取部分背鳍,蒸馏水洗去附着杂质,取出小黄鱼矢耳石,去除表面附着组织,置于30%双氧水中清洗,以去除残余附着有机组织,蒸馏水冲洗后烘干备用。取小黄鱼样品侧线附近鳞片,蒸馏水浸泡,显微镜下以软刷去除附着黏液后,使用蒸馏水冲洗数遍。所取材料均置于烘箱 60℃烘干,肌肉、内脏、耳石和鱼鳃组织于玛瑙研钵中磨成粉末备用,鱼鳍和鱼鳞组织用无菌剪刀剪碎至均一接近粉状备用。
1.2 同位素分析
所有样品的测定在中国农业科学院环境稳定同位素实验室完成。称取2~4 mg样品放入锡箔杯中,通过自动进样器进入元素分析仪(Vario PYRO cube,德国Elementar公司),通过燃烧与还原转化为纯净的N2气体,进入稳定同位素质谱仪(IsoPrime100, 英国Isoprime公司)进行检测。氮稳定同位素组成用国际通用的δ值表示,按以下公式计算:
δ15N(‰) = (δ15N 样品-δ15N 标准)/δ15N 标准×1000
实验室采用 IAEA N1(δ15Nair=0.4‰)标定钢瓶 N2参考气,用 IAEA N1和USGS43(δ14Nair=8.44‰)对测定结果进行校正。
1.3 数据处理
分别测定小黄鱼不同组织器官中的 δ15N值,应用SPSS Statistics 21软件对小黄鱼的δ15N值进行单因素方差(One-way ANOVA)分析,LSD多重比较和Pearson相关性分析。
2 结果与分析
2.1 小黄鱼不同组织器官中δ15N值的分布特征
从表1可以看出,小黄鱼体长范围为66~144 mm,平均值为 106 mm;肌肉中 δ15N 值范围为 8.73‰~12.36‰,平均值为(10.72±1.02)‰;耳石中δ15N值范围为5.75‰~9.04‰,平均值为(7.08±0.91)‰;内脏中δ15N 值范围为 8.00‰~11.44‰,平均值为(10.36±1.04)‰;鱼鳃中δ15N值范围为8.33‰~11.78‰,平均值为(10.29±0.98)‰;背鳍中 δ15N 值范围为 8.65‰~11.98‰,平均值为(10.53±0.95)‰;鳞片中δ15N值范围为 9.01‰~12.18‰,平均值为(10.59±0.88)‰。从显著性差异来看,耳石中的 δ15N值极显著低于其他组织器官(P<0.01),而其他组织器官间δ15N值不存在显著差异(P>0.05)(表 2)。
从图1可以看出,小黄鱼不同个体同一组织器官的δ15N值不同;同一个体不同组织器官的δ15N值也不同。其中,耳石中的 δ15N值显著低于其他组织器官,其他组织器官中 δ15N值相差较小;且不同个体中δ15N值具有一定波动性。
2.2 小黄鱼不同组织器官中δ15N值的相关性
从图2可以看出,对小黄鱼不同组织器官的δ15N值构建线性模型。结果显示,肌肉中的 δ15N值与其他组织器官中的 δ15N值呈正相关性。除耳石外,肌肉与其他组织器官的δ15N值均存在显著的线性关系,其 R2>0.741(表 3)。
从表4可以看出,小黄鱼耳石中的δ15N值与体长的相关性不显著(P>0.05),其 Pearson相关系数为0.295;肌肉、内脏、鱼鳃、背鳍和鳞片中的δ15N值与体长存在极显著正相关性(P<0.01),其 Pearson相关系数分别为0.625、0.792、0.677、0.613和0.571。从组织器官来看,耳石和内脏中的 δ15N值存在显著正相关性(P<0.05);其他组织器官的δ15N值均存在极显著正相关性(P<0.01)。

表1 小黄鱼体长和不同组织器官中δ15N的值(n=20)Tab.1 The length and δ15N value of different tissues of L. polyactis (n=20)

表2 小黄鱼不同组织器官的δ15N值的差异(n=20)Tab.2 The differences of δ15N value among different tissues of L. polyactis(n=20)

图1 小黄鱼肌肉、鳞片、背鳍、鱼鳃、耳石和内脏中δ15N的分布Fig.1 The distribution of δ15N value of different tissues of L.polyactis

图2 小黄鱼耳石、内脏、鱼鳃、背鳍、鳞片与肌肉δ15N线性模型Fig.2 Linear models of δ15N in otolith and muscle, viscera and muscle, gill and muscle, fin and muscle, scale and muscle

表3 小黄鱼肌肉中δ15N值与其他组织器官中δ15N的相关性Tab.3 Correlation of δ15N values between muscle and different tissues of L. polyactis
3 讨论
应用稳定同位素技术分析黄海小黄鱼不同组织器官的 δ15N值。结果显示,不同个体同种组织器官的δ15N值不同,同一个体不同组织器官的δ15N值也不同。研究表明,鱼体中 δ15N值主要受蛋白质的含量和类别影响(Ballantyne et al, 2001),而不同组织器官的营养成分和结构不同,因此,很大程度上导致δ15N值在不同组织器官间的差异。而针对小黄鱼个体的耳石与其他组织器官的 δ15N值存在明显差异,可能是由于耳石组成成分与其他组织器官不同,耳石主要由碳酸钙盐结晶形成,无机矿物质含量占整个耳石的95%以上(Dilly et al, 1976; Radtke et al, 1983),耳石中有机物含量相对较低,蛋白质只占整个耳石的3%(高永华等, 2009),因此,耳石中的δ15N值显著低于其他组织结构。本研究中,小黄鱼其他组织器官δ15N 值的大小顺序为肌肉>鳞片>背鳍>内脏>鱼鳃,结果与Suzuki等(2005)、刘保占(2013)研究结果相吻合。造成其他组织器官间 δ15N值的差异,可能是由于同一生物的不同组织器官对物质的周转率不同,导致同位素在生物体内存在一定的分馏现象(Rounick et al, 1986; Post, 1976)。因此,通过对小黄鱼不同组织器官 δ15N值的组成和差异的研究,希望为以后更深入研究同属种鱼类不同组织器官的稳定同位素值提供借鉴。
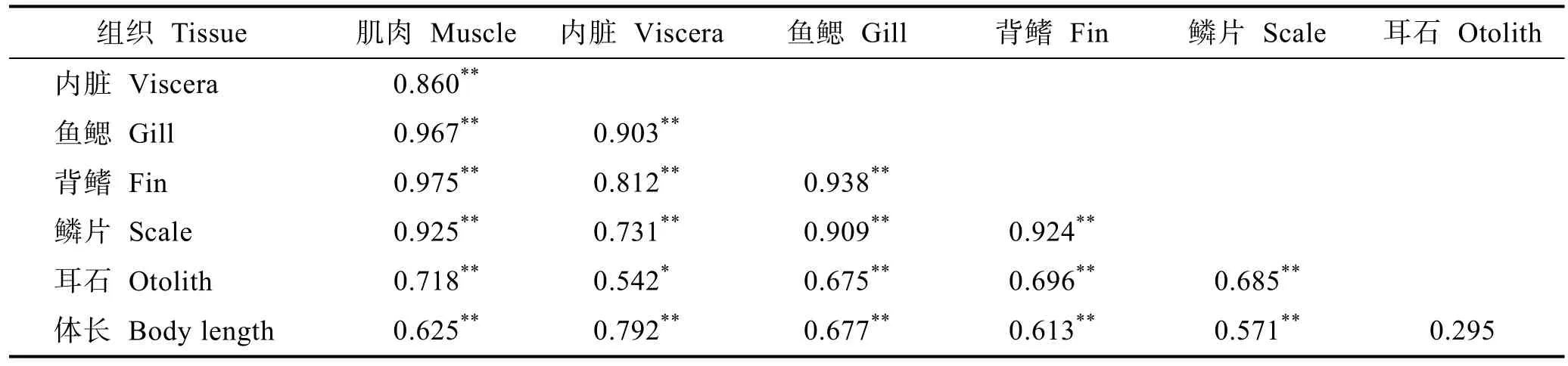
表4 小黄鱼组织器官δ15N值及体长的Pearson相关系数矩阵Tab.4 Pearson correlation coefficient of tissues and organs δ15N values of L.polyactis and their body length
从资源保护和生物可持续利用的因素角度考虑,分析其他组织器官 δ15N值的有效性具有重要意义。相关研究表明,不同组织器官与肌肉中 δ15N值相关性较高,北美和欧洲多种淡水鱼及海水鱼通过简单回归模型,已经采用其组织器官中的 δ15N值估算肌肉组织稳定同位素含量(Kelly et al, 2006; Fincel et al,2012; Blanco et al, 2009; Sinnatamby et al, 2008)。结合本研究的结果,小黄鱼不同组织器官与肌肉 δ15N值的相关性较好,可以尝试耳石、鳞片和鱼鳍等组织作为研究材料,其原因是鳞片和鱼鳍适合活体采样,采样成本低,可操作性强;耳石、鳞片和鱼鳍样品只需常温保存,而且保存时间长;且鱼鳞和耳石性质稳定,一旦长成,其成分和结构不再变化。因此,使用鱼鳞等非致命组织作为稳定同位素分析的替代物,不会影响种群数量,特别适用于濒危物种,且允许长时间监测鱼类食性变化和营养级的确定。
本研究中,小黄鱼耳石和肌肉间的 δ15N值相关性较好,耳石中的 δ15N值可以反映鱼类食性和营养级位置。Post(2002)研究表明,耳石中的δ15N值在相邻营养级之间,沿着食物链以2.56‰数级逐级递增。在生物营养级研究方面,Vandermyde等(2008)比较鱼类耳石和肌肉中的δ15N值发现,耳石中的δ15N值低于肌肉 1.1‰,Delong等(2009)研究发现,无脊椎动物中贝壳的δ15N值低于软体组织(2.3~2.5)‰。而本研究中,小黄鱼耳石中的 δ15N值低于肌肉 3.64‰,其结果与其他研究结果一致,即耳石中的 δ15N值低于肌肉。随着鱼体的生长,肌肉不断的更新和修复为鱼类生长提供能量,只能提供捕获时的食性信息,而耳石生长过程中形成的日轮结构和化学组成相当稳定,记录着鱼类整个生命历程的食性信息,利用耳石中的 δ15N值分析鱼类不同时期摄食水平,反演个体不同生长阶段的营养位置;其次结合历史和现代耳石中的 δ15N值重建鱼类营养级和食物网结构,了解鱼类生态系统群落结构的变化,探讨海洋生态系统营养动力学的变动,为渔业的保护和可持续利用提供科学依据。
稳定同位素技术已经广泛应用于研究鱼类食性、营养级位置以及食物网能量流动路径等问题,已经成为海洋生态系统营养动力学研究的重要手段之一。本研究对小黄鱼不同组织器官中 δ15N值的分析,揭示了 δ15N值在不同组织器官的分布特征及相关性,为未来稳定同位素技术在鱼类生态学研究的发展提供了思路和基础依据。
Ballantyne JS. Amino acid metabolism in Nitrogen excretion.San Diego: Academic Press, Calif, 2001, 77–107
Blanco A, Deuder OS, Box A. Muscle and scale isotopic offset of three fish species in the Mediterranean Sea: Dentex dentex,Argyrosomus regius and Xyrichtys novacula. Rapid Communications in Mass Spectrometry, 2009, 23(15):2321–2328
Campana SE, Neilson JD. Microstructure of fish otoliths. Journal Canadien Des Sciences Halieutiques et Aquatiques, 1985,42(5): 1014–1032
Delong MD, Thorp JH. Mollusc shell periostracum as an alternative to tissue in isotopic studies. Limnology and Oceanography Methods, 2009, 7(1): 436–441
Dilly PN. The structure of some cephalopod tatoliths. Cell and Tissue Research, 1976, 175(2): 147–163 Fincel MJ, Vandehey JA, Chipps SR. Non-lethal sampling of walleye for stable isotope analysis: A comparison of three tissues. Fisheries Management and Ecology, 2012, 19(4):283–292
Gao Y, Dettman DL, Piner KP, et al. Isotopic correlation (δO versus δC) of otolith in identification of groundfish stocks.Transactions of the American Fisheries Society, 2010,139(2): 491–501
Gao YH, Li Z, Qiao L, et al. Raman and FTIR characteristics of otolith of ornamental carp. Spectroscopy and Spectral Analysis, 2009, 29(10): 2689–2693 [高永华, 李卓, 乔莉,等. 鲤鱼耳石的拉曼及红外光谱特征研究. 光谱学与光谱分析, 2009, 29(10): 2689–2693]
Huang H. Recent progress and prospect of small Yellow croaker(Pseudosciaena polyactis Bleeker). Modern Fisheries Information, 2010, 129(9): 10–12 [黄昊. 小黄鱼生物学研究进展. 现代渔业信息, 2010, 129(9): 10–12]
Kelly MH, Hagar WG, Jardine TD et al. Nonlethal sampling of sunfish and slimy sculpin for stable isotope analysis: How scale and fin tissue compare with muscle tissue. North American Journal of Fisheries Management, 2006, 26(4): 921–925
Li ZY, Jin XS, Zhuang ZM, et al.Applications of stable isotope techniques in aquatic ecological studies. Acta Ecologica Sinica, 2005, 25(11): 3053–3060 [李忠义, 金显仕, 庄志猛,等. 稳定同位素技术在水域生态系统研究中的应用. 生态学报, 2005, 25(11): 3053–3060]
Liu BZ. The studies on the food web structures of Northern China Sea by stable isotopes analysis. Doctoral Dissertation of Dalian Maritime University, 2013, 1–126 [刘保占. 基于稳定同位素组成分析中国北方海域食物网结构研究. 大连海事大学博士研究生学位论文, 2013, 1–126]
Longmore C, Trueman CN, Neat F, et al. Otolith geochemistry indicates life-long spatial population structuring in a deep-sea fish, Coryphaenoides rupestris. Marine Ecology Progress Series, 2011, 435(8): 209–24
Post DM. Using stable isotopes to estimate trophic position:Models, methods, and assumptions. Ecology, 2002, 83(3):703–718
Radtke RL. Chemical and structural characteristic of statoliths from the short finned squid Illex illecebrosus. Marine Biology, 1983, 76(1): 47–54
Rounick JS, Winterbourn MJ. Stable carbon isotopes and carbon flow in ecosystems. Bioscience, 1986, 36: 171–177
Shan XJ, Li ZL, Dai FQ, et al. Seasonal and annual variations in biological characteristics of small yellow croaker Larimichthys polyactis in the central and southern Yellow Sea. Progress in Fishery Sciences, 2011, 32(6): 7–16 [单秀娟, 李忠炉, 戴芳群, 等. 黄海中南部小黄鱼种群生物学特征的季节变化和年际变化. 渔业科学进展, 2011, 32(6): 7–16
Sinnatamby RN, Dempson JB, Power M. A comparison of muscle and scale derived δ13C and δ15N across three life history stages of Atlantic salmon, salmo salar. Rapid Communications in Mass Spectrometry, 2008, 22(18): 2773–2778
Thresher RE, Proctor CH, Gunn JS, et al. An evaluation of electron probe microanalysis of otoliths for stock delineation and identification of nursery areas in a southern temperate groundfish, Nemadactylus macropterus (Cheilodactylidae).Fish Bull, 1994, 92(4): 817–840
Suzuki KW, Kasai A, Nakayama K et al. Differential isotopic enrichment and half-life among tissues in Japanese temperate bass (Lateolabrax japonicus) juveniles: Implications for analyzing migration. Canadian Journal of Fisheries and Aquatic Sciences, 2005, 62(3): 671–678
Vandermyde JM, Whitledge GW. Otolith delta N-15 distinguishes fish from forested and agricultural streams in southern Illinois.Journal of Freshwater Ecology, 2008, 23(2): 333–336
Wang YY, Xu J, Lei CG. Scale tissue of bighead carp and silver carp as nonlethal surrogates for muscle tissues in freshwater food web studies using stable isotopes. Lake Science, 2014,26(6): 853–856 [王玉玉, 徐军, 雷春光. 鳙、鲢鱼鳞作为稳定同位素研究非致命采样替代物的有效性. 湖泊科学,2014, 26(6): 853–856]
Zeng QF, Gu XH, Mao ZG, et al. Effect of diet switch on turnover rates of tissue nitrogen stable isotopes in fish based on the enrichment-dilution approach. Acta Ecologica Sinica,2012, 32(4): 1257–1263 [曾庆飞, 谷孝鸿, 毛志刚, 等. 同位素富集–稀释法研究食性转变对鱼类不同组织 N同位素转化率的影响. 生态学报, 2012, 32(4): 1257–1263]
Zhang GZ, Li XS, Jin XS, et al. Changes of biological characteristics of small yellow croaker (Larimichthys polyactis) in the central and southern Yellow Sea. Acta Ecologica Sinica, 2010, 30(24): 6854–6861 [张国政, 李森,金显仕, 等. 黄海中南部小黄鱼生物学特征的变化. 生态学报, 2010, 30(24): 6854–6861]

