牙鲆抗迟缓爱德华氏菌病家系的继代选育与早期速生家系筛选*
李泽宇 陈松林 郭 华 王 磊 王 倩 李仰真杨英明 刘寿堂 孙德强 李文升 王晓梅
(1. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;2. 上海海洋大学水产与生命学院 上海 201306;3. 山东海阳市黄海水产有限公司 烟台 265100;4. 山东莱州明波水产有限公司 烟台 261418)
牙鲆(Paralichthys olivaceus)是我国北方沿海地区重要的海水养殖鱼类之一。近年来,牙鲆的大规模工厂化养殖发展迅速,高密度的工厂化养殖和长期的近亲交配导致牙鲆种质退化、病害频发、产量下降,严重妨碍了牙鲆养殖业的可持续发展(王志敏等, 2005;司飞等, 2017)。
迟缓爱德华氏菌病是由迟缓爱德华氏菌(Edwardsiella tarda)引起的水生动物疾病(陈爱平等,2011),俗称腹水病。该病具有感染率高、感染后死亡迅速、患病前期不易被发现等特点,25℃~30℃水温时该病最易发生。迟缓爱德华氏菌主要通过鱼类消化道、表皮受伤破损处、鳃进入鱼体,也可通过接触患病鱼体、摄入携带迟缓爱德华氏菌的食物或生物饵料而相互感染(陈爱平等, 2011)。李宁求等(2012)对爱德华氏菌菌蜕制备条件进行了优化,为鳗源迟缓爱德华氏菌病疫苗开发奠定了基础。陈昌福等(1998)对从日本鳗鲡(Anguilla japonica)分离出的迟缓爱德华氏菌进行致病力测试,注射菌液后的发病症状与自然发病的日本鳗鲡症状相同。
陈松林等(2008)、徐田军等(2010)、王磊等(2013)分别于2007、2009及2012年建立了大量牙鲆家系,通过鳗弧菌(Vibrio anguillarum)感染实验,已经选育出牙鲆抗鳗弧菌家系。陈松林等(2011)自2003年起,对中国牙鲆进行人工感染鳗弧菌,选育出中国本地的抗病群体,然后将中国本地的抗病群体与日本引进的牙鲆群体杂交,获得养殖成活率高、生长较快的群体,将其作为母本,以韩国引进牙鲆的选育群体作为父本进行杂交得到的三杂交后代,育成了牙鲆“鲆优1号”新品种。张英平等(2014)、孙何军等(2015)和郑卫卫等(2016)分别利用迟缓爱德华氏菌对牙鲆家系进行攻毒感染,筛选出了一些抗迟缓爱德华氏菌家系,为培育抗迟缓爱德华氏菌牙鲆新品种奠定基础。齐文山等(2014)研究表明,冷冻保存的异源精子可以诱导建立牙鲆卵裂雌核纯系,有助于构建牙鲆优良纯系。侯吉伦等(2014)以牙鲆两代雌核发育的个体为亲本,再度诱导雌核发育,获得三代雌核发育后代,结果显示,雌核发育后代个体的纯合度、平均遗传相似度进一步提高。
本研究主要通过家系选育方法,以2007、2009、2014年选育出的抗病牙鲆家系为亲本,于2016年培育出28个牙鲆家系,从中筛选出抗病速生牙鲆家系,并对这些家系进行了抗迟缓爱德华氏菌感染能力测试和比较分析。
1 材料与方法
1.1 牙鲆家系的建立
亲鱼来源包括:日本牙鲆,韩国牙鲆,2009、2010、2012、2013及 2014年牙鲆家系。2016年 4月开始进行2016年抗迟缓爱德华氏菌牙鲆家系的培育。本次家系建立共使用雌鱼25尾,来自于16个不同家系;雄鱼27尾,来自于10个不同家系。家系命名规则参照王磊等(2013),即F(family)+家系建立年份+家系编号。
1.2 鱼苗早期生长性能测定
2016年7月15日~9月15日,在山东莱州明波水产有限公司进行牙鲆家系生长性能测定实验,测定方法参照田永胜等(2009)。2016年7月15日,将鱼苗(69~90日龄)分别饲养在水体积为2.5 m3的圆形玻璃钢养殖桶中,每组300尾。实验期间,对鱼苗进行饱食投喂,流水养殖,保持水温 22℃,24 h光照。60 d后,从所有牙鲆家系中各随机选取50尾鱼苗进行生长测量。测量指标主要为全长(从吻端到尾鳍末端)和体重。
1.3 抗病性能测定
通过预实验确定半致死浓度,再从每个家系中选取100尾牙鲆鱼苗(169~186日龄),采用腹腔注射半致死浓度的菌液,注射剂量与预实验相同,并用PBS注射作对照组。攻毒感染实验的水温为(22±1)℃,注射后,每隔6 h检查并取样,及时清理死鱼,记录每条鱼的死亡时间、家系号,测量死鱼的全长、体重。感染后12 d,统计每个家系的存活鱼苗数量,测量其全长和体重。
1.4 数据处理
用 SPSS 19.0软件计算各家系的平均全长和体重,统计死亡与存活鱼苗数量,计算各个家系的存活率及各表型的相关性。
2 结果与分析
2.1 牙鲆家系的建立
本研究于2016年成功建立和培育了28个牙鲆家系,包括F3代家系4个、F4代家系23个和对照家系1个(表1)。对照家系来自山东海阳黄海水产有限公司同时期繁育的普通牙鲆鱼苗。亲鱼培育、苗种繁育参照陈松林等(2008)。
2.2 28个牙鲆家系的鱼苗早期阶段生长性能分析
由于前期鱼苗较小,难以测量单个鱼苗的体重,故只进行了鱼苗体长测定。生长性能测定时间为60 d,测定时鱼苗较小,故筛选的速生家系属于早期生长快速的家系,对速生家系的筛选具有参考意义(表 2)。将全长日增长率大于 0.160 cm/d的家系定为早期快速生长家系,共5个(F1639、F1621、F1661、F1606、
F1648),其平均全长日增长率为0.168 cm/d,占所有家系的17.9%;将全长日增长率在0.150~0.160 cm/d之间的家系定为早期生长速度一般家系,共9个,平均全长日增长率为0.152 cm/d,占所有家系的32.1%;将全长日增长率小于0.150 cm/d的14个家系定为早期慢速生长家系,平均全长日增长率为0.142 cm/d,占所有家系的50.0%(图1)。
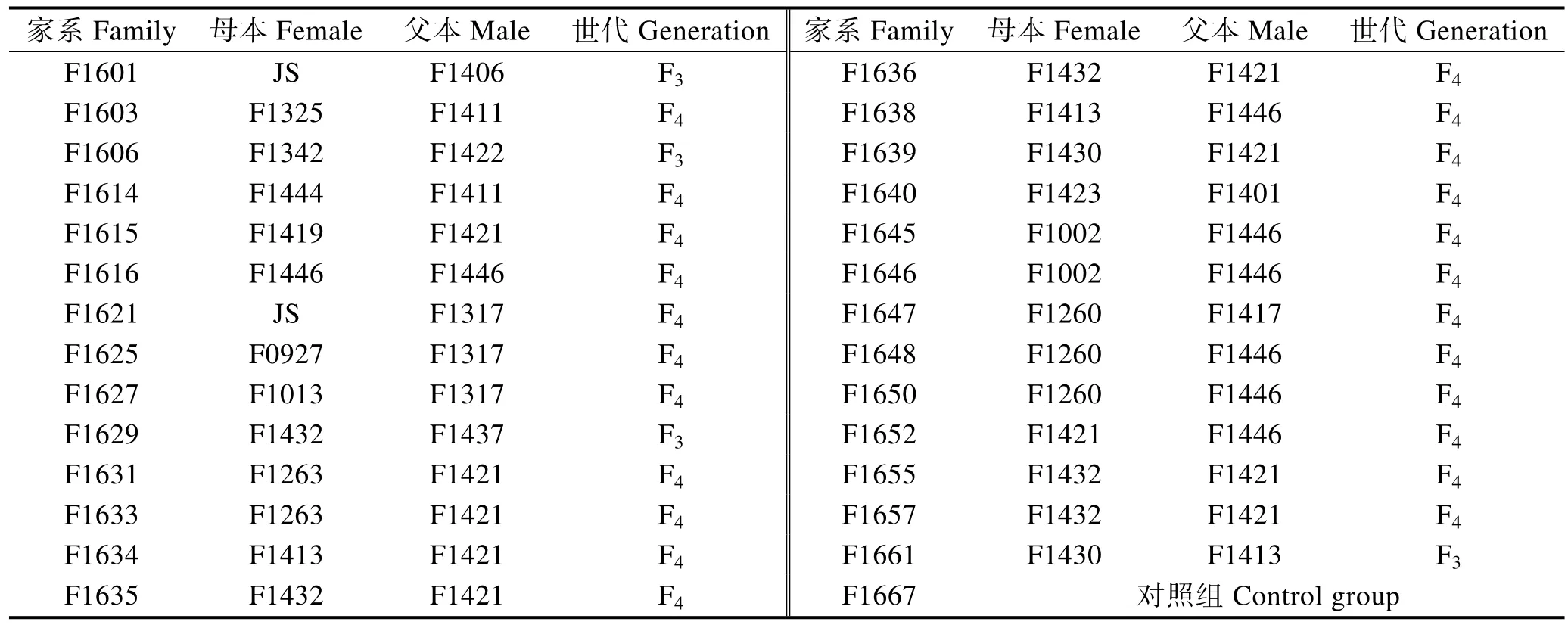
表1 28个牙鲆家系亲本信息Tab.1 Parental information of 28 flounder families
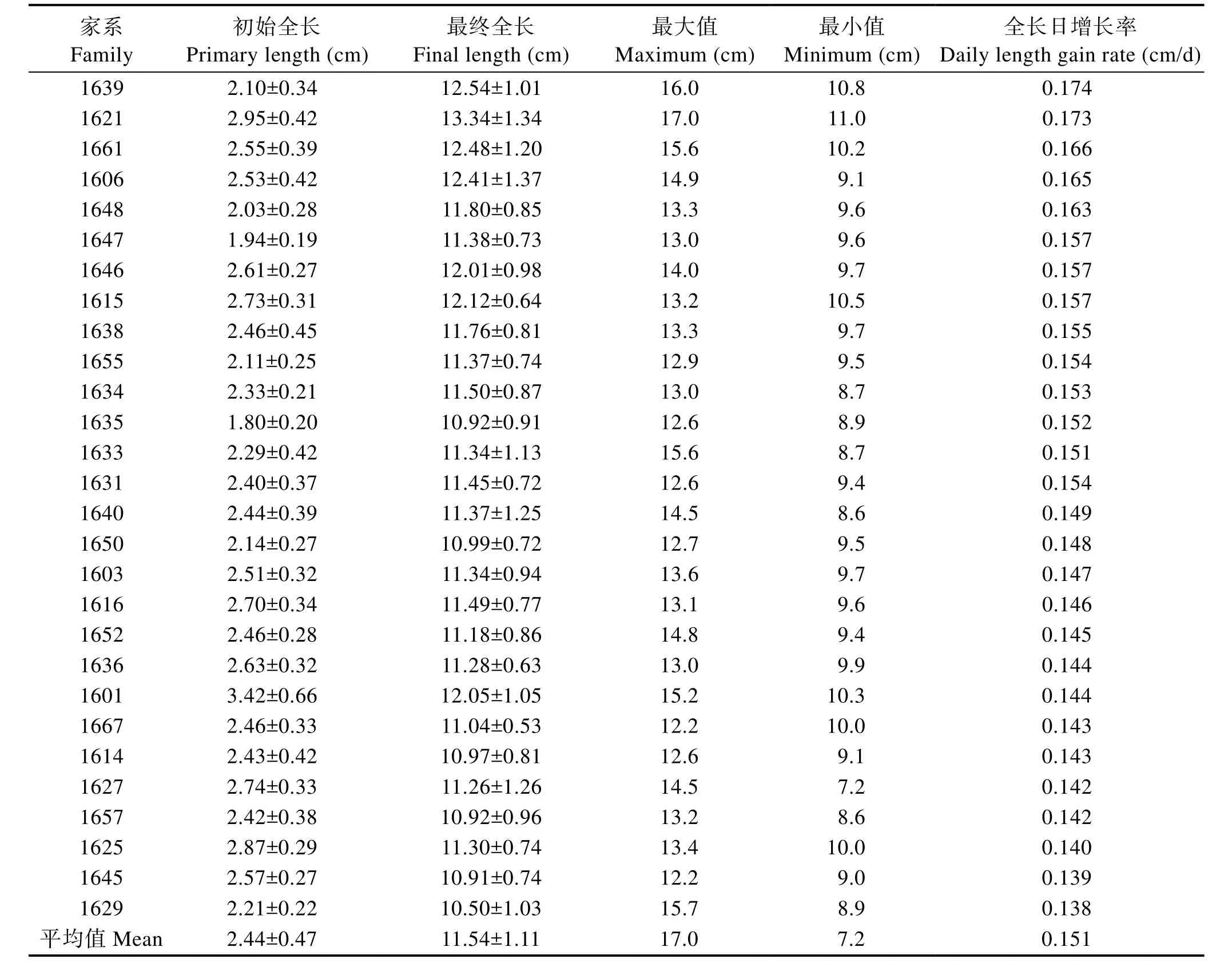
表2 28个牙鲆家系的全长日增长率Tab.2 Daily length gain rate of 28 flounder families
2.3 28个牙鲆家系的抗病性能差异
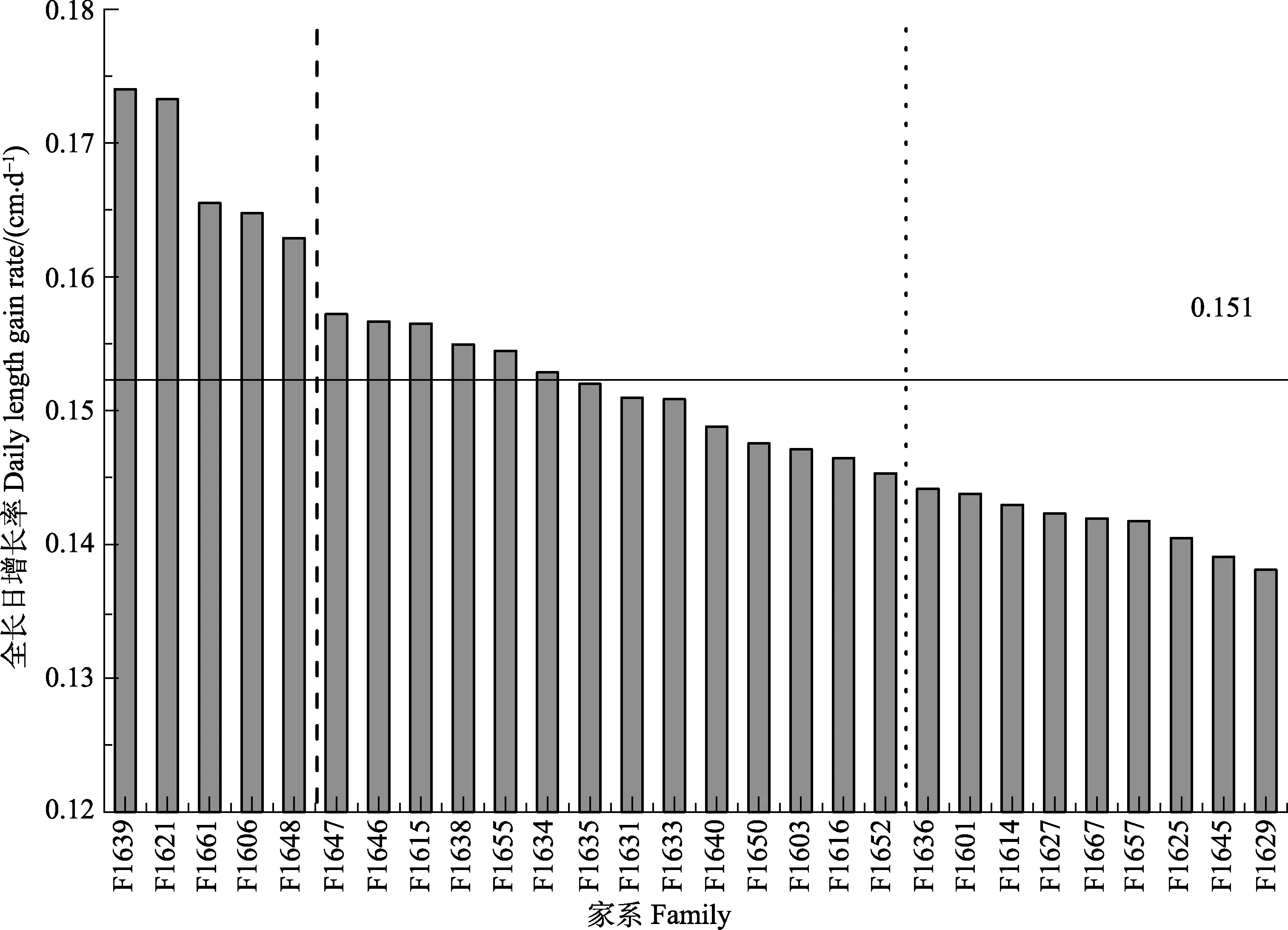
图1 28个牙鲆家系的全长日增长率Fig.1 Daily length gain rate of 28 flounder families
观察结果显示,注射24~72 h后,所有家系鱼摄食量减少,活力下降,出现白色粪便,部分鱼表现腹水症状。第3天开始出现死亡,死亡的个体体色发黑,腹部肿胀,部分个体有肠道外露现象。第 4、5天开始大规模死亡,死亡持续到第12天逐渐稳定,总体平均存活率为(44.48±19.72)%(表 3)。其中,F1639、F1601、F1633、F1635、F1657、F1606和 F1631 7个家系(占总量的25.0%)的存活率均高于60%,定义为高抗病力家系;11个存活率介于30%~60%之间的家系(占比39.3%),定义为抗病力一般的家系;10个存活率低于30%的家系(占总量的35.7%),称为低抗病力的家系(图2)。
2.4 28个家系生长与抗病性能相关性分析
使用SPSS 19.0软件对28个牙鲆家系中生长性能与抗病性能进行皮尔森相关性分析(表 4),P<0.05说明存活率与生长性状显著相关,其中,全长与存活率的相关系数为 0.496,全长日增长率与存活率的相关系数为0.301,体重与存活率的相关系数为0.432,说明存活率与全长、全长日增长率、体重之间呈现中等相关性。
2.5 抗病速生家系筛选及其来源
由图1和图2可见,F1639家系早期生长最快,抗病力也最强,为F4代中的速生高抗病力家系。F1639的母本来自F1421家系,父本来自F1430家系。F1430家系为 F3代中筛选出的生长快速家系,其母本来自F0917家系,父本来自F0915家系,均为抗病速生家系;F1421家系为F3代选育出的抗病速生家系,其母本来自F0927家系,父本来自F0915家系。F0927家系为 F2代筛选出的抗病力高家系,是 F0750家系个体雌核发育后代。F0750为F1代选育出的抗病力高家系,亲本为选育出的中国牙鲆抗病选育群体(RS)与日本引进后选育的牙鲆群体(JS)。
F1639家系的感染存活率为77.23%,比2016年构建的28个家系的平均存活率(44.48%)高32.75%。F1421家系为F3代选育出的抗病力高家系,存活率为47.06%,比F3代平均存活率(20.29%)高26.77%。F0927家系为 F2代筛选出的抗病力高家系,感染存活率为64.97%,比F2代平均存活率(28.24%)高36.73%。F0750为 F1代选育出的抗病力高家系,感染存活率为64.05%,比F1代平均存活率(32.60%)高31.45%。
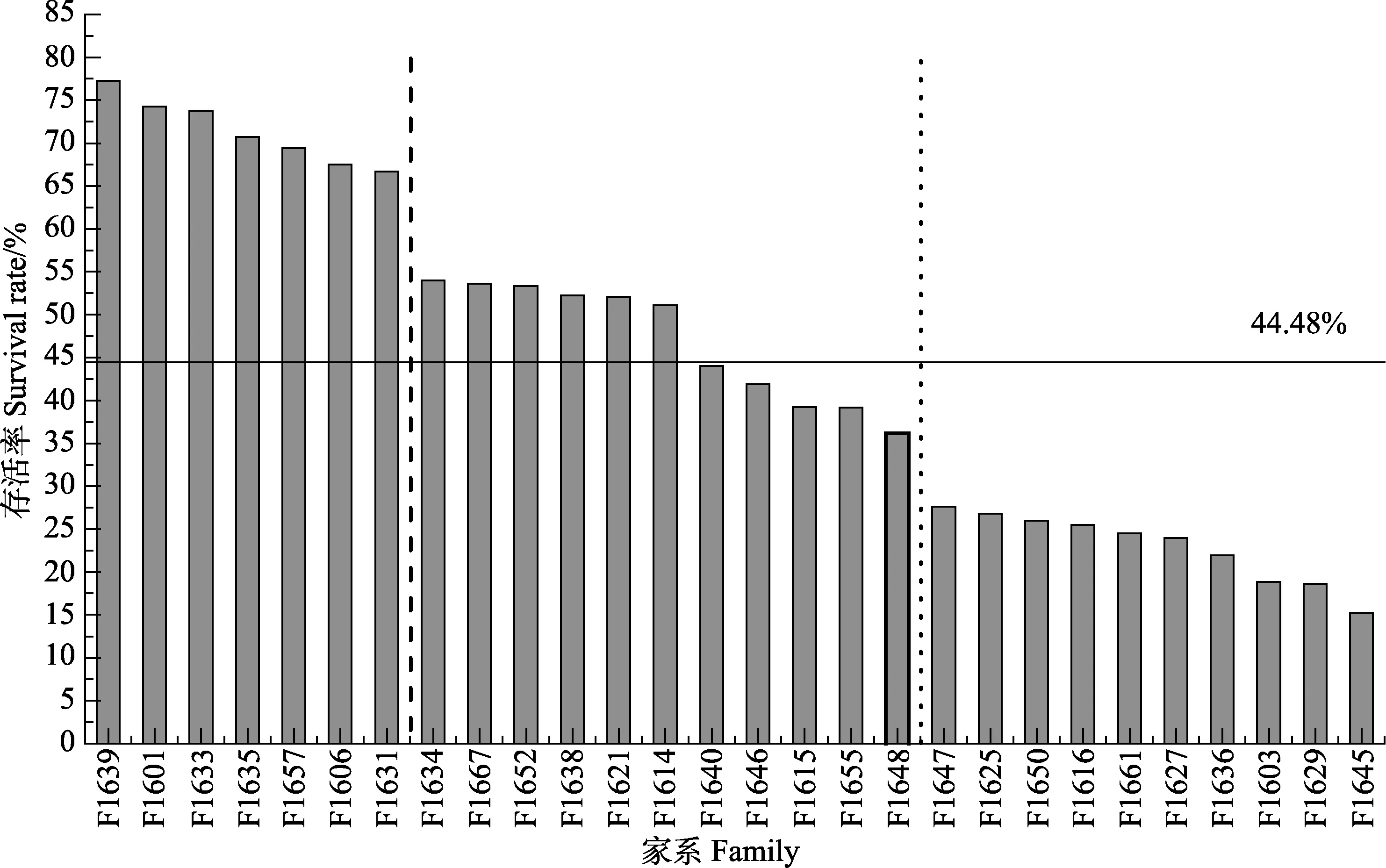
图2 感染后各牙鲆家系存活率统计Fig.2 Statistic of survival rate of the infected flounder family
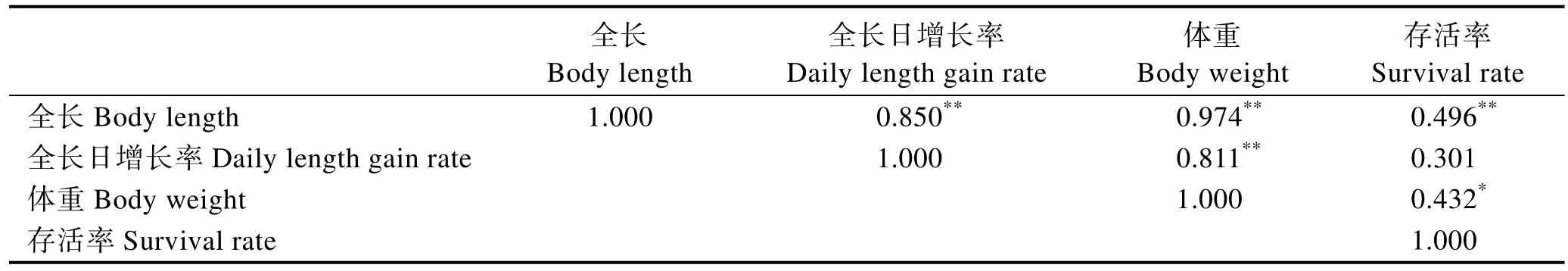
表4 牙鲆28个家系中各项表型间相关性分析Tab.4 Correlation analysis of phenotypes in 28 flounder families

图3 抗病家系系谱Fig.3 The family trees of disease resistance family虚线外框家系为抗病家系,箭头上端为亲本,←为杂交,KS:韩国群体;RS:抗病群体;JS:日本群体;LS:鲈鱼精子The families in frame with dotted lines are the resistant families, the upper ends of the arrows are the parents of families arrowed, ←represent hybridization,KS: Korean stocks; RS: Disease-resistant stocks; JS: Japanese stocks; LS: Lateolabrax japonicus sperm
3 讨论
牙鲆等多种水产养殖动物感染迟缓爱德华氏菌后会出现摄食量和活力明显下降,腹腔膨大,腹膜软化出血,内脏肿大甚至外漏,肝、肾等组织局灶性坏死等临床症状(张晓君等, 2005; 刘云等, 2000),这些症状与本研究所观察到的结果基本一致。另外,比较人工腹腔注射感染与自然感染,人工注射感染的发病症状表现突出,发病情况较为普遍,不同家系之间的抗病力差异区分明显。
2016年本研究共建立了28个牙鲆家系,包括F3代家系4个、F4代家系23个和对照家系1个。通过迟缓爱德华氏菌攻毒感染实验,成功筛选出抗迟缓爱德华氏菌 F3家系 2个(F1601和 F1606),F4代家系5个(F1633、F1635、F1639、F1657和 F631)。分析表明,2016年抗病力强的家系的父本来自2014年抗迟缓爱德华氏菌病家系(F1406、F1421和F1422),其祖先或祖先之一67%来自抗鳗弧菌家系。由此可见,近年来本实验室不断选育的牙鲆抗病家系效果明显。在抗病力强的7个家系中,F1639家系的早期阶段的全长日增长率(0.174 cm/d)最高,为早期快速生长家系;F1606为早期快速生长家系,F1633和F1635为生长速度一般家系。综合比较这些家系的抗病和生长性能可以看出,F1639在抗病和生长性能方面都优于其他家系,可作为以后研究的F4代重点家系。马爱军等(2014)从2010年开始大菱鲆抗鳗弧菌病选育研究,成功选育出5个抗病力较强的优良家系,可作为抗鳗弧菌选育的核心育种群体。朱佳杰等(2012)构建了吉富罗非鱼(GIFT strain Oreochromis niloticus)家系,并进行无乳链球菌(Streptococcus agalactiae)攻毒感染实验,利用家系选育方法对吉富罗非鱼进行了抗病品种选育的研究。
为了说明抗病选育对各世代抗病力的提高情况,比较本实验室所培育的牙鲆F1~F4世代家系攻毒感染后的存活率。其中,F1代为 2007年陈松林等(2008)建立的抗鳗弧菌病家系,F2代家系为2009年王磊等(2013)建立的抗鳗弧菌病家系,F3代家系为 2014年孙何军等(2015)建立的抗迟缓爱德华氏菌病家系。本实验建立的大多数为F4代抗迟缓爱德华氏菌病家系。
F1代与 F2代进行的是抗鳗弧菌选育,F2代家系对鳗弧菌攻击的抗病力显著增强,抗病力高家系的攻毒感染存活率由 F1代的 51.86%提高至 F2代的60.68%。F3代与 F4代进行的是抗迟缓爱德华氏菌选育,抗病力高家系的攻毒感染存活率由F3代的40.59%提高至F4代的72.14%。在家系选育中,虽然家系培育占用场地较多、牙鲆亲鱼性成熟时间较长,但家系选育能够增加有效群体数量,控制近交系数的增量,延长世代间隔,减少基因流失(黄永春等, 2013),因此,家系选育是进行鱼类抗病良种培育的重要技术手段。
经过 F1代、F2代选育出的牙鲆家系具有生长迅速、养殖成活率较高、抗鳗弧菌感染的优点。本研究通过家系选育,建立了牙鲆抗迟缓爱德华氏菌病家系,成功筛选到抗病力强、生长快速的 F4代家系(F1639),为进一步培育抗病高产优质的牙鲆优良品种奠定了重要基础。本研究表明,经过多代的家系选育和攻毒感染实验,牙鲆的抗病力得到逐代提升,实现了抗病力性状向后代的稳定遗传。本研究结果对于其他鱼类抗病良种培育,具有重大的应用价值和广阔的推广前景。
Chen AP, Jiang YL, Qian D, et al. Edwardsiellasis. China Fisheries, 2011(7): 49–50 [陈爱平, 江育林, 钱冬, 等. 迟缓爱德华氏菌病. 中国水产, 2011(7): 49–50]
Chen CF, Wu ZX, Gao HJ. Isolation and identification of pathogenic bacteria causing Edwardsiellosis in eel (Anguilla japonica). Journal of Huazhong Agricultural University,1998, 17(4): 382–388 [陈昌福, 吴志新, 高汉娇. 日本鳗鲡爱德华氏菌病病原菌的分离与鉴定. 华中农业大学学报, 1998, 17(4): 382–388]
Chen SL, Tian YS, Xu TJ, et al. Development and characterization for growth rate and disease resistance of disease-resistance population and family in Japanese flounder (Paralichthys olivaceus). Journal of Fisheries of China, 2008, 32(5):665–673 [陈松林, 田永胜, 徐田军, 等. 牙鲆抗病群体和家系的建立及其生长和抗病性能初步测定. 水产学报,2008, 32(5): 665–673]
Chen SL, Tian YS. 2011 Japanese flounder “Pingyou No.1”. In:National Fisheries Technology Extension Station. 2010 new aquatic breeds promotion guide. Beijing: Agricultural Press China, 2011 [陈松林, 田永胜. 2011牙鲆“鲆优1号”. 全国水产技术推广总站. 2010水产新品种推广指南. 北京: 中国农业出版社, 2011]
Hou JL, Li C, Wang GX, et al. Analysis of genetic structure of three third-generation of successive meiogynogenetic families in Japanese flounder, Paralichthys olivaceus.Engineering Sciences, 2014, 16(9): 26–32 [侯吉伦, 李超,王桂兴, 等. 牙鲆连续三代减数分裂雌核发育家系的遗传特征分析. 中国工程科学, 2014, 16(9): 26–32]
Huang YC, Ai HS, Pan ZC, et al. Establishment and WSSV resistant characteristics of selective breeding families for resistance to the white spot syndrome virus of Litopenaeus vannamei. Journal of Fisheries of China, 2013, 37(3):359–366 [黄永春, 艾华水, 潘忠诚, 等. 凡纳滨对虾抗WSSV选育家系的建立及其抗病特性. 水产学报, 2013,37(3): 359–366]
Li NQ, Yu LJ, Fu XZ, et al. Construction of Edwardsiella tarda ghosts from eel and their optimization of preparation conditions. Journal of Fisheries of China, 2012, 36(11):1754–1762 [李宁求, 余露军, 付小哲, 等. 鳗源迟缓爱德华氏菌菌蜕的构建及制备条件优化. 水产学报, 2012,36(11): 1754–1762]
Liu Y, Jiang M, Jiang GL, et al. Effect of injection of Edwardsiella tarda on the immune organ of bastard halibut(Paralichthys olivaceus). Marine Sciences, 2000, 24(12):42–46 [刘云, 姜明, 姜国良, 等. 迟缓爱德华氏菌对牙鲆免疫器官的影响. 海洋科学, 2000, 24(12): 42–46]
Ma AJ, Guo JL, Wang XA, et al. Family selection and estimation of disease resistance in turbot, Scophthalmus maximus.Journal of Fishery Sciences of China, 2014, 21(3): 484–493[马爱军, 郭建丽, 王新安, 等. 大菱鲆选育家系抗鳗弧菌性能. 中国水产科学, 2014, 21(3): 484–493]
Qi WS, Tian YS, Jiang J, et al. Establishment and identification of mitotic gynogenesis Japanese flounder (Paralichthys olivaceus) pure family. Journal of Agricultural Biotechnology,2014, 22(5): 541–551 [齐文山, 田永胜, 姜静, 等. 牙鲆卵裂雌核发育纯系的建立及鉴定. 农业生物技术学报, 2014,22(5): 541–551]
Si F, Sun ZH, Yu SS, et al. Analysis of the genetic variability of the captured population of Japanese flounder Paralichthys olivaceus in the coastal releasing area of Qinhuangdao. Progress in Fishery Sciences, 2017, 38(6):18–24 [司飞, 孙朝徽, 于姗姗, 等. 秦皇岛近海增殖放流区牙鲆(Paralichthys olivaceus)回捕群体的遗传多样性分析. 渔业科学进展, 2017, 38(6): 18–24]
Sun HJ, Chen SL, Zheng WW, et al. Screening for resistance to Edwardsiella tarda in different families of Japanese flounder,Paralichthys olivaceus. Journal of Fishery Sciences of China,2015, 22(6): 1115–1122 [孙何军, 陈松林, 郑卫卫, 等. 抗迟缓爱德华氏菌病牙鲆家系的筛选与分析. 中国水产科学, 2015, 22(6): 1115–1122]
Tian YS, Chen SL, Xu TJ, et al. The comparison of growth performances of Japanese flounder (Paralichthys olivaceus)families and selection of parents with good trait. Journal of Fisheries of China, 2009, 33(6): 901–911 [田永胜, 陈松林,徐田军, 等. 牙鲆不同家系生长性能比较及优良亲本选择. 水产学报, 2009, 33(6): 901–911]
Wang L, Chen SL, Zhang YP, et al. Comparative analysis of disease resistance among three successive generations of Japanese flounder (Paralichthys olivaceus) families. Journal of Fishery Sciences of China, 2013, 20(5): 990–996 [王磊,陈松林, 张英平, 等. 牙鲆连续三代抗鳗弧菌病家系的筛选与分析. 中国水产科学, 2013, 20(5): 990–996]
Wang ZM, Zhang WX, Feng LX, et al. Isolation and identification of the pathogenic bacteria of the white intestine disease in Paralichthys olivaceus. Hebei Fisheries,2005(1):11–15 [王志敏, 张文香, 冯力霞, 等. 牙鲆仔鱼肠道白浊病病原菌的分离鉴定. 河北渔业, 2005(1):11–15]
Xu TJ, Chen SL, Tian YS, et al. Comparative analysis of disease resistance among Japanese flounder (Paralichthys olivaceus)families. Journal of Fishery Sciences of China, 2010, 17(1):59–68 [徐田军, 陈松林, 田永胜, 等. 牙鲆抗鳗弧菌病家系筛选及其分析. 中国水产科学, 2010, 17(1): 59–68]
Zhang XJ, Zhan WB, Chen CZ, et al. Studies on the infection and pathogen of Edwardsiella tarda in flounder Paralichthys olivaceus. Acta Hydrobiologica Sinica, 2005, 29(1): 31–37[张晓君, 战文斌, 陈翠珍, 等. 牙鲆迟钝爱德华氏菌感染症及其病原的研究. 水生生物学报, 2005, 29(1): 31–37]
Zhang YP, Chen SL, Sun HJ, et al. Establishment and analysis of Japanese flounder (Paralichthys olivaceus) families with enhanced disease resistance to Edwardsiella tarda. Journal of Fisheries of China, 2014, 38(9): 1917–1925 [张英平, 陈松林, 孙何军, 等. 牙鲆抗迟缓爱德华菌病家系建立与抗病性能评价. 水产学报, 2014, 38(9): 1917–1925]
Zheng WW, Chen SL, Li ZY, et al. Analyzing of heritability and breeding value of disease resistance for Edwardsiella tarda in Japanese flounder (Paralichthys olivaceus). Journal of Agricultural Biotechnology, 2016, 24(8): 1181–1189 [郑卫卫, 陈松林, 李泽宇, 等. 牙鲆抗迟缓爱德华氏菌性状的遗传力和育种值分析. 农业生物技术学报, 2016, 24(8):1181–1189]
Zhu JJ, Li LP, Zhou Y, et al. Family establishment and disease resistance of different families of GIFT Nile tilapia Oreochromis niloticus. South China Fisheries Science, 2012,8(6): 22–27 [朱佳杰, 李莉萍, 周宇, 等. 吉富罗非鱼家系构建及抗病力检测. 南方水产科学, 2012, 8(6): 22–27]

