MiR-106a作用于TIMP2诱导人胃癌BGC-823细胞的腹腔种植转移
朱 萌,潘小丽,张 宁,和水祥,任牡丹
(1. 宁夏医科大学总医院消化内科,宁夏银川 750004;2. 宁夏医科大学总医院病理科,宁夏银川 750004;3. 西安交通大学第一附属医院消化内科,陕西西安 710061)
胃癌在亚洲国家的发病率和死亡率一直居高不下[1]。我国是胃癌的高发区,尤以西北地区为著。西北地区胃癌早期发现率低,多数患者就诊时已处于进展期并伴有多种类型转移的发生,治疗效果差,其中占转移类型50%的腹腔种植转移是导致患者死亡、复发、预后差的不可忽略因素[2-3]。一旦发生腹腔种植转移,就不易被切除干净,术后极易复发,增加了肿瘤细胞的侵袭性和恶性肿瘤对人体的危害性[4]。研究表明,miRNA在肿瘤转移的多个环节包括黏附、滚动、细胞外基质的降解等方面起到关键调节作用[5],但关于miR-106a与胃癌腹腔种植转移关系仍知之甚少。基于此,本课题在体外水平观察miR-106a与胃癌细胞侵袭转移的关系,进一步在体内水平有针对性地研究miR-106a与种植转移的关系,并结合基质金属蛋白酶抑制物TIMP2探讨miR-106a诱导人胃癌细胞腹腔种植转移的可能机制,以期为胃癌的临床诊治提供一定的实验依据和潜在的治疗靶点。
1 材料与方法
1.1主要材料人胃低分化腺癌BGC-823细胞株(中国科学院典型培养物保藏委员会细胞库);PRMI-1640培养基(美国Gibco公司),胎牛血清、RIPA裂解液(杭州四季青公司),EDTA-胰蛋白酶(美国Hyclone公司);RNA提取试剂盒(货号:5080576001,德国Roche公司);Real-time PCR引物及试剂盒(miR-106a ID:002169,U6 snRNA ID:001973,美国Life technology公司);Transwell小室(美国Millipore公司);MiR-106a拮抗剂(hsa-miR-106a-5p antagomir,miR30000103-1-10)和无关序列阴性对照(microRNA negative control #24,miR-NC,广州锐博公司);BALB/c裸鼠[SCXK(京)2012-0001,北京维通利华实验动物技术有限公司];兔多克隆TIMP2抗体(17353-1-AP,美国proteintech公司);通用二步法检测试剂盒(PV-9000,北京中杉金桥公司);ECL化学发光试剂(美国Millipore公司)。
1.2细胞培养及转染人胃癌BGC-823细胞株,采用含100 mL/L胎牛血清的RPMI-1640培养基,置于37 ℃、50 mL/L CO2的培养箱中培养,待细胞融合度达80%~90%时传代培养至对数生长期。转染前1 d,按2×105个细胞/孔接种至6孔培养板,使转染时细胞密度达到50%~70%。次日miR-106a antagomir和negative control优化浓度200 nmol/L直接转染,转染后48 h消化细胞,使用Roche High Pure miRNA Isolation Kit抽提小RNA,严格按照试剂盒说明书操作,遵循无菌无酶操作规范,抽提出的小RNA分子进行质量检测,A在1.8~2.0之间表示RNA纯度完好。
1.3Real-timePCR采用Taqman探针法进行real-time PCR(qRT-PCR)反应,标化内参U6 snRNA基因。RNA模板量10 ng,配制反应混合液,置于Bio-Rad S1000 PCR仪上逆转录,反应条件:16 ℃ 30 min、42 ℃ 30 min、85 ℃ 5 min、4 ℃终止。cDNA模板与扩增反应混合液混匀,于Bio-Rad C1000 PCR仪上扩增,反应条件:95 ℃ 10 min、95 ℃ 15 s、60 ℃ 60 s,共40个循环。结果采用2-△△Ct计算相对基因表达量,Ct=目标扩增产物达到设定阈值所经历的循环数。
1.4Transwell实验细胞分3组:BGC-823、BGC-823/anti-miR-106a,BGC-823/negative control。转染前一天取对数生长期细胞以2×105个/孔、100 μL/孔接种于6孔培养板,48 h后消化离心收集细胞,transwell下室加入600 μL含100 mL/L胎牛血清的培养基,上室按2×104个细胞/100 μL/室滴加细胞悬液。每组3个小室。侵袭试验将Matrigel基质胶按1∶5比例稀释50 μL/孔加入上室。温箱培养24 h后,40 g/L多聚甲醛室温固定30 min,1 g/L结晶紫染色10 min,PBS浸洗,风干,中性树胶封片,显微镜下随机选取10~20个高倍视野,计数穿膜细胞数量。
1.5移植瘤模型BALB/c裸鼠共16只,雄性,4~6周,16~18 g,饲养于西安交通大学医学部实验动物中心SPF层流房内。该中心具备动物饲养资质,有关操作符合动物实验管理条例,遵循实验动物保护福利。遵循随机配对原则将动物分组:miR-antagomir组和miR-NC组。BGC-823细胞密度达80%~90%,按以上浓度转染,转染后24 h在antagomir处于最佳作用时间时收集细胞。100 mL/L水合氯醛麻醉后,于剑突下剪开0.1 cm长切口,直接注入细胞悬液(0.2 mL含1×107个/细胞),关腹。2周后脱颈处死裸鼠,暴露腹腔,直视观察癌细胞的播散和种植,主要剥离切口处、大网膜、肠系膜种植瘤结节。标本一部分制成石蜡切片,一部分置于液氮冻存。
1.6免疫组织化学法检测TIMP2表达石蜡切片行免疫组织化学Elivision法检测。切片脱蜡水化,柠檬酸高压抗原修复,30 mL/L H2O2阻断内源性过氧化物酶,一抗1∶200室温孵育2 h,滴加试剂1,室温孵育20 min,滴加试剂2,室温孵育20 min,DAB显色2~5 min,苏木素淡染,封片。TIMP2表达阳性为细胞质出现棕黄色细颗粒状物。半定量积分法判断结果,阳性细胞百分比:<5%为0分,5%~25%为1分,25%~50%为2分,50%~75%为3分,>75%为4分;染色强度:阴性为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞百分比和染色强度乘积≥1判为阳性。
1.7Westernblot法检测TIMP2的表达液氮冻存组织经研磨匀浆后加入RIPA裂解液裂解提取总蛋白。加入蛋白Marker,SDS-PAGE凝胶电泳分离80 V 30 min、120 V 1 h,TIMP2检测条带24 ku,内参β-actin条带43 ku。在15~30 ku和35~55 ku宽度平行切胶,25 V 20 min 干转。50 mL/L脱脂牛奶室温封闭1 h。结合一抗,TBST稀释(1︰1 000),4 ℃孵育过夜,次日结合二抗,室温孵育1 h,TBST清洗。ECL发光液暗室发光、显色。

2 结 果
2.1miR-106a在胃癌细胞株中的表达差异Real-time PCR检测在应用miR-106a antagomir后,BGC-823/anti-miR-106a组和BGC-823/negative control组miR-106a的表达差异,结果显示miR-106a在BGC-823/anti-miR-106a组表达下调,相对表达量为2-△△Ct=0.05±0.01。Levene齐性检验P=0.447,两独立样本t检验得出两组之间miR-106a表达量有统计学差异(t=-18.001,P<0.001,图1)。

图1 Real-time PCR检测miR-106a表达量Fig.1 The expression of miR-106a detected by Real-time PCR method (P<0.001)
2.2miR-106a对胃癌细胞迁移和侵袭的影响Transwell迁移实验结果表明,3组细胞BGC-823、BGC-823/anti-miR-106a,BGC-823/negative control组穿膜细胞数分别为99.00±28.11,18.80±17.01,94.23±18.15。方差齐性检验P=0.008,方差分析使用Welch修正值得出3组细胞穿膜数不全相等,BGC-823/anti-miR-106a组穿膜细胞数最少(P<0.001)。侵袭实验结果表明,3组细胞的穿膜细胞数分别为74.11±49.22,16.15±8.42,83.00±42.81,方差齐性检验P<0.001,方差分析使用Welch修正值得出P<0.001,3组细胞穿膜数BGC-823/anti-miR-106a组最少(图2)。
2.3miR-106a对胃癌细胞腹腔种植转移能力的影响肉眼观察miR-NC组胃壁瘪陷,肠道粘连,内容物少,蠕动差,腹腔内癌结节满布,大网膜可见癌结节种植,Φ平均1.3 cm;切口处癌结节凸出于皮面,Φ1.2 cm;肠系膜癌结节密布、融合,Φ 0.3~0.8 cm;个别大网膜与后腹壁粘连。miR-antagomir组腹腔癌结节明显少,腹腔脏器之间及与腹壁之间无明显粘连,大网膜癌结节Φ平均0.6 cm;切口处癌结节Φ 0.4 cm;肠系膜癌结节散在,Φ 0.1 cm。HE染色证实癌细胞种植,miR-antagomir组癌细胞密集成片,体积大,核质比例失调,胞质丰富,核大深染,可见多极性、顿挫性、不对称性等病理性核分裂象,部分癌细胞中央坏死。miR-NC组癌细胞成小团巢状分布,癌细胞周围可见巨噬细胞、淋巴细胞、浆细胞等炎细胞浸润(图3)。
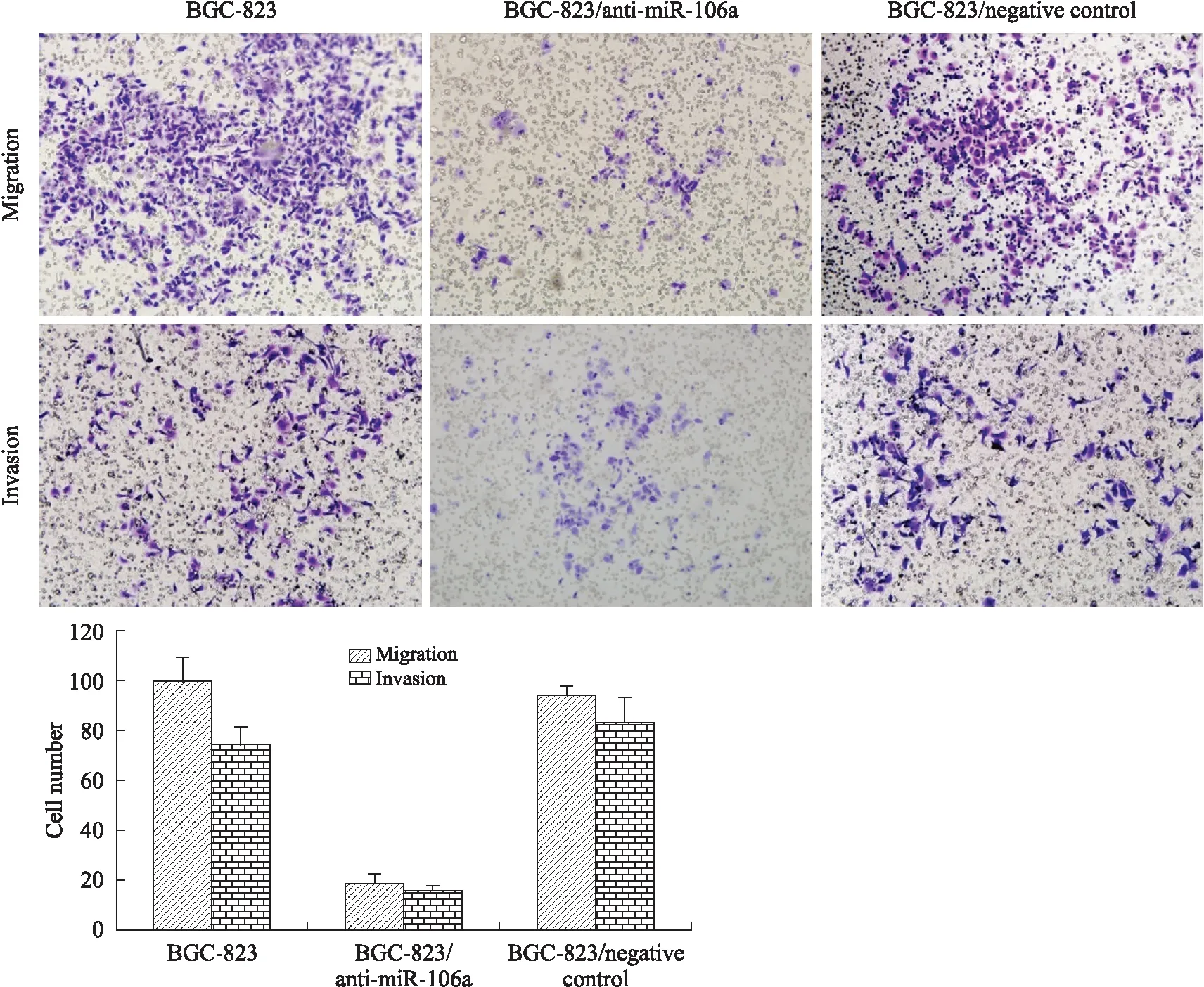
图2 miR-106a对胃癌细胞迁移和侵袭的影响(P<0.001)Fig.2 Effect of miR-106a on migration and inva-sion of gastric cancer cells (P<0.001, ×10)

图3 miR-106a对胃癌细胞腹腔种植转移能力的影响Fig.3 Effect of miR-106a on peritoneal metastasis of gastric cancer cells
2.4miR-106a对目的蛋白TIMP2表达的影响免疫组织化学染色显示,miR-antagomir组TIMP2表达呈片状,棕褐色着色于胞质,miR-NC组TIMP2表达呈单个散在分布(图4A)。使用等级资料的非参数检验得出u=49.500,P=0.039,miR-antagomir组TIMP2蛋白表达量高于miR-NC组(表1)。Western blot结果显示,miR-antagomir组miR-106a表达缺失对应着TIMP2蛋白表达水平明显增高(图4B)。

表1 两组TIMP2蛋白表达率的比较Tab.1 Comparison of TIMP2 protein level between the two groups (n=8)
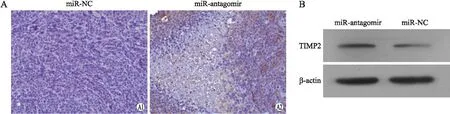
图4 miR-106a对TIMP2蛋白表达的影响Fig.4 Effect of miR-106a on the expression level of TIMP2
3 讨 论
关于胃癌的腹腔种植转移,经典的研究理论认为“种子-土壤”(seed and soil)学说可解释胃癌细胞的腹腔种植。该学说所基于的前提是认为转移仅仅发生在适宜肿瘤生存和生长的环境中[6]。胃癌细胞侵破胃壁浆膜面从原发灶脱离后,形成游离癌细胞(free cancer cells, FCC),FCC进入腹腔后可能会发生种植,首先是释放一系列早期炎症介质如TGF-β、EGF和b-FGF等导致大网膜表面间皮细胞凋亡,间皮细胞凋亡后其下血管和细胞成分裸露,细胞表面含有的配体与肿瘤细胞表面的受体结合,从而发生种植[7-8]。这一系列过程同侵袭转移相关调控分子的功能改变是密不可分的。
本研究在体外和体内水平验证miR-106a是否依赖于基质金属蛋白酶家族抑制物TIMP2的作用靶点而调节生物信号通路的功能方向。通过转染miRNA antagomir进行功能缺失性(loss-of-function)研究。体外实验证实miR-106a功能减弱或缺失导致BGC-823细胞迁移和侵袭能力减弱,提示miR-106a在胃癌细胞的侵袭转移过程中可能起着促癌基因样的作用。因侵袭试验采用基质胶,推测miR-106a可能通过溶解基底膜胶原基质促进癌细胞侵袭,为探索此机制,进一步在体内检测侵袭转移标记物基质金属蛋白酶抑制物重要成员TIMP2的表达。本实验通过HE染色证实为低分化黏液腺癌并有向印戒细胞癌转化的倾向,此种病理类型多表现为皮革胃,容易发生腹膜播散。关于移植瘤模型有多种报道,包括胃浆膜下移植瘤和皮下多部位移植瘤等[9-10],而我们采用的是腹部小切口注射瘤细胞的方式,该方式能够直观模拟游离癌细胞随腹腔内脏器的蠕动和裸鼠的运动在腹腔内播散的情况。实验结果表明,体内应用antagomir后,胃癌细胞的腹腔种植能力下降,表现为各脏器主要包括切口处、大网膜、肠系膜种植瘤结节数量和体积的减小,且随着miR-106a功能减低或缺失,其对应目的蛋白TIMP2表达显著升高。动物实验在体内水平证实miR-106a可能通过靶向抑制TIMP2而参与胃癌的恶性进展。
现已明确miRNA的作用机制是通过识别一个或多个mRNA分子的3′-非翻译区(3′-UTR),在转录后水平抑制mRNA翻译或降解mRNA而调节基因的表达[11]。在miRNA家族中,已有研究报道显示,miR-3978、miR-214等肿瘤特异性表达miRNA是能够靶向调节胃癌转移包括腹腔种植转移的[12-14]。本研究锁定miR-106a,体外和体内实验均得出miR-106a对胃癌细胞侵袭转移的诱导作用,且分析基质金属蛋白酶抑制物TIMP2可能是miR-106a发挥作用的功能靶位。已知基质金属蛋白酶和基质金属蛋白酶抑制物的分子平衡是维持细胞外基质(extracellular matrix, ECM)降解与完好的重要调节物质,TIMPs是MMPs的天然抑制剂。TIMP2几乎对所有MMPs都有抑制作用,尤以TIMP2作用最强。有报道显示,在大肠腺癌组织中,TIMP2低表达和MMP2高表达两者之间失衡致使ECM降解是启动肿瘤细胞黏附迁移的始动因素之一[15]。结合本实验结果,说明当miR-106a表达受抑时,一定程度上解除了对TIMP2的表达抑制,TIMP2表达增强,TIMP2的高表达拮抗MMPs,使得MMPs表达减低,减少基底膜降解,阻抑胃癌细胞的侵袭转移。据此,我们可以认为,miR-106a可能通过直接抑制基质金属蛋白酶抑制物TIMP2的表达,打破TIMP-MMP之间的平衡,加速ECM降解,促进胃癌细胞的腹腔种植。
参考文献:
[1] WANG J, SUN Y, BERTAGNOLLI MM. Comparison of gastric cancer survival between Caucasian and Asian patients treated in the United States: Results from the Surveillance Epidemiology and End Results (SEER) database[J]. Ann Surg Oncol, 2015, 22(9):2965-2971.
[2] MAEHARA Y, HASUDA S, KOGA T, et al. Postoperative ossssutcome and sites of recurrence in patients following curative resection of gastric cancer[J]. Br J Surg, 2000, 87(3):353-357.
[3] KOBAYASHI D, KODERA Y. Intraperitoneal chemotherapy for gastric cancer with peritoneal metastasis[J]. Gastric Cancer, 2017, 20(Suppl 1):111-121.
[4] LIANG P, HU X. Strategies of diagnosis and treatment for peritoneal metastasis of gastric cancer[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2017, 20(5):500-503.
[5] ZHAO X, LI X, YUAN H. microRNAs in gastric cancer invasion and metastasis[J]. Front Biosci (Landmark Ed), 2013, 18:803-810.
[6] Paget S. The distribution of secondary growths in cancer of the breast[J]. The Lancet, 1889, 133(3421):571-573.
[7] FIDLER IJ. The pathogenesis of cancer metastasis: the 'seed and soil' hypothesis revisited[J]. Nat Rev Cancer, 2003, 3(6):453-458.
[8] KIYASU Y, KANESHIMA S, KOGA S. Morphogenesis of peritoneal metastasis in human gastric cancer[J]. Cancer Res, 1981, 41(3):1236-1239.
[9] FURUKAWA T, FU X, KUBOTA T, et al. Nude mouse metastatic models of human stomach cancer constructed using orthotopic implantation of histologically intact tissue[J]. Cancer Res, 1993, 53(5):1204-1208.
[10] LI K, DU H, LIAN X, et al. Establishment and characterization of a metastasis model of human gastric cancer in nude mice[J]. BMC Cancer, 2016, 16:54.
[11] HAMMOND SM. An overview of microRNAs[J]. Adv Drug Deliv Rev, 2015, 87:3-14.
[12] ZHANG Y, WU YY, JIANG JN, et al. MiRNA-3978 regulates peritoneal gastric cancer metastasis by targeting legumain[J]. Oncotarget, 2016, 7(50):83223-83230.
[13] XIN R, BAI F, FENG Y, et al. MicroRNA-214 promotes peritoneal metastasis through regulating PTEN negatively in gastric cancer[J]. Clin Res Hepatol Gastroenterol, 2016, 40(6):748-754.
[14] SHI Z, WEI Q, SHE J. MicroRNAs in gastric cancer metastasis[J]. Crit Rev Eukaryot Gene Expr, 2014, 24(1):39-53.
[15] 陈谦,柯娟,王纪全,等. 大肠腺癌中基质金属蛋白酶-2、9及其抑制剂-1、2的表达[J]. 西安交通大学学报(医学版), 2009, 30(4):474-477.

