血清miR-27a评估胰腺癌患者化疗疗效和预后的临床应用价值
朱善军 徐震 沈昊 沈国荣 付海龙 杨鸿林 钱东林 沈振芳 石磊 钱红英 朱安渡 马春芳
微小RNA(microRNA,miRNA)是一类长度为21~24个核苷酸的非编码小分子RNA,可在转录后水平调控靶基因表达。据报道,一些miRNA广泛参与细胞增殖、分化、凋亡和基因调控,在肿瘤的发生、发展中扮演重要角色[1]。miR-27a作为一种肿瘤相关基因,受到人们越来越多的关注,其异常表达与人类肺癌、食管癌、肝癌、胃癌等恶性肿瘤存在相关性[2-5],但通过监测miR-27a水平评估胰腺癌患者化疗疗效及预后的研究鲜见报道。本研究检测胰腺癌患者化疗前后血清miR-27a水平的变化,探讨其临床应用价值。
一、资料与方法
1.研究对象:收集2013年5月至2015年8月间南京医科大学第一附属医院和南通大学附属苏州市吴江区第一人民医院肿瘤科收治的169例胰腺癌患者,其中男性98例,女性71例,年龄 31~77岁,平均(58±8)岁。胰腺癌的诊断均经组织病理学检查确诊。患者随访至2015年10月。
2.化疗方案及疗效评价:患者接受美国国立综合癌症网络(NCCN)推荐的一线或二线药物化疗,一线药物化疗方案为吉西他滨,二线化疗药物为FOLFOX4方案。每个化疗周期结束后参考RECIST标准进行疗效评价。完全缓解(CR):所有目标病灶消失和肿瘤标志物水平正常;部分缓解(PR):基线病灶长径总和缩小≥30%;病情进展(PD):基线病灶长径总和增加≥20%、绝对值增大5 mm或出现新病灶;病情稳定(SD):基线病灶长径总和有缩小但未达PR或有增加但未达PD,一个或多个非目标病灶和(或)肿瘤标志物高于正常持续存在。本组患者以一线药物化疗后的最好疗效进行分组。
3.血清miR-27a检测:采用双重荧光定量PCR法检测患者血清miR-27a水平。于化疗前1~7 d及化疗后1~2 d采集静脉血2 ml,3 000 r/min离心5 min,取上层血清再于4℃ 16 000 g 离心10 min,分装上层血清,置-70℃保存。2 h内应用Qiazol试剂提取血清总RNA,分光光度法测定其浓度和纯度。采用RT试剂盒逆转录miR-27a和内参cel-miR-39,反应条件:16℃ 30 min,42℃ 30 min,85℃ 5 min。再在ABI 7 500荧光定量PCR扩增仪扩增,反应条件:95℃ 10 min,95℃ 15 s、60℃ 1 min,45个循环。数据采集和处理由软件SDS system software完成[8]。miRNeasy Mini Kit购自美国Qiagen公司,Taqman miRNA逆转录试剂盒、miRNA特异性茎环结构逆转录引物、双重荧光定量PCR引物和探针均购自美国Appliued BioSystems公司,Real-time PCR试剂盒购自宝生物工程(大连)有限公司。
4.统计学处理:应用SPSS 16.0软件进行统计学分析。采用 Shapiro-Wilk 正态性检验考察计量资料的分布,偏态资料以M(P25,P75)表示,组间比较采用Kruskal-Wallis秩和检验,化疗前后比较采用Wilcoxon配对秩和检验。生存曲线分析采用Kaplan-Meier方法,并进行Log-rank检验。P<0.05为差异有统计学意义。
二、结果
1.胰腺癌患者化疗疗效:169例患者接受一线或二线药物化疗后获得有效随访146例,有效随访率为86.4%。依据RECIST标准,无CR病例,PR 91例,SD 39例,PD 16例。
2.胰腺癌患者化疗前后血清miR-27a水平变化:146例胰腺癌患者化疗前血清miR-27a水平为1.75(1.09~2.22),化疗后为2.88(0.91~4.43),化疗后较化疗前显著升高,差异有统计学意义(Z=-4.609,P< 0.001)。
3.胰腺癌患者化疗前后血清miR-27a水平变化与化疗疗效的关系:化疗前91例PR组和55例SD+PD组患者血清miR-27a水平分别为1.75(1.27~2.36)和1.83(0.95~2.19),差异无统计学意义(Z=-1.018,P=0.309)。化疗后PR组和SD+PD组患者血清miR-27a水平分别为3.90(2.96~5.21)和0.78(0.63~1.03),化疗后PR组显著高于化疗前,而SD+PD组水平显著低于化疗前,差异均有统计学意义(Z=-6.325,P<0.001;Z=-4.505,P<0.001)。此外,化疗后PR组血清miR-27a水平显著高于SD+PD组,差异也有统计学意义(Z=-7.821,P<0.001)。
4.血清miR-27a水平变化与患者生存时间的关系:至随访结束,146例患者存活时间为3~29个月,中位生存期为10.2个月,其中6个月、1年生存率分别为75.4%、52.8%。根据化疗后血清miR-27a水平升高或下降将146例患者分为化疗后升高组和下降组。81例升高组患者的平均生存时间为12.4个月,65例下降组患者的平均生存时间为8.6个月,升高组总体生存时间显著长于下降组,差异有统计学意义(Z=8.241,P=0.001,图1)。
讨论胰腺癌是一种较常见的恶性肿瘤,恶性度高、疗效欠佳、预后差,5年生存率小于5%。目前根治性切除是胰腺癌患者的首选治疗方式,但由于早期诊断率低,仅有不到20%的患者存在根治性切除的手术机会。许多研究结果显示,胰腺癌辅助化疗对提高患者生活质量,改善患者预后均具有重要意义[6]。但由于个体差异加之缺乏准确的化疗疗效评价体系,传统经验化疗所取得的效果并不令人满意。为提高化疗疗效,改善患者预后,针对胰腺癌患者实施系统性、综合性、个体化的规范诊治已成为临床化疗的方向和趋势[7]。
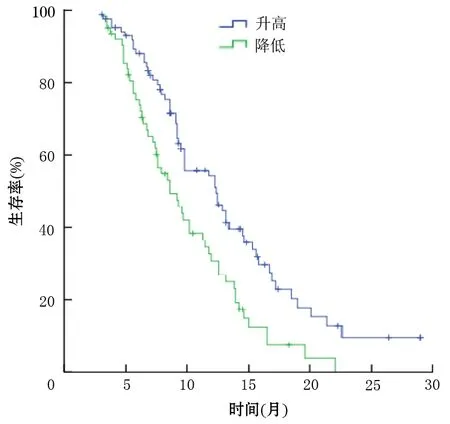
图1 化疗后血清miR-27a水平升高及降低组患者的Kaplan-Meier生存曲线
本研究结果显示,146例胰腺癌患者血清miR-27a水平在化疗后总体显著升高,其中PR组患者血清miR-27a水平在化疗后显著升高,而SD+PD组患者化疗后显著下降,且化疗后PR组显著高于SD+PDF组,而化疗前PR组和SD+PD组患者血清miR-27a水平差异无统计学意义,提示血清miR-27a水平有可能成为评估胰腺癌化疗疗效的血清学标志物。血清miR-27a水平升高可能与化疗药物诱导胰腺癌细胞发生凋亡,释放大量miR-27a进入血循环所致。
根据Kaplan-Meier生存分析结果,化疗后血清miR-27a水平升高的81例患者的平均生存时间显著长于血清miR-27a水平下降的62例患者,与Wang等[8]报道的血清miR-638水平对非小细胞型肺癌患者具有重要的临床应用价值结
果一致,提示血清miR-27a也可能成为评估胰腺癌患者预后的潜在的血清学标志物。
参 考 文 献
[1] Esquela-Kerscher A, Slack FJ. Oncomirs-microRNAs with a role in cancer[J]. Nat Rev Cancer, 2006, 6(4):259-269. DOI: 10.1038/nrc1840.
[2] Feng B, Wang R, Chen LB. MiR-100 resensitizes docetaxel-resistant human lung adenocarcinoma cells (SPC-A1) to docetaxel by targeting Plk1[J]. Cancer Lett, 2012, 317(2):184-191. DOI: 10.1016/j.canlet.2011.11.024.
[3] Zhang H, Li M, Han Y, et al. Down-regulation of miR-27a might reverse multidrug resistance of esophageal squamous cell carcinoma[J]. Dig Dis Sci, 2010, 55(9):2545-2551. DOI: 10.1007/s10620-009-1051-6.
[4] Huang S, He X, Ding J, et al. Upregulation of miR-23a approximately 27a approximately 24 decreases transforming growth factor-beta-induced tumor-suppressive activities in human hepatocellular carcinoma cells[J]. Int J Cancer, 2008, 123(4):972. DOI: 10.1002/ijc.23580.
[5] Xiaohong Z, Li Y, Jianguo H. Down-regulation of miR-27a might inhibit proliferation and drug resistance of gastric cancer cells[J]. J Exp Clin Cancer Res, 30. DOI: 10.1186/1756-9966-30-55.
[6] van Tienhoven G, Gouma DJ, Richel DJ. Review: Neoadjuvant chemoradiotherapy has a potential role in pancreatic carcinoma[J]. Therc Adv Med Oncol, 2011, 3(1):27-33. DOI: 10.1177/1758834010383150.
[7] 赵玉沛. 胰腺癌诊断与治疗的现状与未来[J]. 中华肝胆外科杂志, 2009,15(5):321-323. DOI: 10.3760/cma.j.issn.1007-8118.2009.05.001.
[8] Wang F, Lou J-f, Cao Y, et al. miR-638 is a new biomarker for outcome prediction of non-small cell lung cancer patients receiving chemotherapy[J]. Exp Mol Med, 2015, 47(5):e162. DOI: 10.1038/emm.2015.17.

