鹿茸多肽蛋白的提取及功能研究
高 冷,王昊天,牛晓晖,杨富雅,吕思丞,高晓晨
(1.长春工业大学,长春 130012;2.长春中医药大学,长春 130117)
鹿茸是雄鹿软骨形态没有形成坚硬骨质形态的嫩角,自古以来就是我国名贵的中药。《本草纲目》中曾有记载,鹿茸能生精补髓, 养血益阳, 强筋健骨,鹿茸中含有多种生物活性物质, 能够有助于受损机体的愈合调节作用,能促进新陈代谢,预防和治疗多种疾病[1]。但是鹿茸的化学和药理学研究并不深入,无法确定鹿茸的准确服用剂量和其能治疗的病症[2]。目前已知对生物细胞组织有效果的物质为多肽和蛋白质,而鹿茸中50%以上是蛋白类物质[3]。然而传统的热提取方法对鹿茸蛋白破坏较大,严重影响了鹿茸的药用功能,因此,寻找到一种更好的方法来提取,不但能提高鹿茸蛋白的药性,还能节省原料[4]。本研究通过用不同的方法来提取鹿茸多肽蛋白并加以比较,确定较佳的提取工艺,并对提取的鹿茸蛋白进行蛋白酶酶解处理,之后对鹿茸多肽蛋白的抗感染效果进行研究[5]。
1 实验材料
1.1原料 鹿茸样品取自长春双阳梅花鹿场4年生梅花鹿;碱性蛋白酶购自北京鼎国昌盛生物技术有限公司;中性蛋白酶购自北京奥博星生物技术有限公司;胃蛋白酶购自中国盛世生物有限公司;NIH3T3细胞来自中国科学院长春应用研究所。
1.2实验仪器 冷冻干燥机购自北京松原华兴科技发展有限公司,旋转蒸发仪购自上海豫康科教仪器设备有限公司,超声提取机购自 宁波新芝生物科技股份有限公司。
2 实验方法
2.1超声法提取鹿茸蛋白 分别称取1 000 g、2 000 g、3 000 g新鲜鹿茸剥皮,用切片机切成1~2 cm厚的薄片。称取一定量鲜鹿茸放入超声仪器中,并加入50%的酒精水溶液直至没过鹿茸5~10 cm,在20℃的温度下超声24 h。之后过滤,将滤液放入旋转蒸发仪中浓缩,为保证不发生蛋白变性影响实验,温度一般选在80℃以下。将滤液浓缩到1 L左右后取出,倒入托盘中,放入干燥箱80℃干燥直至水分完全蒸干,取出用粉碎机磨粉过80目筛,称重并密封保存[6]。
2.2CO2超临界萃取法提取鹿茸蛋白 新鲜鹿茸剥皮切片,称重后放入- 40℃冰箱冷冻24 h。待其冷冻完全,放入冷冻干燥机干燥24 h,直至鹿茸切片发白,水分少于3%停止干燥。用粉碎机粉碎成粉,并过80目筛,放入CO2超临界萃取装置萃取桶中。在以压力为20 mPa,温度为20℃,流速为20的条件下萃取,得到鹿茸蛋白。
2.3细胞复苏 把冷冻好的细胞从- 80℃的冰箱中迅速取出,将其放置在恒温水浴锅中,水温为细胞适宜的37℃,等到冻存管内的液体融化完全后,将其加入15 mL的离心管中,同时把4 mL细胞培养液缓缓加入离心管中,再将装好细胞的离心管放入离心机中,设置转速为1 000 r/min,离心5 min,把1 mL培养液用移液枪加入,并向其吹匀,将细胞放于培养皿中,培养皿中加入9 mL培养液和1 mL血清。
2.4细胞传代 等到培养皿的80%以上都铺满所培养的细胞后,弃掉培养皿中全部的培养基,向其中加入胰酶2 mL,在37℃的条件下,让其消化2~5 min,降解细胞之间结合处蛋白,使之不再黏连贴壁,向其加入1 mL血清和3 mL培养基用移液枪吹起,将其加入到15 mL的离心管中,并放入离心机离心,将沉淀用3 mL培养液吹起,把它们分成3份,分别放入3个培养皿中培养。
2.5细胞冻存 1 mL冻存体系为500 µL血清、400 µL培养液和100 µL DMSO。冻存液要在实验之前配置好,现用现配。把已经不在黏连的细胞放置于冻存液当中,之后放于- 20℃冰箱存储冷冻2 h,然后将其转到- 80℃冰箱中。
2.6MTT实验 1)接种细胞[7],单个细胞悬液的配置,须由10%胎小牛血清的培养液配成,并将其接种到96孔板中,其中每孔中有1 000~10 000个细胞,每个孔的体积是200 µL。2)培养细胞,培养细胞生长,直到其黏连贴壁,在每个孔中加入各种鹿茸多肽蛋白,其质量为5 mg,之后培养24 h。3)呈色,培养细胞24 h后,每个孔中加MTT溶液(用5 mg/mL PBS配制,pH = 7.4)20 µL,连续培养4 h。之后停止培养,小心吸出孔内的培养液上清液,并将其弃掉,若发现孔中有细胞悬浮,则需要将其以1 000 r/min离心5 min,之后再吸出孔内培养上清液。每孔中加入150 µL DMSO,振荡10 min,能充分融解孔内的晶体物质。4)比色,波长的选择为490 nm,测定各孔的吸光度,测试仪器为酶联免疫检测仪。把时间设为横坐标,纵坐标为吸光值来绘制细胞生长曲线。
2.7NIH3T3细胞实验[8]1)将NIH3T3细胞分到96孔板中,每孔各加入105个NIH3T3细胞,之后在向每孔中加含10%胎牛血清的半DMEM培养液200 µL,之后放置在CO2培养箱中,以温度设为37 ℃、CO2浓度设为5 %,在此条件下培养24 h。2)吸出上清液,并向每孔中加入包含浓度为0.5%胎牛血清的培养液200 μL,之后放置在CO2培养箱中,培养温度为37 ℃、CO2浓度为5 %,在此条件下培养24 h。3)把终浓度为1 mmol/L的阿司匹林加入各孔中,之后放置在CO2培养箱中培养,培养温度为37 ℃、CO2浓度为5%,在此条件下培养30 min。4)丢弃掉上清液,用PBS液(200 μL)冲洗每个孔,之后向每个孔中加入200 μL的10%血清半DMEM培养液,以温度为其最适宜的37 ℃、CO2浓度为5%的培养环境下培养3 h。5)向每个阳性对照孔中分别加入相同质量的罗非昔布,阴性对照组不给药,加药孔分别加入不同质量的鹿茸水解总蛋白、胃蛋白酶水解鹿茸蛋白、中性蛋白酶水解鹿茸蛋白和碱性蛋白酶水解鹿茸蛋白(0.5、1、2.5、5 mg),37℃、5%CO2环境下培养30 min。6)分别向每个孔中加入终浓度为2 µmol/L的花生四烯酸溶液,以温度为37 ℃、CO2浓度为5%的培养环境下培养15 min。7)与ELISA试剂盒操作相同。
2.8PGE2 分泌量检测 1)样品制备:吸取加鹿茸多肽蛋白的细胞培养基上清液50 μL。2)加样:各设置空白孔(空白对照孔不加入样品和酶标试剂)、标准孔和待测孔。在标准品孔中精确加入50 μL的标准样品,将50 μL待测样品加入待测孔中。样品需加入酶标板的底部,尽量不触及孔壁,轻轻摇晃,使其充分混合[9]。3)温育:用 封板模封板后置于37 ℃温育30 min。4)配液:将浓缩30倍的洗涤液用蒸馏水稀释30倍后,放于一旁备用。5)洗涤:小心揭掉封板模,丢弃掉其中液体,甩干,向每个孔中加入洗涤液直至加满,静置30 s后弃去洗涤液,如此往返重复5次,拍干。6)加酶:向每个孔中加酶标试剂各50 μL,空白孔不加。7)温育:用封板模封板后置于37 ℃温育30 min[3]。8)洗涤:小心揭掉封板模,丢弃掉其中液体,向每个孔中加入洗涤液直至加满,静置30 s后弃去洗涤液,如此往返重复5次,拍干。9)显色:先将50 μL显色剂A分别加入每一个孔中,然后向每孔中再加入50 μL显色剂B,之后将两者轻轻震荡使其混合均匀,将其置于37 ℃条件下避光显色15 min[2]。10)终止:将50 μL终止液分别加入每个孔中以终止反应 (此时溶液会由蓝色变成黄色)。11)测定:以空白孔为零,波长为450 nm,测量各孔的吸光度。测定须在各孔加终止液后15 min内进行。
3 结果
3.1鹿茸蛋白提取结果比较 见表1~2及图1。
如表1及图1所示,在其它条件相同的条件下,其中CO2超临界萃取提取率要略高于用超声法提取鹿茸蛋白,提取率高1.0%,所以较佳的提取方法是CO2超临界萃取法提取鹿茸蛋白。
3.2鹿茸多肽蛋白抗感染效果 见表2。

表1 超声法与CO2超临界萃取法提取鹿茸蛋白提取率
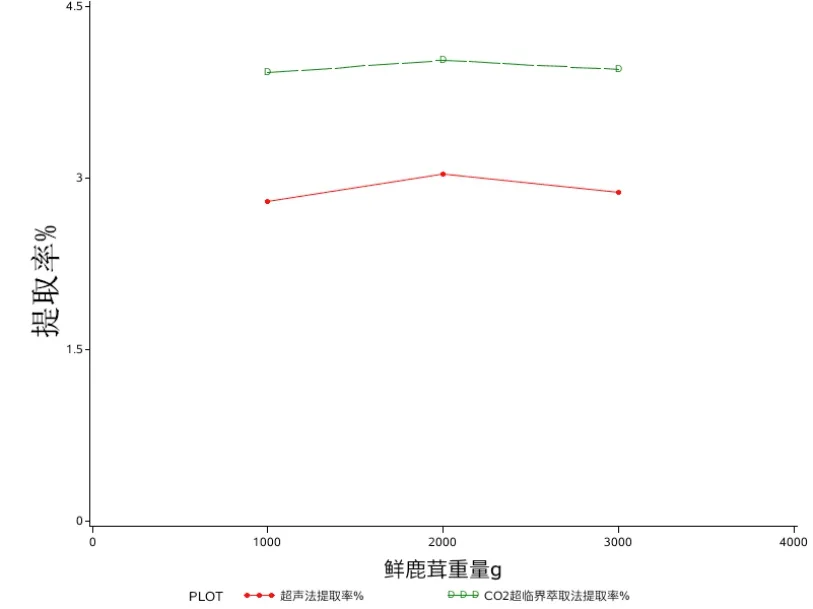
图1 超声提取与CO2超临界萃取提取率
如表2所示,用体外的细胞实验表明,检测NIH3T3细胞生成的PGE2浓度来计算鹿茸多肽蛋白的抗感染效果,并将其与罗非昔布进行对比。发现鹿茸多肽蛋白在以NIH3T3 为实验模型时,当干粉给药20 mg时,与阳性药物罗非昔布抗炎效果相当,50 mg时鹿茸多肽蛋白的抗感染效果要高于罗非昔布。
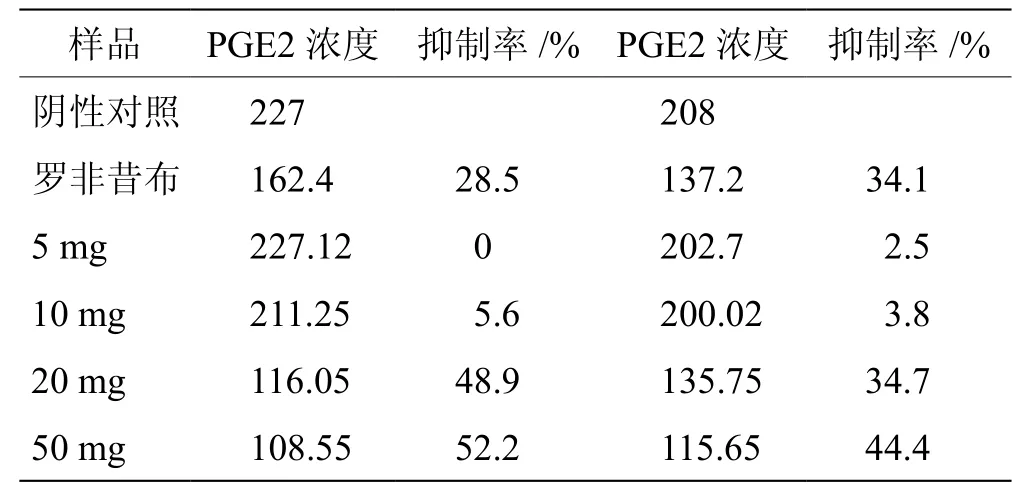
表2 鹿茸多肽蛋白抗感染效果检测(NIH3T3细胞) pg/mL

表3 各酶解鹿茸多肽蛋白抗感染效果检测(NIH3T3细胞) pg/mL
如表3及图2所示,NIH3T3体外实验表明,NIH3T3生成的PGE2浓度可以折算成其抗感染效果,计算并将其与罗非昔布进行对比。各酶解鹿茸蛋白在给药20 mg时,酶解鹿茸蛋白抗感染效果:酶解鹿茸总多肽蛋白>中蛋白酶酶解鹿茸多肽蛋白>胃性蛋白酶酶解鹿茸多肽蛋白>碱性蛋白酶酶解鹿茸多肽蛋白。在所有酶解鹿茸多肽蛋白中,酶解鹿茸总多肽蛋白抗感染效果要好于其他媒介鹿茸多肽蛋白。

图2 酶解鹿茸蛋白提取物细胞抗感染效果检测(NIH3T3细胞)
3 讨论
在超声波法取鹿茸多肽蛋白和CO2超临界萃取法提取鹿茸蛋白的实验中较佳的提取方法是CO2超临界萃取法,其较之超声法提高率高,提取率有显著差异。NIH3T3体外实验表明,检测NIH3T3细胞生成的PGE2浓度来计算鹿茸多肽蛋白的抗感染效果,并将其与罗非昔布进行对比。各酶解鹿茸蛋白在给药5、10 mg时,酶解鹿茸总多肽蛋白的抗感染效果不明显。但是各酶解鹿茸蛋白在给药20 mg时,酶解鹿茸蛋白抗感染效果:酶解鹿茸总多肽蛋白>中蛋白酶酶解鹿茸多肽蛋白>胃性蛋白酶酶解鹿茸多肽蛋白>碱性蛋白酶酶解鹿茸多肽蛋白,酶解鹿茸总多肽蛋白抗感染效果要好于其他媒介鹿茸多肽蛋白。

