全光学光声/OCT双模态成像系统及其应用
许晓慧,周王婷,陈重江*
(1.广州工商学院电子信息工程系,广东 佛山 528138;2.华南师范大学, 生物光子学研究院激光生命科学研究所、暨激光生命科学教育部重点实验室,广东 广州 510631)
光声成像(photoacoustic imaging)技术已经成功地应用于皮下微血管结构成像、功能成像和早期的肿瘤监测中,其具有很高的灵敏度和特异性,并拥有光学成像无法比拟的成像深度[1-5],这都得益于光声成像高度依赖于组织的光学吸收和以超声信号作为信息载体的特性。然而,对于弱吸收物质,光声成像提供的有效信息相对较少,通常需要其他的成像方式加以判别。光学相干层析成像(optical coherence tomography, OCT)是一种相对成熟的无损成像方式,它的成像原理是检测由样品臂和参考臂反射回来干涉光信号来实现组织成像的。OCT的优点是对组织的散射结构有很高的灵敏度,但是缺少生物组织的光学吸收信息,它已经成功应用于眼科的临床实践和血管内成像[6]。由于OCT依赖于生物组织的光散射特性,因而OCT的成像深度一般不超过2 mm[7]。综上所述,光声成像和光学相干层析成像在获取生物组织结构特性上和生理参数上可以实现优势互补;同时,光声成像可以弥补光学相干断层扫描成像在成像深度上的不足。
近几年来,已有科研人员开始探索如何实现光声成像和OCT这两种成像方式的结合。他们中有把光声成像系统和OCT系统做了一个简单拼接,依然使用超声换能器通过使用耦合介质来接收光声信号[8-12]。这样简单的组合会导致系统成本的上升,在一些特殊应用场合这种简单的组合并不适用,比如对一些敏感部位的检测,包括眼睛、创口等等。到目前为止,还没有人成功的用光学的方法把光声成像和光学相干层析成像两者有机结合起来。之前的研究有涉及到使用透明的高分子薄膜构成的法布里珀罗标准具来检测超声波,同时进行光学相干层析成像[13];由于法布里珀罗标准具的灵敏度较低,因而探测器还是需要和被测组织直接接触。另外,也有研究中使用波分多路复用器来实现全光学的光声成像和光学相干层析成像的整合[14],也有使用同一个迈克尔逊干涉仪来实现光声与光谱OCT双模态成像[15],但是他们的系统中光声探测系统和光学相干层析成像系统依然还是相互独立的。
非接触式光学探测超声的方法是一种全新的超声探测方式,这种探测方式对超声有很高的探测灵敏度。近年来,越来越多的研究者倾向于使用光学方法来探测样品表面振动速度和位移来达到检测超声的目的[16-18],这种探测方式已经被用于生物医学领域的光声成像[19,20]。由于越来越多的光学探测超声方法的出现,这也为光声成像和光学相干断层扫描成像集成在一个系统上提供了可能[19-21]。
本文中,我们提出了一种新型的全光学集成的光声/OCT双模成像系统,该系统利用同一个低相干迈克尔逊干涉仪即可实现光声成像和OCT于一体的双模成像系统,该系统装置结构简单,可同时非接触式地获取生物组织的吸收与散射结构信息。并将该系统应用于基底细胞癌(BCC)的检测中,获得了初步的研究结果。
1 方法与装置
图1为光声/OCT双模态成像系统装置图。光声激发源为532 nm、脉宽为10 ns的脉冲激光器(HLX-I-F005, Horus Laser),脉冲激光通过空间滤波系统耦合进单模光纤后经过准直镜并通过二向色镜与OCT的激发光合成一束,然后经物镜聚焦到样品上。由于光声/OCT双模态成像系统中光声信号的检测及OCT相干信号检测使用的是同一套迈克尔逊干涉仪及信号探测系统,因而需要在时间上对这两个信号进行错位检测。系统具体运行过程如下[22]:开始时,快速扫描光学延迟线被设定在平衡位置,即参考臂的光程长度与样品臂的光程长度相等,此时迈克尔逊干涉仪工作在零差模式。根据参考文献[21]中对光学超声检测法的要求,系统控制程序启动PCI-1716采集卡监测此时迈克尔逊干涉仪的过零点情况,并触发脉冲激光器,然后光声显微子系统开始运行工作,光声信号通过数据采集卡(NI-5124)进行采集。由于光声信号是加载在周围环境振动的低频信号上的,需加高通滤波器消除载波信号。光声信号完成采集后,快速扫描光延迟线开始对样品进行轴向扫描并触发采集卡,进而光学相干信号也开始被数据采集卡接收。OCT完成一次采集后,快速扫描光学延迟线回到平衡位置,二维扫描振镜移动到下一个位置,这样就可以交替的获得光声信号和光学相干信号并进行成像扫描,系统工作时序图如图2所示。实验中为了进一步提高光声显微系统对光声信号探测的灵敏度,在样品成像区域覆盖了一层厚度约为几百微米的油层,来减少样品表面粗糙造成的散射影响确保样品表面的粗糙度在光源的相干长度之内[23]。

图1 光声/OCT双模态成像系统装置图Fig.1 The setup of dual-mode photoacoustic and optical coherence tomography imaging system

图2 光声/OCT双模态成像系统工作时序图Fig.2 Timing diagrams of the dual-mode photoacoustic and optical coherence tomography imaging system
2 结果与讨论
2.1 系统性能验证
为了验证系统的成像能力,我们分别测试了光声成像子系统及光学相干层析成像子系统。首先,我们对埋在1%的琼脂凝胶中的一簇直径为6 μm的碳纤维进行了光声成像,结果如图3(a)所示。从结果中可以看出光声成像子系统可以清晰地成像碳纤维丝,且具有较高的对比度及分辨率。图3(b)是厚度为170 μm的盖玻片的B扫OCT图像,盖玻片的上下边界可以被清晰地显示出来,且边界间距大小与170 μm是一致的。以上实验结果表明该系统是可以实现光声成像及光学相干层析成像的。

图3 (a)碳纤维丝的光声图像; (b)盖玻片的OCT 的断层图像Fig.3 (a) The photoacoustic image of carbon fibers;(b) the B-scan OCT image of cover glass
2.2 模拟实验验证
接下来,我们验证光声/OCT双模成像系统在散射介质中同时成像的能力。我们用1%的琼脂凝胶模拟组织的高散射背景,并在琼脂的不同深度处插入四根黑色头发丝。成像模式设置为光声、OCT同时成像,即先读取光声信号再读取OCT信号,这样依次采集,最终获得光声及OCT图像。图4(a)展示了四根黑色头发的光声B扫图像,而无法看到琼脂的信号。这是因为光声成像是基于组织对光的吸收成像,黑色头发因包含浓度较大的黑色素所以产生了较强的光声信号,但是琼脂在532 nm波长处无光吸收,因而光声成像无法看到散射介质琼脂的。OCT的B扫图像中(图4(b))能够同时清晰地看到四根头发以及琼脂表面的边界。图4(c)和4(d)分别展示的头发丝的光声信号和OCT信号。图4(d)为图4(b)的一个A扫信号,从A扫信号中可以看到琼脂凝胶的强散射边界以及头发丝与凝胶接触的边界信号。模拟实验结果表明全光学光声/OCT双模态成像系统可以同时获得散射介质的吸收和散射结构信息。
2.3 光声/OCT双模态成像系统的应用
为了证明光声/OCT双模态成像系统具有成像活体生物组织的能力,我们用该双模态系统应用于老鼠耳部组织的成像中。在实验之前,用脱毛剂脱去老鼠耳部的毛发。给老鼠注射戊巴比妥钠(注射剂量40 mg/kg,追加剂量10 mg/kg/h)使老鼠在实验过程中保持静止。为了使小鼠皮肤不被脉冲激光灼伤,保证在美国国家标准协会规定的激光能量安全阈值20 mJ/cm2范围内[24],在实验中照射在小鼠皮肤表面的激光能量密度控制在10 mJ/cm2以下。图5(a)展示了小鼠耳朵组织的光声图像,清晰地显示了小鼠耳朵部位的微血管网络结构信息。图5(b)和5(c)分别是光声和OCT的B扫描图像,对应于图5(a)中的虚线位置。光声B扫图中可以提取到血管的位置分布及血管大小等信息;从OCT B扫图中可以估算出老鼠耳部的厚度大概在500 μm左右,并且可以清晰识别耳朵的上皮、真皮和软骨组织结构。图5(d)为光声和OCT的B扫描图像的融合图像,从图中可以确定血管在组织中位置分布情况。
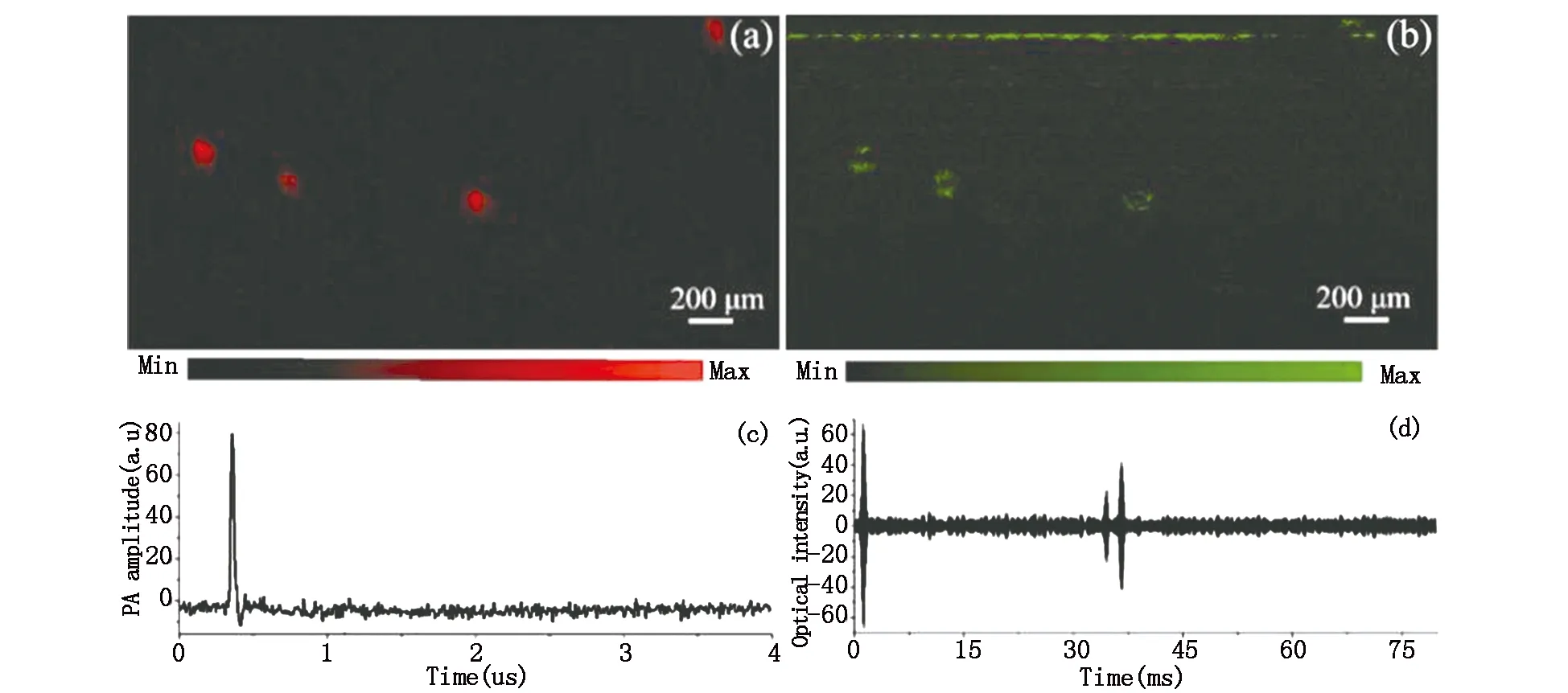
图4 (a)光声B扫图像; (b)OCT B扫图像; (c)头发丝的光声信号图; (d)头发丝及琼脂的OCT信号图Fig.4 (a)Photoacoustic B scan image of human hair;(b)OCT B scan image of human hair;(c)The photoacoustic signal of human hair;(d) The OCT signal of human hair and gel

图5 (a)光声血管网络图像; (b)光声B扫图像; (c)OCT B扫图像; (d)光声/OCT融合图Fig.5 (a)The photoacoustic image of microvasculaure;(b)Photoacoustic B scan image of blood vessels;(c)OCT B scan image of mouse ear;(d)Fused photoacoustic and OCT B-scan image

图6 (a)基底细胞癌的光声血管网络图像; (b)正常部位的OCT B扫图像; (c)基底细胞癌区域的OCT B扫图像Fig.6 (a)The photoacoustic image of BBC microvasculaure;(b)OCT B scan image of normal area;(c)OCT B scan image of BCC
进一步地,我们将该系统用于基底细胞癌的检测中。基底细胞癌是皮肤病中发病率最高的一种肿瘤,一般不致命,但可以导致局部破坏性,当肿瘤细胞扩散到周围组织,会引起并发症。由于基底细胞癌发生在头面部占70%-90%,如果未能早期发现或盲目创伤性诊疗,可引起病灶复发甚至毁容等严重后果。流行病学资料显示基底细胞癌的发病率在全球迅速增加,目前,这种病已经趋于年轻化并已成为人们广泛关注的公共卫生问题[25],因而早期检测显得尤为重要。由于基底细胞在生长发展过程中表现为血管的形状及瘤体周围胶原基质分布的变化[26],光声成像对于血管成像具有天然优势,OCT对胶原成像比较敏感,因而,光声/OCT成像非常适合基底细胞癌的检测。实验中,我们将TE354.T基底细胞癌细胞接种在小鼠耳朵皮层下,由于基底细胞癌生长较为缓慢,在接种基底细胞癌细胞后将小鼠每天定时定量进行紫外灯照射,促进基底细胞癌的生长。如图6所示为接种14天后小鼠耳部的光声/OCT成像结果。图6(a)为小鼠耳部血管网络的光声图像,其中绿色圆圈内为基底细胞癌肿瘤区域,可以看到肿瘤区域血管相对正常部位密集且成树枝状分布,这是基底细胞癌诊断的重要标志[26]。图6(b)和6(c)分别对应图6(a)中正常和肿瘤处的OCT B扫图像。图6(b)显示的为小鼠耳朵正常部位结构,可以清晰地看到上皮、真皮和软骨组织。图6(c)中绿色箭头所指的区域为基底细胞癌肿瘤实体,这是因为肿瘤实体周围有一层胶原基质层,而胶原基质的折射率高于其它组织,因而基底细胞癌实体的OCT图像表现为边界亮而中间区域暗的特点。此外,从图中也可以看到成分立状的基底细胞癌实体,这与基底细胞癌的特性是一致的[26]。
2.4 讨论
上述实验结果表明,该双模成像系统可以高分辨率成像模拟样品及生物组织,并成功地应用到了基底细胞癌的检测中,这将有助于促进光声/OCT双模成像系统在生物医学上的应用。一般来说,吸收和散射系数是组织的重要参数,由于生物体的病变都会导致吸收和散射系数的变化,我们可以通过提取组织的吸收和散射的信息来判断其病理变化情况。此外,由于我们使用的是非接触式光声检测方法,因而我们的光声/OCT双模成像系统可以方便地用于眼科、皮肤科等疾病诊断。
3 结论
本文中,我们开发了一套基于单个迈克尔逊探测器的全光学非接触式光声/OCT双模成像系统,模拟和活体动物实验证明该双模成像系统具有高分辨率和高对比度成像微血管及其他组织结构信息的能力,并将该系统成功地应用到了基底细胞癌的检测中。此外,光声/OCT双模成像系统运用了小型脉冲微片激光器作为光声的激发源,并使用全光纤迈克尔逊干涉仪作为光声信号探测以及OCT的成像设备,由于他们的体积都非常小,因而双模式系统可以很容易地集成与携带。所有这些实验结果表明,这套基于全光学检测的光声/OCT双模态成像系统具有一定的临床应用潜力。
——随钻钻孔电磁波层析成像超前探水设备及方法研究

