乌头碱在斑马鱼胚胎和幼鱼发育过程中的神经毒性作用
王翀昊,王心童,朱 娜
(1.首都医科大学附属北京天坛医院 神经外科,北京100050;2.吉林大学中日联谊医院 神经内科;3.中国疾病预防控制中心病毒病预防控制所)
乌头碱为双酯类生物碱,具有很强生理活性;药理学研究表明其具有抗炎、麻醉镇痛、扩血管降压、抑制肿瘤生长等药理作用[1];尤其在外用镇痛方面有其独到之处,是蒙药常用的制剂之一。但乌头碱的毒性比较大,0.2 mg即可使人中毒,3-5 mg即可致死[2];外用药亦可通过皮肤累积吸收[3]。因此,乌头碱的毒性研究一直是人们关注的热点。乌头碱的心脏毒性目前已被广泛和系统的研究,但其神经毒性方面的研究较少,大多集中在临床病例报道和症状描述方面,只有少数实验以胎鼠为模型进行了验证[4,5],缺乏低剂量积累造成的慢性毒理研究,也缺乏乌头碱神经毒性的机制探索。
近年来,人们研究发现斑马鱼作为模式生物进行神经毒性研究具有其他生物不可比拟的优势:斑马鱼神经形成过程和机制以及对于药物的反应都与人具有高度相似性;与哺乳动物相比,斑马鱼的繁殖周期短、实验成本低;斑马鱼胚胎通体透明,可直接应用显微镜观察其神经细胞等。因此斑马鱼作为脊椎动物模型广泛应用于药物神经毒性的研究[6-8]。本研究以斑马鱼为实验模型,动态研究乌头碱在胚胎及幼鱼发育早期的神经毒性,并初步探讨乌头碱神经毒性的可能作用机制,为乌头碱的安全应用提供科学依据。
1 材料与方法
1.1 实验药物
乌头碱购于Target Mol公司,纯度≥98%,分子式C34H47NO11,母液溶解于二甲基亚砜(DMSO)中,再以斑马鱼胚胎培养液稀释至实验所需浓度,DMSO终浓度≤0.1%。
1.2 斑马鱼饲养和鱼卵采集
实验AB系斑马鱼,鱼体长(30±5)(x±s)mm,体质量(0.20±0.05)(x±s)g,取自北京大学生命科学研究院。参照Westerfield的方法养殖并繁殖斑马鱼。光周期14 h/10 h,水温控制在(28±1)℃,溶解氧不低于4 mg/L,正常喂食,每天2次。成鱼雌雄分开饲养。实验前16 h将亲鱼(雌雄比例1∶1)放入交配缸,次日晨取隔板使其自然交配。受精后6 h镜下检查,确定发育阶段并选择正常受精卵备用。
1.3 游泳行为观察
将受精后6 h斑马鱼胚胎置于12孔板(20颗/孔)中,每孔分别加入4 ml的0 μM,0.1 μM,0.5 μM,1 μM,10 μM,100 μM 的乌头碱溶液,每天更换1/2体积相应浓度的乌头碱溶液至受精后96 h。将直径为10 cm的培养皿放置在如图1A所示圆圈的薄板上,在显微镜下随机选择各浓度组的受精后96 h斑马鱼幼鱼,将幼鱼放置于圆心位置,用探针轻触幼鱼尾部,选择每个浓度组幼鱼10条,每条触动20次。记录在测试周期内幼鱼连续游泳时穿越交叉线和内同心圆线的次数。幼鱼游泳活力与单位时间内幼鱼所游过的距离正相关[9]。
1.4 乙酰胆碱酯酶活测定
显微镜下剥离不同浓度乌头碱作用的斑马鱼脊索,30条/组。加入5倍体积蛋白匀浆液(Tris-Cl 100 mmol/L,NaCl 50 mmol/L,KCl 30 mmol/L,EDTA 2 mmol/L,PMSF 2 mmol/L,1% Triton X-100,pH 7.5)冰上匀浆每组斑马鱼脊索组织,4℃ 800 g离心10 min;取匀浆液上清待测乙酰胆碱酯酶活性。具体参照Ellman的方法[10]。AChE活性单位定义:每毫克组织蛋白在37℃保温6 min,水解体系中1 μmol 底物为1 个活力单位。按如下公式计算AChE 活力。组织匀浆中AChE 活性(U/mg Pr)=(OD 样品-OD 对照)/(OD 标准-OD 空白)×1/样品总蛋白浓度。
1.5 统计学处理实验数据
2 结果
2.1 乌头碱抑制幼鱼游泳活力
分别以不同浓度的乌头碱培养液(0 μM,0.1 μM,0.5 μM,1 μM,10 μM,100 μM)于胚胎期(0-4 d)持续给药,然后换到正常培养液中,观察幼鱼5-8 d的游泳行为。结果发现,随着乌头碱浓度的增加,幼鱼游泳活力逐渐减弱。如图1所示,随着幼鱼发育时间的推进,幼鱼在5-8天穿越交叉线次数逐渐降低。当乌头碱浓度为0.1 μM时,幼鱼穿越交叉线次数与无药物组没有明显差别,但乌头碱浓度达到0.5 μM,1 μM,10 μM,100 μM时,幼鱼在5-8天穿越交叉线的次数与浓度与对照组相比在各个相应时期均有明显差别。说明乌头碱在达到一定浓度时,会抑制斑马鱼幼鱼游泳活力。
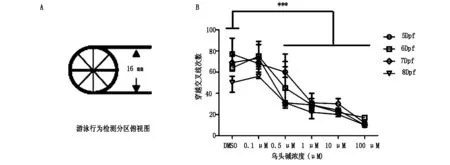
图1 不同浓度乌头碱溶液中斑马鱼穿越交叉线次数 (A)游泳行为检测分区俯视图 (B)不同浓度乌头碱中斑马鱼穿越交叉线次数
2.2 乌头碱导致幼鱼躯干肌发育萎缩
对照幼鱼的体肌节内肌纤维排列整齐,两种肌纤维分化明显,其中白肌纤维数量占有明显优势 (图2A)。暴露于低剂量(0.1 μM)的乌头碱的环境中,肌纤维的排列和肌节长度都没有明显地改变(图2B)。乌头碱浓度达到1 μM,时,幼鱼躯干肌节内白肌纤维数量减少,但仍然可以看到分化的红白肌纤维(图2C);但乌头碱剂量增至100 μM时,肌纤维的分化不再显著,(图2D)。在图2E中,当乌头碱暴露浓度高于0.1 μM时,躯干肌节的长度(0.5 μM,0.224±0.005 mm;1 μM,0.209±0.003 mm;10 μM,0.179±0.003 mm;100 μM ,0.137±0.004 mm) 明显短于对照幼鱼(0.254±0.006 mm)。

(A)DMSO(B)乌头碱浓度0.1 μM(C)乌头碱浓度1 μM(D)乌头碱浓度100 μM (E)不同乌头碱浓度导致肌节长度变化统计图
2.3 乌头碱导致Rohon-Beard神经元在发育早期的正常凋亡障碍
如图3相差显微镜照片所示,乌头碱作用于斑马鱼胚胎72 h后,溶剂对照组幼鱼体内几乎观察不到RB神经元,神经管背侧没有出现胞体巨大的细胞(图3A)。当暴露于有乌头碱存在的环境,在幼鱼的神经管背侧可以看到数量不等的RB细胞,其数量随着乌头碱处理剂量增加而上升(图3B-D)。
2.4 乌头碱通过抑制乙酰胆碱酯酶活性对斑马鱼胚胎和幼鱼产生神经毒性
为了揭示乌头碱导致的上述两个组织学异常现象的原因,我们连续检测了乌头碱处理后3个发育时间点(24、48、72hpf)实验幼鱼脊索总AChE活性水平(IU/pro),测量结果汇总于图4中。结果发现,斑马鱼胚胎暴露于乌头碱72 h,乌头碱浓度大于0.5 μM,即可导致孵化后的幼鱼体内的AChE活性显著降低;提示我们乌头碱可降低乙酰胆碱酯酶活性,抑制Rohon-Beard神经元生理性凋亡,从而对斑马鱼幼鱼产生神经毒性。

(A)DMSO (B)乌头碱浓度0.1 μM (C)乌头碱浓度1 μM (D)乌头碱浓度100 μM

图4 乌头碱对斑马鱼脊索神经元乙酰胆碱酯酶活性的抑制
3 讨论
乌头碱具抗炎、麻醉镇痛、扩血管降压、抑制肿瘤生长等药理作用,是临床常见的重要药物;但其中毒剂量很接近药用剂量,因此,用药需谨慎。乌头碱的神经毒性在体外模型上已有初步研究,但其神经毒性缺乏体内动物实验研究。国际上常用斑马鱼作为模型检测药物潜在的神经毒性效应。本研究选择模式生物斑马鱼为动物模型研究乌头碱的神经毒性。结果发现当乌头碱浓度大于0.5 μM时即可表现出轻微的毒性,具体体现在斑马鱼幼鱼游泳活力减弱,肌节发育不良等表型。进一步观察胚胎发育情况,发现乌头碱作用于斑马鱼胚胎72 h,即可导致斑马鱼发育时期正常凋亡的初级感觉神经元(Rohon-Beard神经元)凋亡障碍。乙酰胆碱酯酶在RB神经元凋亡中扮演着重要角色[11],而乌头碱又是乙酰胆碱酯酶的天然抑制剂[12,13],那么乌头碱是否通过抑制乙酰胆碱酯酶活性导致RB神经元凋亡障碍?通过检测暴露于不同浓度乌头碱的斑马鱼胚胎脊索乙酰胆碱酯酶活性,发现浓度大于0.5 μM的乌头碱作用胚胎72 h后即可明显抑制斑马鱼胚胎发育早期脊索组织中乙酰胆碱酯酶的活性;提示我们乌头碱可能通过抑制乙酰胆碱酯酶活性对斑马鱼胚胎和幼鱼产生神经毒性。对于乌头碱神经毒性的研究,还需要更多的动物模型进行体内实验,以便更好的对乌头碱的临床用药进行指导。

