APCDD1对骨髓基质干细胞成脂分化及脂质合成的影响
史亚茹,杨威利,杨俊英,王孝臣,周杰,王宝利
(1天津医科大学代谢病医院·卫生部激素与发育重点实验室·天津市代谢性疾病重点实验室,天津300070;2天津医科大学基础医学院)
骨髓基质干细胞(BMSC)也称骨髓间充质干细胞,是一种具有多向分化潜能的成体干细胞。在不同的诱导条件下,BMSC可分化为脂肪细胞、成骨细胞、软骨细胞和成肌细胞[1]。在BMSC向脂肪细胞或成骨细胞分化的进程中存在着此消彼长的生物学现象[2]。研究发现,骨质疏松、年龄相关性骨丢失等骨代谢疾病中,骨量的减少往往伴随着骨髓腔内脂肪组织的堆积,而由肥胖引起的代谢综合征、血脂异常及2型糖尿病患者骨密度下降,发生骨折的风险显著增加[3,4]。提示脂肪组织的增加与骨形成能力下降关系密切,而脂肪组织的过度堆积与脂肪细胞分化、细胞内脂质合成能力增强有关。结肠腺瘤样息肉下调蛋白1(APCDD1)是脊椎动物进化过程中高度保守的膜结合糖蛋白。研究证实APCDD1是经典的Wnt信号通路的新型抑制剂[5]。APCDD1在脊椎动物的发育过程中发挥重要的生物学功能,而其对BMSC向脂肪细胞分化及脂质合成的作用尚未阐明。2017年5月~2018年5月,本研究以BMSC为研究对象,探讨APCDD1对脂肪细胞分化及脂质合成的作用,以期为骨代谢及肥胖相关代谢性疾病治疗药物的研发提供新靶点。
1 材料与方法
1.1 细胞及试剂 小鼠BMSC系ST2细胞由本实验室保存;感受态细胞DH5α购自北京全式金生物技术有限公司;质粒pcDNA3.1由本实验室保存;高纯度小提试剂盒、无内毒素质粒小提试剂盒以及快速琼脂糖凝胶DNA回收试剂盒均购自北京康为世纪生物科技有限公司;限制性内切酶 BamH Ⅰ、EcoR Ⅰ购自Thermo Fisher 公司;ClonExpress®Ⅱ重组克隆试剂盒购自南京诺唯赞生物科技有限公司;引物合成及测序由生工生物工程(上海)股份有限公司完成;α-MEM培养基、胎牛血清(FBS)购自Hyclone公司;Opti-MEM/Reduced Serum Medium购自Thermo Fisher 公司;转染试剂Attractene Transfection Reagent 购自QIAGEN公司;总RNA提取试剂盒购自GeneMark公司;逆转录试剂盒购自Thermo Fisher公司;胰岛素、地塞米松、3-异丁基-1-甲基黄嘌呤购自 Sigma公司;吲哚美辛为Cyagen 公司产品;油红O染液购自Sigma公司。
1.2 APCDD1基因过表达质粒构建 设计成对PCR扩增引物,APCDD1上游引物: 5′-TTGGTACCGAGCTCGGATCCGCCACCATGTCCCGTGTGCGCCGCCTTCTG-3,下游引物: 5′-GCTGGATATCTGCAGAATTCCTATCTGAGGATGCGCCAATG-3′。以C57 BL/6小鼠肝脏DNA为模板进行PCR扩增。PCR扩增条件:95 ℃ 预变性2 min,95 ℃变性30 s、56 ℃退火30 s、72 ℃延伸30 s共40个循环,72 ℃延伸10 min。将扩增好的PCR产物及线性化的pcDNA3.1空载体(经限制性内切酶 BamH Ⅰ/EcoR Ⅰ双酶切)进行纯化回收,之后用ClonExpress®Ⅱ重组克隆试剂盒于37 ℃重组反应30 min,转化感受态细胞DH5α,均匀涂于LB/氨苄青霉素的固体培养基上,37 ℃培养16 h后挑取单菌落摇菌过液,提取质粒后用BamH Ⅰ/EcoR Ⅰ进行双酶切鉴定,鉴定后测序,测序正确的重组子命名为APCDD1基因过表达质粒。
1.3 ST2细胞培养及转染 取复苏冻存的ST2细胞,用含10% FBS、100 U/mL青霉素、100 mg/L链霉素的α-MEM完全培养基,于37 ℃、5% CO2条件下培养,隔天换液1次。待细胞汇合度至80%~90%时,将其传代培养。转染前1 d,将细胞接种于24孔培养板,待细胞汇合度60%~80%时进行转染。将细胞随机分为空白对照组、实验组与对照组,分别取APCDD1过表达质粒(实验组)、pcDNA3.1质粒(对照组)稀释于Opti-MEM/ Reduced Serum Medium,将质粒混合物轻轻吹打混匀后室温静置5 min,向混合物中加入转染试剂Attractene 1.5 μL/mL,轻轻吹打混匀后室温静置15 min。向24孔板中每孔均匀缓慢地滴加50 μL转染混合物,轻轻混匀后于37 ℃、5% CO2培养箱中培养。观察细胞状态,转染18 h,及时更换α-MEM完全培养基。空白对照组常规培养。
1.4 ST2细胞成脂分化及脂质合成诱导方法 待三组细胞汇合度达100%时,进行成脂诱导。成脂诱导培养基:α-MEM培养液(含10%胎牛血清)、0.5 μmol/L地塞米松、0.25 mmol/L IBMX、5 mg/L胰岛素、50 μmol/L吲哚美辛。诱导3 d后将细胞培养基更换为只含有5 μg/mL胰岛素的α-MEM完全培养基再继续诱导2 d。于诱导3 d后行mRNA和蛋白检测,诱导5 d后行油红O染色。加入诱导培养基器皿中培养,用PBS洗涤细胞2次,用4%多聚甲醛室温固定15 min;弃4%多聚甲醛固定液,用PBS再洗涤1次;加60%油红O染液,室温静置5 min,于镜下观察脂滴着色情况。弃染液,用蒸馏水冲洗干净后,每孔留少量蒸馏水,于倒置显微镜下观察脂滴生成情况并拍照;弃蒸馏水,倒置晾干,每孔加100%异丙醇200 mL,室温静置20 min,待油红O被完全萃取出来,采用多功能酶标仪测定OD520,油红O着色程度用OD520值表示,定量分析各组脂滴形成情况。
1.5 ST2细胞内成脂分化及脂质合成相关基因表达检测 采用qRT-PCR法。收集细胞并裂解,按照GeneMark 说明书提取RNA 2 μg进行逆转录,逆转录体系:10 mmol/L dNTP 2 μL、100 pmol/μL Random primer 1 μL、5×RT Buffer 4 μL、10 U/μL RNase Inhibitor 1 μL、Reverse Transcriptase 1 μL、20 μmol/L Oligo dT 1 μL,用RNase-free H2O补足至20 μL。逆转录反应条件:25 ℃ 10 min,42 ℃ 60 min,70 ℃ 15 min。反应结束后将逆转录产物稀释10倍进行后续实验。转染48 h测定对照组和实验组中APCDD1的表达。APCDD1的上下游引物分别为5′-CGGTGTGCTCTCATCTAAGGTC-3′、5′-CCCACTGAAGACATTGAGGAGG-3′。诱导3 d后测定对照组和实验组成脂分化及脂质合成过程中相关因子的表达,各上下游引物序列如下。过氧化物酶体增殖物激活受体(PPARγ):5′-CTTGACAGGAAAGACAACGG-3′、5′-GCTTCTACGGATCGAAACTG-3′;CCAAT增强子结合蛋白α(C/EBPα):5′-CTGATTCTTGCCAAACTGAG-3′、5′-GAGGAAGCTAAGACCCACTAC-3′;脂肪酸结合蛋白4(aP2):5′-AAATCACCGCAGACGACAG-3′G、5′-GGCTCATGCCCTTTCATAAAC-3′;、脂滴包被蛋白(Perilipin):5′-GAGAAGGTGGTAGAGTTCCTCC-3′、5′-GTGTGTCGAGAAAGAGTGTTGGC-3′;脂肪酸合酶(FASN):5′-CACAGTGCTCAAAGGACATGCC-3′、5′-CACCAGGTGTAGTGCCTTCCTC-3′;乙酰辅酶A羧化酶1(ACC1):5′-GTTCTGTTGGACAACGCCTTCAC-3′、5′-GGAGTCACAGAAGCAGCCCATT-3′;β-actin:5′-GTCCCTCACCCTCCCAAAAG-3′、5′-GCTGCCTCAAC ACCTCAACC-3′。取实验组与对照组细胞。反应体系:模板cDNA 2 μL、10 μmol/L特异性上下游引物各0.5 μL、2×SYBR Green PCR Master Mix 5 μL,去离子水补充至10 μL。反应条件:95 ℃ 预变性3 min,95 ℃ 5 s、56 ℃ 15 s、72 ℃ 15 s共35个循环。溶解曲线分析:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s。用溶解曲线法分析qRT-PCR产物,并排除引物二聚体的干扰。以β-actin 为内参,采用2-ΔΔCt法计算各目的基因相对表达量,ΔCt=Ct目的mRNA-Ct内参mRNA,ΔΔCt=ΔCt实验组-ΔCt对照组。重复实验3次。
1.6 ST2细胞内成脂分化及脂质合成相关蛋白表达检测 采用Western blotting法。成脂诱导72 h取实验组与对照组细胞。弃细胞培养基,用预冷的PBS洗涤细胞表面2次,加入适量PBS,用细胞刮快速刮下细胞,并全部收集至1.5 mL离心管中,全程冰上操作。放入4 ℃离心机,3 000 r/min,离心5 min,弃上清液。加入适量RIPA裂解液重悬细胞,其中裂解液中含有1×Cock Tail(蛋白酶抑制剂混合物),反复吹打几次混合均匀,在冰上静置10 min,4 ℃,12 000 r/min离心10 min,取上清于新的离心管中获得总蛋白。配制SDS-PAGE凝胶,加样进行蛋白电泳,转膜封闭后敷一抗过夜,次日敷二抗后曝光。用Image J软件进行灰度值分析,计算各目标蛋白与β-actin的灰度比值作为目标蛋白相对表达量。实验重复3次。
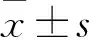
2 结果
2.1 APCDD1在ST2细胞成脂分化过程中的表达变化 成脂诱导0、1、2、3、4、5 d APCDD1 mRNA相对表达量分别为1.00±0.49、5.31±0.96、7.46±1.11、5.95±1.86、4.30±0.38、2.60±0.14。从成脂诱导1 d开始APCDD1 mRNA相对表达量升高,均高于0 d(P均<0.05)。成脂诱导2 d时APCDD1 mRNA相对表达量最高。转染后,实验组、对照组APCDD1 mRNA相对表达量分别为6.20±0.70、1,比较差异有统计学意义(P<0.05)。
2.2 实验组与对照组脂滴形成情况比较 转染APCDD1过表达质粒后,ST2细胞形成的脂滴数量明显增多。对照组OD520值为0.26±0.02,实验组为0.65±0.01,比较差异有统计学意义(P<0.05)。
2.3 实验组与对照组成脂分化及脂质合成相关基因表达比较 实验组成脂分化特异性基因PPARγ、C/EBPα、aP2 mRNA相对表达量分别为2.24±0.56、1.78±0.39、5.33±0.34,对照组均为1,比较差异有统计学意义(P均<0.05);脂肪合成代谢关键因子FASN、Perilipin、ACC1 mRNA相对表达量分别为2.91±0.32、5.44±0.36、1.86±0.08,对照组均为1,比较差异有统计学意义(P均<0.05)。
2.4 实验组与对照组相关蛋白表达比较 实验组PPARγ、C/EBPα、aP2蛋白相对表达量分别为1.62±0.11、2.62±0.13、1.60±0.23,FASN、ACC1蛋白相对表达量分别为3.01±0.25、1.35±0.06,对照组均为1,比较差异有统计学意义(P均<0.05)。
3 讨论
BMSC因其具有易于分离、免疫原性弱、可进行自体移植、尚未发现致瘤性等优点,越来越多受到青睐,被认为是引入临床治疗的最优干细胞。因此,密切关注BMSC成脂分化过程中的分子变化对于了解骨代谢、肥胖等相关代谢性疾病的发病机制及治疗的药物研发有重大意义。
APCDD1基因位于人和小鼠的18号染色体上,是与经典Wnt信号通路密切相关的膜结合糖蛋白,其转录可受β-连环蛋白(β-catenin)/T细胞转录因子转录复合物的调控[6],编码的APCDD1蛋白相对分子质量约为58 kD。APCDD1最初是从结肠癌细胞中被分离出来的,将野生型结肠腺瘤样息肉病蛋白导入结肠癌SW480细胞后,APCDD1的表达下降,也因此将其命名为APCDD1。许多内源性因子可激活或抑制经典Wnt信号通路,这其中就包括APCDD1[5]。APCDD1可参与许多发育过程,如调控胶质细胞再生、牙齿形态发生、少突细胞的分化等[7~9];也与某些疾病的发生密切相关,如遗传性少毛症、骨肉瘤、结肠癌等[10~12]。最新研究发现,APCDD1能够通过抑制Wnt信号通路促进3T3-L1前脂肪细胞的成脂分化,而在高脂饮食诱导的肥胖模型(DIO)中,由于受到miR-130的抑制,导致APCDD1呈低表达,DIO小鼠的脂肪细胞分化也受到抑制[13]。然而目前APCDD1对BMSC成脂分化及脂质合成的调控作用并未见报道。
C/EBPα、PPARγ是公认的调控脂肪细胞分化的重要转录因子,在脂肪分化的过程中具有核心作用,可促进脂肪细胞成熟的重要表征因子aP2表达[14]。Perilipin包被在细胞内脂滴表面,其合成被认为与细胞内脂质的合成同时进行,在脂滴表面发挥屏障作用[15]。ACC1和FASN则是参与机体内脂肪合成的关键酶[16]。本研究发现,在ST2细胞成脂分化过程中APCDD1表达升高,提示APCDD1可能参与调控BMSC的成脂分化及脂质合成过程。本研究构建APCDD1过表达质粒,并转染入ST2细胞,经成脂诱导后,脂滴形成增加,成脂分化相关因子PPARγ、C/EBPα、aP2及脂质合成代谢相关因子Perilipin、FASN、ACC1 mRNA或蛋白表达均升高,本研究中未检测Perilipin的蛋白表达。因此,本研究在细胞水平及分子水平上证实了APCDD1可促进BMSC的成脂分化及细胞内脂质合成的过程。
APCDD1可通过抑制卷曲蛋白2与Wnt蛋白的结合[10],阻碍Wnt3a和Lrp5的相互作用,影响β-catenin的稳定性,从而抑制Wnt介导的发育过程。Wnt/β-catenin信号通路可通过抑制脂肪细胞分化过程中的关键转录因子PPARγ和C/EBPα的表达而抑制成脂分化[17],脂肪细胞特异性Wnt10b转基因小鼠能够有效抵抗高脂饮食诱导肥胖的发生[18]。尽管大部分研究证实APCDD1是Wnt信号通路的抑制剂,但也有研究表明APCDD1在人的牙囊细胞中可通过维持β-catenin的表达并激活Wnt信号通路而影响成骨分化[19]。这说明APCDD1在不同的组织和细胞中对Wnt信号通路的调节作用可能不同。
本研究尽管证实了APCDD1能促进BMSC的成脂分化及脂质的合成代谢,但其是否依赖于抑制Wnt信号通路发挥作用尚有待研究。这也是今后将要探讨的问题之一。

