siRNA敲减缺氧诱导因子1α表达对口腔鳞癌细胞活力及癌胚抗原相关细胞黏附分子1表达的影响*
雷雨广, 张伟丽, 陈 超, 杜尊国
(1信阳市第二人民医院病理科, 2信阳职业技术学院护理学院, 河南 信阳 464000; 3复旦大学附属华山医院病理科, 上海 200031)
口腔癌是常见的严重危害人类健康的恶性肿瘤之一。近年来,口腔癌的发病率和死亡率逐年增加,至今未找到高效的治疗方法[1-3]。鳞状细胞癌占口腔颌面部恶性肿瘤的80%以上,是口腔颌面部最常见的恶性肿瘤[4],因此本文选用口腔鳞癌细胞进行相关研究。RNA干扰(RNA interference, RNAi)技术可从源头上“沉默”机体中的特定致癌基因,从而达到治疗肿瘤的作用,为解决口腔癌的临床治疗问题带来了希望。近年来的研究发现,缺氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)在多种恶性实体瘤组织中的表达量显著增加,并与肿瘤的发生、发展、转移和预后等密切相关[5-6]。研究表明,HIF-1α还与肿瘤的恶性程度呈现正相关性,因此普遍认为HIF-1α是一种致癌基因[7]。本实验检测了HIF-1α在口腔磷癌细胞以及正常口腔上皮细胞中的表达量,并通过RNAi技术设计靶向沉默HIF-1α的siRNA表达载体,转染口腔癌细胞,观察HIF-1α在人口腔鳞癌中表达的变化,并探讨其水平的变化对口腔癌细胞活力和凋亡的影响以及作用机制。
材 料 和 方 法
1 实验材料
正常口腔黏膜上皮细胞系NOK购自中国典型培养物保藏中心;口腔鳞癌细胞系Tca8113和CAL27购自中科院上海细胞库。DMEM培养基和TRIzol试剂购自Gibco;胎牛血清购自HyClone;逆转录试剂盒购自大连TaKaRa;苯甲基磺酰氟(phenyl-methanesulfonyl fluoride,PMSF)和细胞凋亡检测试剂盒购自上海碧云天公司;噻唑蓝(methylthiazolyl diphenyltetrazolium bromide,MTT)和二甲基亚砜(di-methyl sulfoxide, DMSO)购自Sigma;Lipofectamine 2000转染试剂盒购自Invitrogen;鼠抗人HIF-1α单克隆抗体、β-肌动蛋白(β-actin)单克隆抗体、辣根过氧化物酶标记的羊抗鼠IgG抗体、鼠抗人血管内皮生长因子(vascular endothelial growth factor,VEGF)单克隆抗体、鼠抗人Bcl-2单克隆抗体和鼠抗人Bax单克隆抗体购自Santa Cruz; 鼠抗人癌胚抗原相关细胞黏附分子1(carcinoembryonic antigen-related cell adhesion molecular 1,CEACAM1)单克隆抗体购自Abcam;兔抗人P21单克隆抗体购自Cell Signaling Technology。细胞培养箱和酶标仪购自Thermo;流式细胞仪购自Beckman Coulter;荧光定量PCR仪购自Roche。
2 实验方法
2.1细胞的培养 NOK细胞、Tca8113细胞和CAL27细胞均置于含10%胎牛血清的DMEM培养基中培养,并加入1%的双抗,放入37 ℃、5% CO2的细胞培养箱中,待细胞浓度达到90%进行传代。弃去培养基,加入1 mL胰酶消化约1~2 min,加入2 mL完全培养基,冲洗培养瓶壁上的细胞,离心,弃去上清液,分装至2个新的培养瓶中,继续培养。
2.2RT-PCR检测口腔鳞癌细胞以及正常上皮细胞中HIF-1α和CEACAM1的mRNA表达量 收集细胞,加入1 mL TRIzol吹打均匀,冰上裂解5 min,提取细胞总RNA。加入1.0 μL逆转录酶,94 ℃ 5 min、94 ℃ 30 s、55 ℃ 40 s、72 ℃ 30 s,30个循环,合成cDNA。根据GenBank中基因的序列,由上海生工合成基因引物,HIF-1α上游引物序列为5’-TGCTTGGTGCTGATTTGTGA-3’,下游引物序列为5’-GGTCAGATGATCAGAGTCCA-3’;CEACAM1的上游引物序列为5’-AAGCGACCAGCGTGATCT-3’,下游引物序列为5’-AAAGTTCAGGGTAGAATAAGTAACTTCA-3’;GAPDH的上游引物序列为5’-CGGAGTCAACGGATTTGGTCGTAT-3’,下游引物序列为5’-AGCCTTCTCCATGGTGGTGAAGAC-3’。以cDNA为模板,GAPDH为内参照,反应体系为20 μL,反应条件: 95 ℃ 30 s; 95 ℃ 5 s, 55 ℃ 10 s, 72 ℃ 15 s, 40个循环;65 ℃ 5 s, 40 ℃ 10 s。实验重复3次。
2.3Western blot检测口腔鳞癌细胞以及正常上皮细胞中HIF-1α和CEACAM1的蛋白表达量 收集5×106个细胞,每孔加入100 μL PMSF细胞裂解液,提取细胞中总蛋白,与等体积2×上样缓冲液混合均匀,沸水加热5 min,离心;将玻璃板、梳子清洗干净,配置10%的分离胶,小心注入玻璃板缝隙中,预留3cm高度的空间,加入去离子水,静置60 min;制备5%的堆积胶,弃去双蒸水,晾干,将堆积胶注入分离胶上部,插入梳子,待堆积胶凝固,拔去梳子,置于电泳槽中,加入1×电泳液。吸取20 μL蛋白样品加入上样孔,恒压80 V电泳至溴酚蓝到达堆积胶边缘,调整电压120 V,直至溴酚蓝到达凝胶底部。将PVDF膜一端接正极,凝胶一端接负极,恒定电流280 mA转膜35 min;加入封闭液,室温封闭2 h;弃去封闭液,加入 I 抗,4 ℃孵育过夜,TBST漂洗3次,每次5 min,加入II抗,37 ℃孵育1.5 h,TBST漂洗3次,每次5 min,暗室中显色,曝光,拍照,Quantity One分析蛋白质灰度值。同法检测HIF-1α下游P53、P21、VEGF、Bcl-2和Bax蛋白水平的变化。
2.4细胞的转染 CAL27细胞分为空白对照(blank control)组、无义对照(non-sense control)组和siRNA-HIF-1α组。转染前24 h,取对数期细胞计数,以每孔2×105个接种于6孔板中,37 ℃细胞培养箱中继续培养,待细胞融合率达到40%~50%左右,开始转染。3条有效siRNA-HIF1α片段由上海吉玛制药有限公司合成,实验前筛选出干扰效果较强的片段,正义链为5’-GATCCGAAAGATAGAGCAAGACAATTCA-AGAGATTGTCTTGCTCTATCTTTCTTTTTTGGAAA-3’,反义链为5’-AGCTTTTCCAAAAAAGAAAGATAGAGCAAGACAATCTCTTGAATTGTCTTGCTGTATCTTTGG-3’;无义对照正义链为5’-GATCCGTATAAGTCAA-CTGTTGACTTCAAGAGAGTCAACAGTTGACTTATAC-TTTTTTGGAAA-3’,反义链为5’-AGCTTTTCCAAAA-AAGTATAAGTCAACTGTTGACTCTTGAAGTCAACAG-TTGACTTATACG-3’。根据脂质体Lipofectamine 2000转染试剂盒说明书将无义对照和siRNA-HIF1α序列分别转染入CAL27细胞后,置于37 ℃、5% CO2细胞培养箱中继续培养48 h。转染后,根据2.3所示的方法,用Western blot检测转染后细胞中HIF-1α蛋白的表达量。
2.5MTT法检测细胞的活力 将各组CAL27细胞以每孔1×105接种于96孔板中,每组3个复孔,37 ℃培养48 h,每孔加入20 μL MTT(5 g/L),37 ℃恒温箱培养4 h,弃去上清,加入100 μL DMSO,37 ℃摇床中孵育30 min,酶标仪检测细胞在570 nm的吸光度(A)值,实验重复3次,取平均值。
2.6流式细胞术检测细胞的凋亡能力 收集各组细胞,胰酶消化,以结合缓冲液将细胞浓度调整为1×109/L,取100 μL细胞悬浮液加入24孔板中,培养24 h后,每孔加入5 μL Annexin V-FITC和10 μL 碘化丙啶(propidium iodide,PI),避光反应15 min,流式细胞术分析细胞的凋亡率。
3 统计学分析
采用SPSS 22.0软件进行统计处理,结果以平均数±标准差(mean±SD)表示,多组数据间的比较采用单因素方差分析,组间两两比较使用Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结 果
1 口腔鳞癌和正常口腔上皮细胞中HIF-1α和CEACAM1 mRNA和蛋白表达量的变化
与NOK细胞相比,Tca8113和CAL27细胞HIF-1α的mRNA和蛋白表达量显著上调(P<0.05),CEACAM1的mRNA和蛋白水平显著增加(P<0.05);与Tca8113细胞相比,CAL27细胞中HIF-1α和CEACAM1的mRNA和蛋白水平显著增加(P<0.05),且HIF-1α 与CEACAM1的表达量呈正相关(r2=0.685,P=0.012),见图1、表1。这表明HIF-1α和CEACAM1在口腔鳞癌细胞中的表达量显著高于正常细胞,提示HIF-1α 可能参与口腔鳞癌的发生、发展过程。
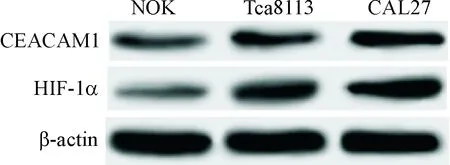
Figure 1.The images of Western blot for determining the protein expression of HIF-1α and CEACAM1 in the oral squamous cell carcinoma and normal epithelial cells.
图1Westernblot检测口腔鳞癌和正常口腔上皮细胞中HIF-1α和CEACAM1蛋白的表达量
表1口腔鳞癌和正常口腔上皮细胞中HIF-1α和CEACAM1的mRNA和蛋白表达量
Table 1.The expression of HIF-1α and CEACAM1 at mRNA and protein levels in oral squamous cell carcinoma and normal epithelial cells (Mean±SD.n=3)
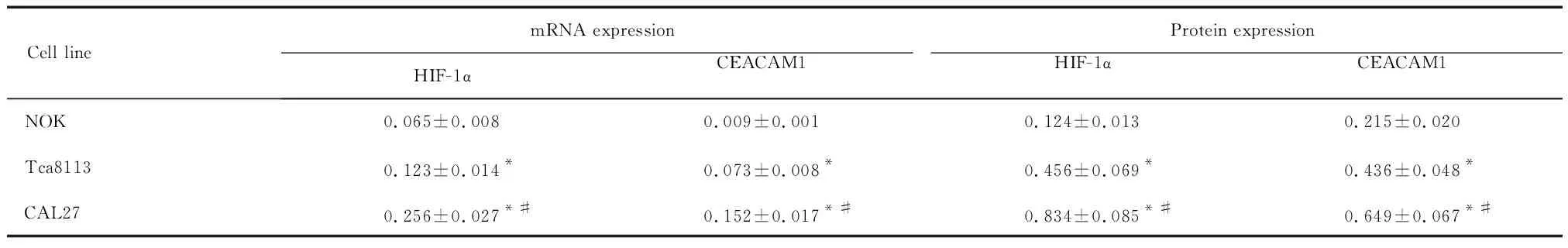
Cell linemRNA expressionProtein expressionHIF-1α CEACAM1 HIF-1αCEACAM1NOK0.065±0.0080.009±0.0010.124±0.0130.215±0.020Tca81130.123±0.014*0.073±0.008*0.456±0.069*0.436±0.048*CAL270.256±0.027*#0.152±0.017*#0.834±0.085*#0.649±0.067*#
*P<0.05vsNOK;#P<0.05vsTca8113.
2 转染后CAL27细胞中HIF-1α蛋白水平的变化
以CAL27细胞作为后续实验的研究对象,将siRNA-HIF-1α转染入CAL27细胞,Western blot 检测细胞中HIF-1α蛋白的表达量,结果显示,与空白对照组和无义对照组比较,siRNA-HIF-1α组细胞中HIF-1α蛋白的表达量显著降低(P<0.05);无义对照组与空白对照组相比细胞中HIF-1α蛋白表达量的差异无统计学显著性,见图2。
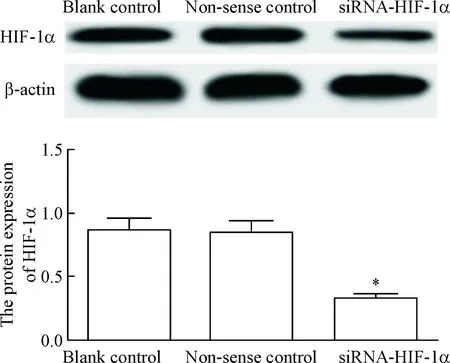
Figure 2.The protein level of HIF-1α in the cells after transfection. Mean±SD.n=3.*P<0.05vsblank control group.
图2转染后细胞中HIF-1α蛋白水平的变化
3 沉默HIF-1α表达对CAL27细胞活力的影响
与空白对照组相比,无义对照组细胞活力的差异无统计学显著性,siRNA-HIF-1α组细胞活力显著降低(P<0.05),见图3。
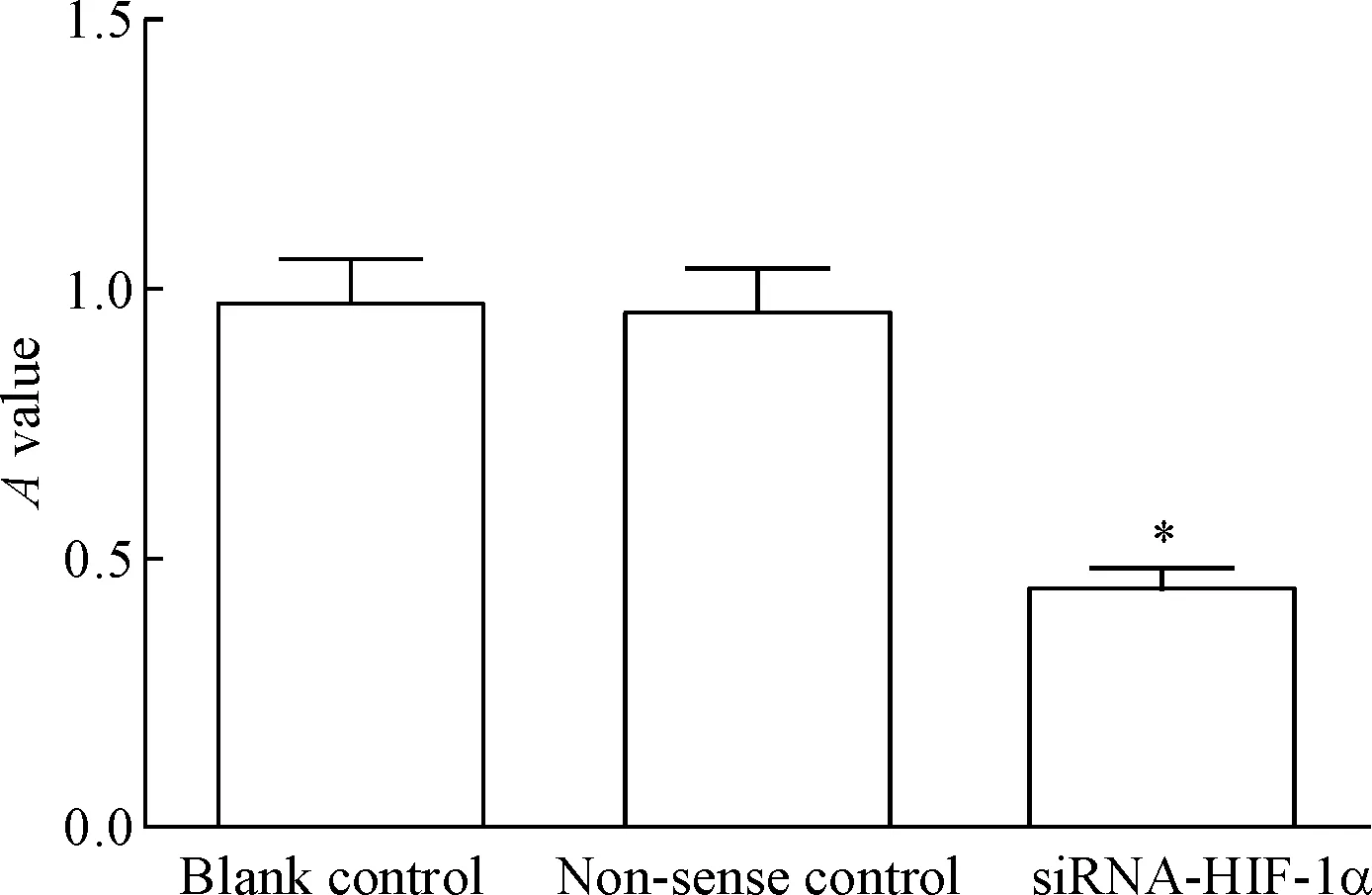
Figure 3.The effect ofHIF-1αknockdown on the viability of CAL27 cells. Mean±SD.n=3.*P<0.05vsblank control group.
图3沉默HIF-1α表达对CAL27细胞活力的影响
4 沉默HIF-1α表达对CAL27细胞凋亡的影响
与空白对照组相比,无义对照组的细胞凋亡率差异无统计学显著性,siRNA-HIF-1α组的细胞凋亡率显著增加(P<0.05),见图4。
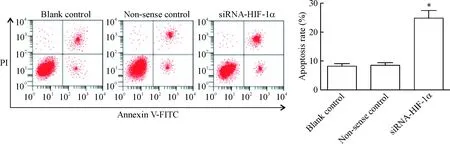
Figure 4.The effect ofHIF-1αknockdown on the apoptosis of CAL27 cells. Mean±SD.n=3.*P<0.05vsblank control group.
图4沉默HIF-1α表达对CAL27细胞凋亡的影响
5 沉默HIF-1α表达对HIF-1α下游靶蛋白水平的影响
无义对照组细胞中HIF-1α下游靶蛋白的表达量与空白对照组间的差异无统计学显著性;siRNA-HIF-1α组细胞中P21和Bax的蛋白水平较空白对照组显著增加(P<0.05),Bcl-2和VEGF蛋白水平显著降低(P<0.05),见图5、表2。
讨 论
口腔癌的发病率位于恶性肿瘤的前列,近年来的新发病例逐渐增加,因此预防和治疗口腔癌是一项艰巨的任务。口腔鳞癌是口腔癌常见的病理类型,极易复发,严重影响人们的健康。HIF-1α是一种在多种实体肿瘤中高表达的基因,其表达量不仅与肿瘤的发生和发展有关,还与肿瘤的转移及患者的生存期密切相关,是预后不良和复发的常用指标[8-9]。HIF-1α已成为近年来研究的热点致癌基因。本实验通过RT-PCR和Western blot检测口腔鳞癌Tca8113和CAL27细胞以及正常上皮细胞NOK中HIF-1α的表达量,结果显示HIF-1α在口腔鳞癌Tca8113和CAL27细胞中的表达量显著高于正常细胞NOK,表明HIF-1α在口腔鳞癌中的表达量显著上调。研究表明,在口腔鳞癌组织中,HIF-1α的表达量上调[10],表明HIF-1α可能参与口腔癌的发生、发展,其中HIF-1α在CAL27细胞中的表达量显著高于Tca8113细胞,因此本文后续实验以CAL27细胞为研究对象。
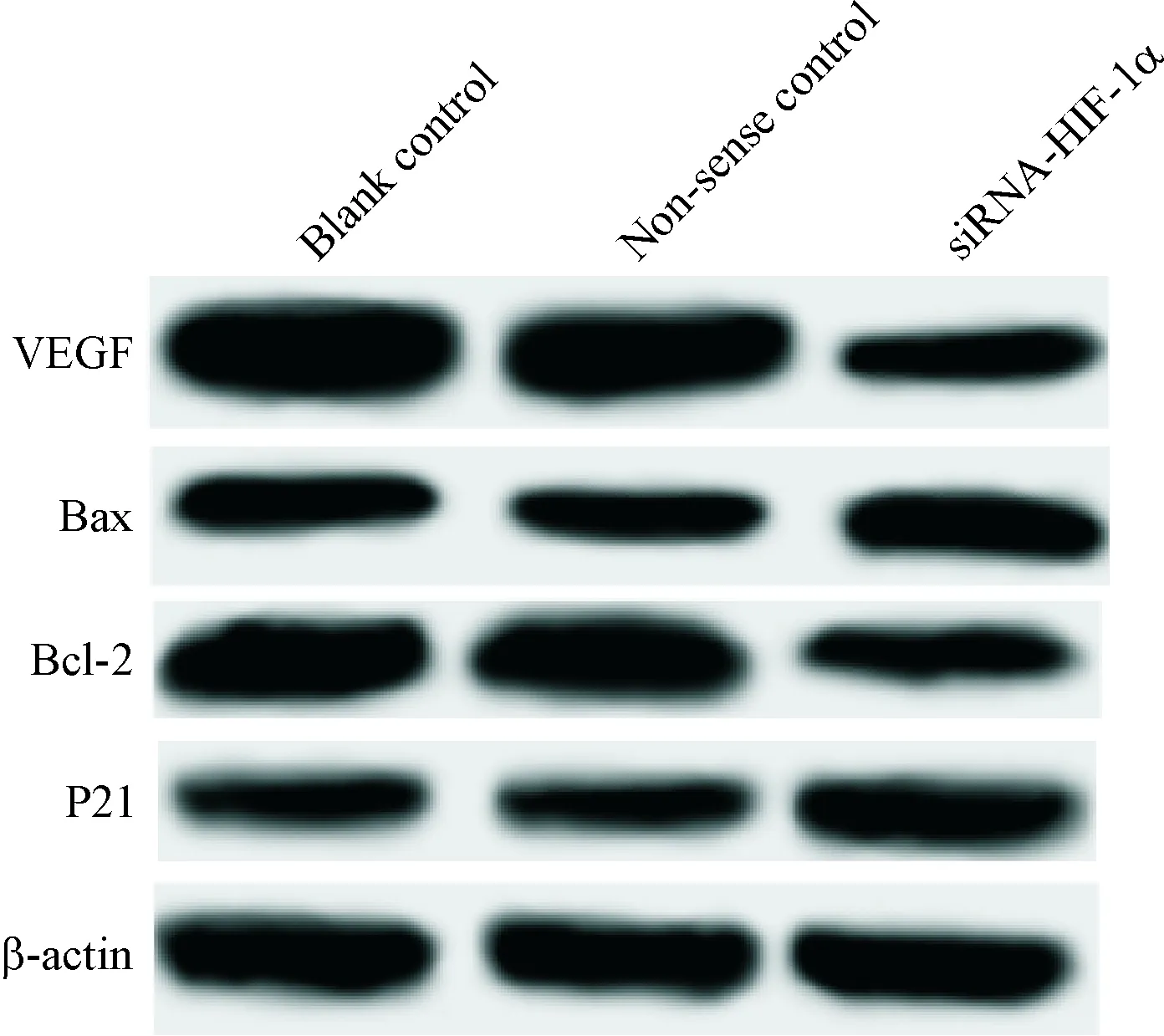
Figure 5.The images of Western blot for determining the protein levels of downstream molecules of HIF-1α after theHIF-1αexpression in the CAL27 cells was silenced.
图5Westernblot检测沉默HIF-1α表达对HIF-1α下游靶蛋白水平的影响
肿瘤的发生、发展与肿瘤细胞的恶性增殖和凋亡减少有关,其中细胞的过度增殖是恶性肿瘤的主要特征之一[11]。目前,在多种肿瘤细胞中特异性降低HIF-1α基因的表达,可显著抑制细胞的增殖、凋亡等生物学特性[12-14]。在本研究中,采用脂质体将siRNA-HIF-1α表达载体转染入CAL27细胞,结果发现siRNA-HIF-1α组细胞中HIF-1α的表达量显著低于空白对照组,提示转染成功;MTT和流式细胞术检测细胞的活性和凋亡率,发现沉默HIF-1α的表达量显著抑制CAL27细胞的活性,其凋亡率显著增加。在膀胱癌、非小细胞肺癌中,下调HIF-1α的表达可抑制细胞的生长并诱导其凋亡,与本实验结果一致,提示HIF-1α可能是口腔癌分子靶向治疗的潜在位点。
表2沉默HIF-1α表达对HIF-1α下游靶蛋白水平的影响
Table 2.The effect ofHIF-1αknockdown on the protein levels of downstream molecules of HIF-1α (Mean±SD.n=3)

GroupP21Bcl-2BaxVEGFBlank control0.668±0.0781.265±0.1370.856±0.0841.355±0.0174Non-sense control0.652±0.0771.318±0.1420.863±0.0891.368±0.141siRNA-HIF-1α0.978±0.120*0.952±0.096*1.145±0.136*0.723±0.071*
*P<0.05vsblank control group.
众所周知,Bcl-2家族蛋白在细胞凋亡过程中发挥重要作用。Bcl-2家族蛋白根据其功能的不同分为抑凋亡蛋白和促凋亡蛋白,Bcl-2为主要的抑凋亡蛋白,Bax为主要的促凋亡蛋白。Bcl-2和Bax的表达量发生变化,诱导线粒体细胞色素C和凋亡诱导相关因子的分泌增加,激活细胞中caspase蛋白酶的活性,从而诱导细胞凋亡[15-16]。P21是一种重要的细胞周期依赖性激酶的抑制因子,主要通过抑制细胞周期G1/S的转换,使细胞周期阻滞在G1期,从而抑制细胞的增殖[17-18]。HIF-1α在口腔癌中的作用机制尚不清楚。本研究中,siRNA-HIF-1α组细胞中Bcl-2的表达量显著降低,Bax和P21蛋白水平显著增加,提示HIF-1α可能通过调控Bcl-2家族蛋白的表达以及上调P21来发挥促CAL27细胞凋亡的作用。
肿瘤的预后主要表现在血管和淋巴的转移,因此抑制肿瘤新血管的生成和淋巴转移是提高肿瘤患者生存率、改善预后不良的重要策略[19-20]。肿瘤的血管生成与机体中的生长因子如VEGF等有关。研究表明,VEGF在多种实体肿瘤中表达量上调,与细胞的生物学行为密切相关,在肿瘤的新血管生成过程中发挥关键作用[21-23]。HIF-1α在调控VEGF表达的信号通路中发挥纽带作用,不仅能显著促进VEGF mRNA的表达量,还可显著促进VEGF mRNA的稳定性。CEACAM1是免疫球蛋白超家族的黏附分子,近年来发现其在肿瘤发生、发展过程中起重要作用[24]。CEACAM1主要参与调控与肿瘤预后相关的血管和淋巴管的生成。沉默CEACAM1基因的表达可抑制肿瘤毛细血管形成过程中VEGF诱导的血管形态发生效应[25]。本实验结果发现,在口腔癌细胞中CEACAM1的表达量显著高于正常上皮细胞,且与HIF-1α的表达量呈正相关性;沉默HIF-1α的表达显著抑制VEGF蛋白水平,表明HIF-1α的表达量与CEACAM1和VEGF水平密切相关,HIF-1α可能通过影响CEACAM1和VEGF的水平,阻碍肿瘤组织新血管的生成,从而抑制口腔癌的发生、发展。
综上所述,HIF-1α在口腔癌细胞中高表达。沉默HIF-1α的表达可以抑制口腔癌CAL27细胞的活力,诱导其凋亡。这可能通过其下游基因的表达以及肿瘤血管的生成来发挥调控作用。HIF-1α有望成为抗口腔癌的潜在靶向位点。

