融合蛋白TAP-SSL5抑制动静脉血栓形成*
曲小龙, 冯世斌, 彭 松, 陈 强, 胡厚源
[陆军军医大学(原第三军医大学)西南医院心血管内科, 重庆 400038]
发生在动脉粥样硬化不稳定斑块基础上的急性血栓形成,是急性心肌梗死、心脏性猝死和脑卒中等心脑血管急症的主要原因。在血栓形成的过程中,血小板激活、粒细胞聚集、局部炎症反应以及凝血系统的激活相互影响、相互促进[1]。过去的几十年中,抗血小板药物的应用,特别是血小板二磷酸腺苷(adenosine diphosphate,ADP)受体抑制剂的广泛应用,在动脉血栓性疾病的二级预防中发挥了极为重要的作用。然而,对于血栓形成过程中炎症反应以及凝血系统的激活却没有得到相应的重视[2]。
金黄色葡萄球菌超抗原样蛋白-5(staphylococcal superantigen-like protein 5,SSL5)是金黄色葡萄球菌分泌的一种蛋白,可与粒细胞表面的P-选择素糖蛋白配体1(P-selectin glycoprotein ligand 1,PSGL-1)结合,从而抑制粒细胞与血小板的结合及粒细胞在内皮细胞表面的滚动[3-4]。本课题组前期研究发现,SSL5 可与血小板表面的糖蛋白(glycoprotein,GP)Ibα和糖蛋白VI(GPVI )结合[5],提示SSL5可能通过抑制 GPIb-IX-V与血管性血友病因子(von Willebrand factor,vWF)、GPVI和胶原的相互作用,从而减少血小板在血管壁的黏附。所以我们将SSL5 作为功能兼引导分子,与活化的凝血因子X(activated coagulation factor X,FXa) 的直接抑制剂蜱抗凝血肽(tick anticoagulant peptide,TAP)融合,构建具有抗炎和抗凝双重活性的新型融合蛋白TAP-SSL5[6]。进一步研究发现TAP-SSL5保留了SSL5与血小板表面的GPIbα结合的能力[7],提示其可能抑制血小板在损伤血管表面黏附,从而抑制动脉血栓的形成;同时,TAP-SSL5不仅抑制激活的血小板与粒细胞[8]和淋巴细胞[9]的结合,还可抑制血小板微粒与单核细胞的结合及单核细胞表面巨噬细胞抗原-1(macrophage antigen-1,Mac-1)的活化[10],表明其具有明显的抗炎效应。药理学分析显示,TAP-SSL5对动物的神经系统、呼吸系统和心血管系统无明显影响,具有较好的安全性,无明显的毒副作用[11],并已有学者对TAP-SSL5药代动力学进行了相关研究[12]。
本课题利用表达纯化的融合蛋白TAP-SSL5,以流式细胞术在体外检测TAP-SSL5与粒细胞表面PSGL-1的结合能力以及其对FXa活性的抑制作用;在体内实验中,首先采用SD大鼠建立下腔静脉血栓形成模型,探讨TAP-SSL5对静脉血栓形成的影响,并采用 C57BL/6J小鼠建立肠系膜动脉血栓形成模型,应用双光子显微镜连续观测TAP-SSL5对 FeCl3诱导的小鼠肠系膜动脉血栓形成的影响,旨在评价 TAP-SSL5 在抑制动静脉血栓形成方面的作用,探讨通过相应引导分子将抗凝物质靶向到病变局部,从而有效地抑制血栓形成的新思路。
材 料 和 方 法
1 材料与试剂
1.1实验动物 SPF级SD大鼠(雄性,12周龄,体质量250~300 g)和SPF级C57BL/6J小鼠(雄性,体质量20~25 g)均由陆军军医大学(原第三军医大学)实验动物中心提供,许可证号为SYXK(军)2012-0030。
1.2实验试剂 PE标记的小鼠抗人CD162(PSGL-1)单克隆抗体(PE-KPL-1)和PE标记的小鼠IgG1(mIgG1-PE)购自BD;Penta-His Alexa Fluor 488和FITC-mouse IGg 1购自QIAGEN;Calcein-AM购自Sigma;P-selectin购自R&D;FACTOR Xa购自HBM;利伐沙班(rivaroxaban)购自Bayer;Russell’s viper venom-factor X activator(RVV-X)购自Abcam。
2 方法
2.1蛋白的表达与纯化 重组蛋白TAP-SSL5及SSL5的表达与纯化按照本课题组之前的方法获得[6], TAP-SSL5化学纯度为98%,相对分子质量为3.2×104kD,重组SSL5蛋白纯度>90%,相对分子质量为2.7×104kD。
2.2双偏振干涉(dual-polarization interferometry,DPI)实验检测蛋白的吸附 DPI实验在硅羟基芯片上展开,所用溶液均为超纯水配制。选择PBS为缓冲液,预先用氩气脱气15~20 min;再分别以80%乙醇溶液和双蒸水进行基线校正;用三甲基硅烷将2个通道修饰成疏水表面,500 mg/L TAP-SSL5结合到2个通道表面, I通道作为对照组,Ⅱ通道表面吸附sialyl Lewis X(sLeX),双通道以5 μL/min 速度灌满sLeX溶液。用DPI数据处理软件计算芯片表面蛋白的吸附亲和力。
2.3人外周血粒细胞及血小板的分离和纯化 人外周血来源为健康志愿者,并经陆军军医大学第一附属医院伦理委员会批准,采血前2周内未服用任何药物。人粒细胞的分离采用梯度离心法,具体方法按照本课题组之前的方法实施[8]。
2.4TAP-SSL5竞争性抑制KPL-1与粒细胞的结合实验 吸取细胞悬液, 1 000 r/min离心5 min;IMDM培养基重悬细胞,调整细胞浓度为1×109/L;分别吸取100 μL细胞悬液移入流式细胞管;蛋白组管分别加入0、1、3和10 μL TAP-SSL5溶液(浓度为1 g/L),室温孵育20 min;PBS洗涤细胞2次;同型对照管加入5 μL mIgG1-PE,蛋白组管加入5 μL PE-KPL-1,室温孵育20 min;PBS洗涤细胞2次;调整细胞悬液体积为200 μL,流式细胞术检测结果。
2.5TAP-SSL5抑制粒细胞及HL60细胞在P-selectin表面的黏附实验[13]取黑色底部透明的96孔酶标板,每孔加入3 mg/L P-selectin溶液100 μL, 4 ℃孵育过夜;PBS洗涤并吸取细胞悬液后离心,加入1/10体积Calcein-AM,Hanks液洗涤后分别以0~30 mg/L浓度TAP-SSL5及10 mg/L KPL-1孵育细胞,PBS再次洗涤后荧光倒置显微镜观察;荧光酶标仪检测荧光强度。
2.6TAP-SSL5对FXa活性的抑制作用
2.6.1TAP-SSL5对纯化的FXa活性的抑制作用[14]实验准备阶段各反应物浓度分别为TAP-SSL5:0、0.3、1.0、3.0和10.0 mg/L; TAP 3 mg/L;rivaroxaban:1 mg/L。室温下反应10 min,每孔加入20 μL S2765溶液,室温下避光反应15 min;每孔加入0.1 mol/L的H2SO4溶液50 μL终止反应;酶标仪检测405 nm处吸光度(A)值。
2.6.2TAP-SSL5对血浆中FXa活性的抑制作用[15]分别采集健康成年志愿者及12周龄雄性C57BL/6J小鼠全血,以1/10体积加入3.8% 枸橼酸钠溶液抗凝,采血前2周内未应用任何抗凝血药物。离心后吸取上清,用PBS按1 ∶5稀释,各组分别取10 μL用于实验。各组TAP-SSL5浓度为0、 0.3、 1.0、 3.0和10.0 mg/L,不同浓度的TAP-SSL5 与RVV-X稀释液总体积为20 μL。血浆与该混合液共同孵育15 min(37 ℃);加入底物S2765溶液孵育20 min;最后以0.1 mol/L H2SO4溶液50 μL终止反应,酶标仪检测405 nm处吸光度(A)值。
2.7TAP-SSL5抑制FeCl3诱导小鼠肠系膜动脉血栓形成
2.7.1实验分组 雄性 C57BL/6J小鼠10只,随机分为2组,每组5只,分别为PBS组和对照TAP-SSL5组。
2.7.2小鼠肠系膜动脉血栓诱导模型的建立及活体成像观察 雄性 C57BL/6J 小鼠,0.3%戊巴比妥钠将其麻醉,固定后于眼球后注射 0.02%罗丹明 6G 100 μL标记血小板和粒细胞,腹部脱毛后,用75%乙醇消毒,腹部中 1/3 正中切口,从切口处牵出一段肠管及其系膜铺于板上,在双光子显微镜下选择周围脂肪较少、直径为(100±10) μm的肠系膜动脉进行实验,录制基线影像3 min,将滤纸片(1 mm×4 mm)浸润 10% FeCl3溶液,贴于肠系膜动脉上,5 min 后取下滤纸片,连续观测损伤动脉处血栓形成情况,并实时记录该部位的影像,总时间 40 min或至管腔闭塞。
2.7.3TAP-SSL5抑制FeCl3诱导小鼠肠系膜动脉血栓形成 将重组蛋白稀释到相应浓度后,按10 mg/kg体质量从小鼠尾静脉注射;30 min 后行腹部切开,选择肠系膜动脉进行损伤。活体成像动态观测小鼠肠系膜动脉的损伤和小鼠肠系膜动脉血栓形成。
2.7.4小鼠肠系膜动脉血栓形成的影像分析 采用 ZEN 2012 图像分析软件对双光子显微镜录制的血管影像进行如下分析:(1)实验段肠系膜动脉直径的测量:直径在(100±10) μm 范围内的血管方可进行后续分析;(2)血栓初发时间:即动脉损伤后至血栓直径达到 10 μm 的时间;(3)管腔闭塞时间(occlusion time,OT): 以血流停止>10 s 界定管腔闭塞,以血管损伤至管腔闭塞的时间反映血栓形成的时间,OT 越长说明药物的抗血栓作用越强。
2.8TAP-SSL5对FeCl3诱导SD大鼠下腔静脉血栓形成的影响
2.8.1实验分组 40只雄性SD大鼠随机分为PBS组、TAP-SSL5(3 mg/kg)组、TAP(1 mg/kg)组、SSL5(2 mg/kg)组及SSL5-T175P(2 mg/kg)组,每组8只。另取40只雄性SD大鼠随机分为PBS组、小剂量(0.3 mg/kg) TAP-SSL5组、中剂量(1 mg/kg) TAP-SSL5组和大剂量(3 mg/kg) TAP-SSL5组,每组10只。
2.8.2FeCl3诱导的SD大鼠腔静脉血栓模型的建立 取雄性SD大鼠,戊巴比妥钠溶液麻醉;尾静脉注射给药后,行腹正中线切口,暴露下腔静脉;给药15 min后,于左肾静脉下方以4号线将下腔静脉与一支20G钝头针环扎,以3.5 μL 10% FeCl3溶液浸湿3 mm见方的滤纸片,将其置于结扎线下方;5 min后去掉滤纸片,继续观察30 min后,纵行剖开结扎线以下的下腔静脉,取出血栓精确称取湿重;心脏采集抗凝血,采用全自动生化仪检测凝血酶原时间(prothrombin time,PT)。
3 统计学处理
所有数据采用GraphPad Prism 5.0统计软件进行分析。数据均采用均数±标准误(mean±SEM)表示,多组间比较采用单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 TAP-SSL5 与sLeX的结合
按本实验TAP-SSL5提取及纯化方案,重组TAP-SSL5的纯度达到95%以上。TAP-SSL5的三维结构模型见图1A。多糖sLeX是PSGL-1结构中与P-selectin和E-selectin结合的位点,调控血小板与内皮细胞和粒细胞之间的结合。SSL-5正是可以通过与P-selectin或E-selectin竞争性结合PSGL-1,发挥抑制炎症的作用。我们用DPI技术分析TAP-SSL5是否保留了SSL5与sLeX结合的能力,结果表明TAP-SSL5呈剂量依赖性地结合sLeX,亲和常数为(3.54± 0.41) μmol/L,见图1B。
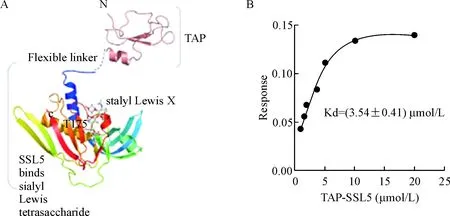
Figure 1.Molecular structure of the recombinant fusion protein TAP-SSL5 and its binding capability to sialyl Lewis X (sLeX). A: the ribbon diagram showed the fold of SSL5 and the connection of TAP with N-terminal open. The bound sLeXwas shown in stick mode; B: TAP-SSL5 binding to sLeXwas measured by dual-polarization interferometry analysis. The affinity constant was determined from the nonlinear curve fitting.
图1TAP-SSL5的三维结构及其与sialylLewisX的亲和力检测
2 TAP-SSL5 可与粒细胞表面PSGL-1结合并抑制粒细胞与 P-selectin 和血小板的结合
流式细胞术结果表明,TAP-SSL5 可与粒细胞结合,其结合率随着 TAP-SSL5 蛋白浓度的增加而升高,见图2A;同时,TAP-SSL5竞争性抑制 PE-KPL-1与粒细胞或HL60细胞的结合,见图2B, TAP-SSL5可使 PE-KPL-1 与粒细胞的结合显著下降,表明TAP-SSL5 可与细胞表面的 PSGL-1 结合。TAP-SSL5 抑制HL60和粒细胞在 P-selectin 表面黏附荧光倒置显微镜下观察可见,随着蛋白浓度的增加,镜下的细胞数逐渐减少,荧光酶标仪检测结果分析显示,TAP-SSL5 可显著抑制粒细胞或 HL60 细胞在 P-选择素包被表面的黏附,见图2C;同时, TAP-SSL5可抑制粒细胞与血小板的结合,见图2D。
3 TAP-SSL5抑制 FXa 活性
TAP是FXa的直接抑制剂。为了验证融合蛋白 TAP-SSL5 是否具有抑制FXa活性的效应,我们分别采用 FXa 蛋白和 RVV-X 激活血浆中的FX来做FXa活性抑制实验,结果表明 TAP-SSL5 在体外可显著抑制FXa活性,并且这种抑制效应在0~10 mg/L范围内呈明显的浓度依赖关系。阳性对照 TAP 和rivaroxaban 对 FXa 的抑制效应均十分明显,TAP-SSL5 对 FXa 活性的抑制效应稍低于同等摩尔浓度下的 TAP (P<0.01),见图3A;同时,TAP-SSL5对健康人及小鼠血浆中激活的FXa均有显著抑制作用,见图3B。
4 TAP-SSL5抑制FeCl3诱导的小鼠肠系膜动脉血栓形成
结果显示,在PBS组,经10% FeCl3溶液作用后,小鼠肠系膜动脉血栓形成较为迅速,血小板迅速聚集到损伤的血管壁处并导致管腔闭塞,管腔闭塞时间为(12.14±0.82) min;在TAP-SSL5组,OT为(38.73±2.21) min,较PBS组明显延长(P<0.05),表明TAP-SSL5可明显抑制小鼠肠系膜动脉血栓的形成的效应,见图4。
5 TAP-SSL5抑制FeCl3诱导的SD大鼠下腔静脉血栓形成
在体实验结果表明,应用TAP(1 mg/kg)、TAP-SSL5(3 mg/kg)和SSL5(2 mg/kg)均可明显抑制腔静脉内血栓的形成,而SSL5的无功能突变体SSL5-T175P(2 mg/kg)则无此作用,见图5A。随着TAP-SSL5浓度的增加,其抑制血栓形成的作用也愈加明显,见图5B,而尾部出血时间也明显延长(P<0.01),见图5C,但PT无明显改变,见图5D。
讨 论
最近临床研究表明,尽管给予了合适的治疗,还是有10%左右的急性冠脉综合征的患者发生心脑血管事件,该类事件发生的主要原因是动脉粥样硬化病变基础上的急性血栓形成。抗血小板和抗凝药物虽然在一定程度上可以改善心脑血管病患者的预后,但其抗血栓效应和出血风险之间的矛盾始终存在。因此,研制更加有效、更加安全的抗血栓药物对心脑血管疾病的防治具有重要意义。
血小板首先黏附并聚集于受损的血管壁或者斑块破裂的部位,是止血和血栓形成的始动环节[16]。研究发现,血小板与粒细胞的聚集体在心绞痛、心肌梗死和PCI术后患者的循环血液中有明显增加[17]。血小板表面的P-selectin 和粒细胞表面的PSGL-1的结合是血小板-粒细胞聚集体形成的关键环节[18]。 P-selectin与PSGL-1结合后,通过激活粒细胞Mac-1和促进组织因子(tissue factor,TF) 的表达,合成和释放多种炎症因子,这些机制共同参与了动脉粥样硬化斑块的发生发展和动脉血栓的形成[19-20];另一方面,粒细胞表面的TF对凝血系统的激活是血栓形成的重要原因[21]。有研究发现,在粒细胞缺乏的小鼠中,血栓形成明显减少,提示了粒细胞在动脉血栓形成过程中可能有着极为重要的作用[22]。 暴露的TF通过与凝血因子VII/VIIa形成TF-FVIIa复合体激活FX,后者使凝血酶原活化,激活凝血级联反应[22-23]。研究发现,血小板可以促进NETs的形成和TF的表达[24]。我们的实验结果表明,TAP-SSL5可以通过与粒细胞表面PSGL-1的结合,抑制血小板与粒细胞的聚集,从而发挥抑制动脉血栓形成的作用,一方面,TAP-SSL5可以抑制血小板与粒细胞之间的相互作用,从而减少TF的表达;另一方面,在SSL5的引导下,TAP可靶向聚积于粒细胞,主要在炎症部位发挥抗凝作用,避免因广泛抗凝而出现严重的出血并发症。

Figure 2.TAP-SSL5 binded to PSGL-1 on human neutrophils and inhibited the formation of platelet-leukocyte aggregates. A: the representative images of flow cytometry histogram overlay of TAP-SSL5 (FITC labeled) binding to human neutrophils. Grey area indicated the negative control, and the peaks indicated the binding of TAP-SSL5 at 1, 3, and 10 mg/L, respectively; B: the binding of PE-KPL-1 (anti-CD162) was competitively inhibited by TAP-SSL5. Grey area indicated the isotype control, the thick grey line indicated the binding of PE-KPL-1 only, and the other peaks (from the second right to left) indicated the binding of PE-KPL-1 inhibited by TAP-SSL5 at 1, 3, and 10 mg/L, respectively; C: TAP-SSL5 inhibited the adhesion of neutrophils to P-selectin coated surface under static condition. Calcein AM-labeled human neutrophils were treated with TAP-SSL5 (1~30 mg/L) for 10 min, while 10 mg/L KPL-1 was used as positive control. The data represent relative adhesion of cells compared with untreated cells; D: the effects of 10 mg/L TAP-SSL5 on the formation of platelet-leukocyte aggregates. Mean±SEM.n=6.△P<0.05,△△P<0.01vs0 mg/L group;*P<0.05,**P<0.01vsbasline group.
图2TAP-SSL5可与粒细胞结合并抑制血小板-中性粒细胞聚集体的形成
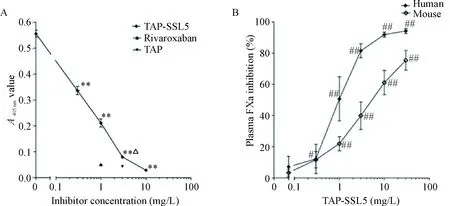
Figure 3.TAP-SSL5 inhibited the activity of activated coagulation factor X (FXa)invitro. A: TAP-SSL5 inhibited human FXa activity in a concentration-dependent manner. 3 mg/L TAP and 1 mg/L rivaroxaban were used as positive controls; B: TAP-SSL5 inhibited the formation of FXa in human and mouse plasma activated by RVV-X. Mean±SEM.n=6.**P<0.01vs0 mg/L control;△P<0.05vsTAP group;#P<0.05,##P<0.01vs0.1 mg/L group.
图3TAP-SSL5对FXa活性的抑制作用
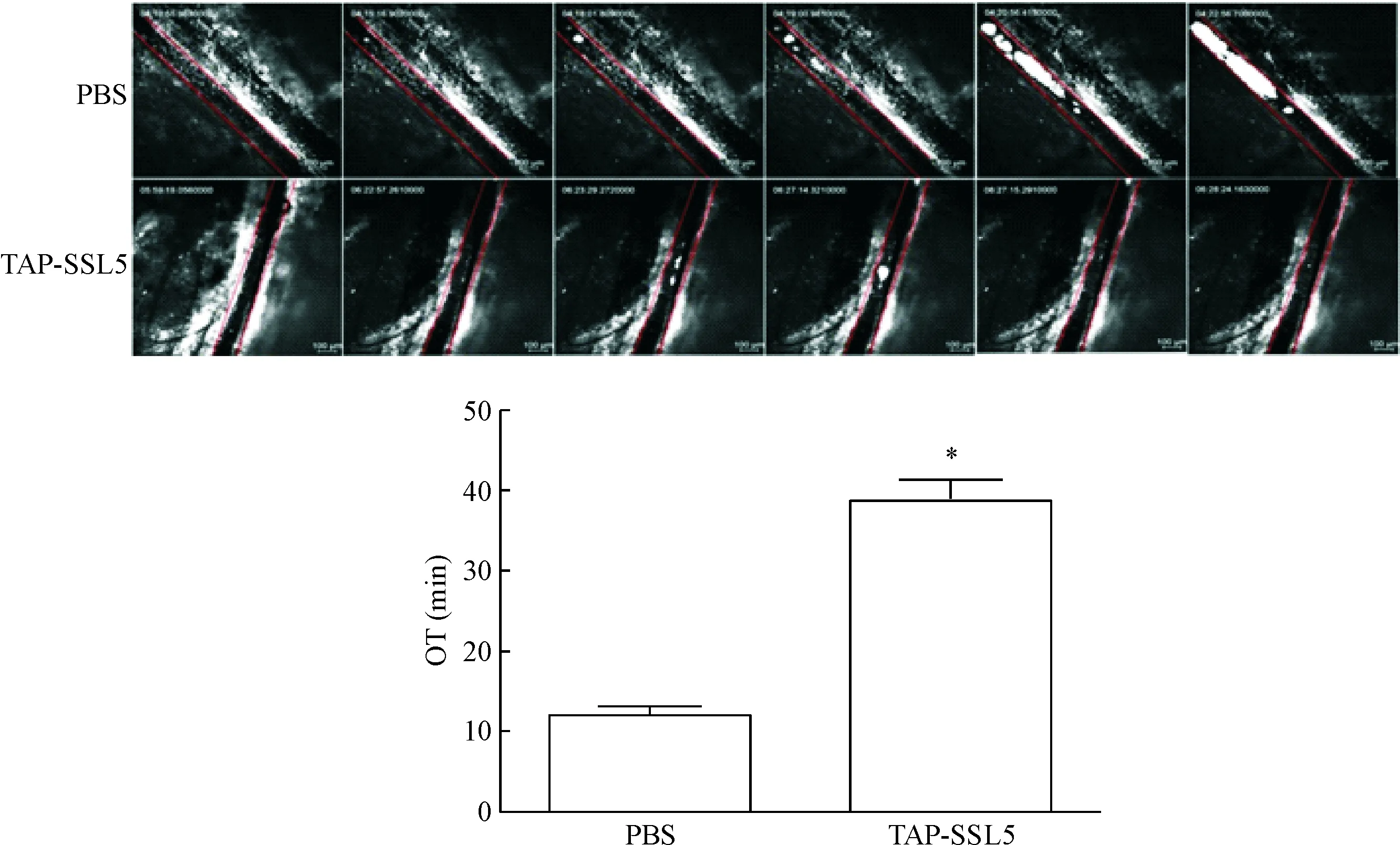
Figure 4.TAP-SSL5 inhibited FeCl3-induced mesenteric arterial thrombosis. Mean±SEM.*P<0.05vsPBS group.
图4TAP-SSL5对FeCl3诱导下小鼠肠系膜动脉血栓形成的抑制作用
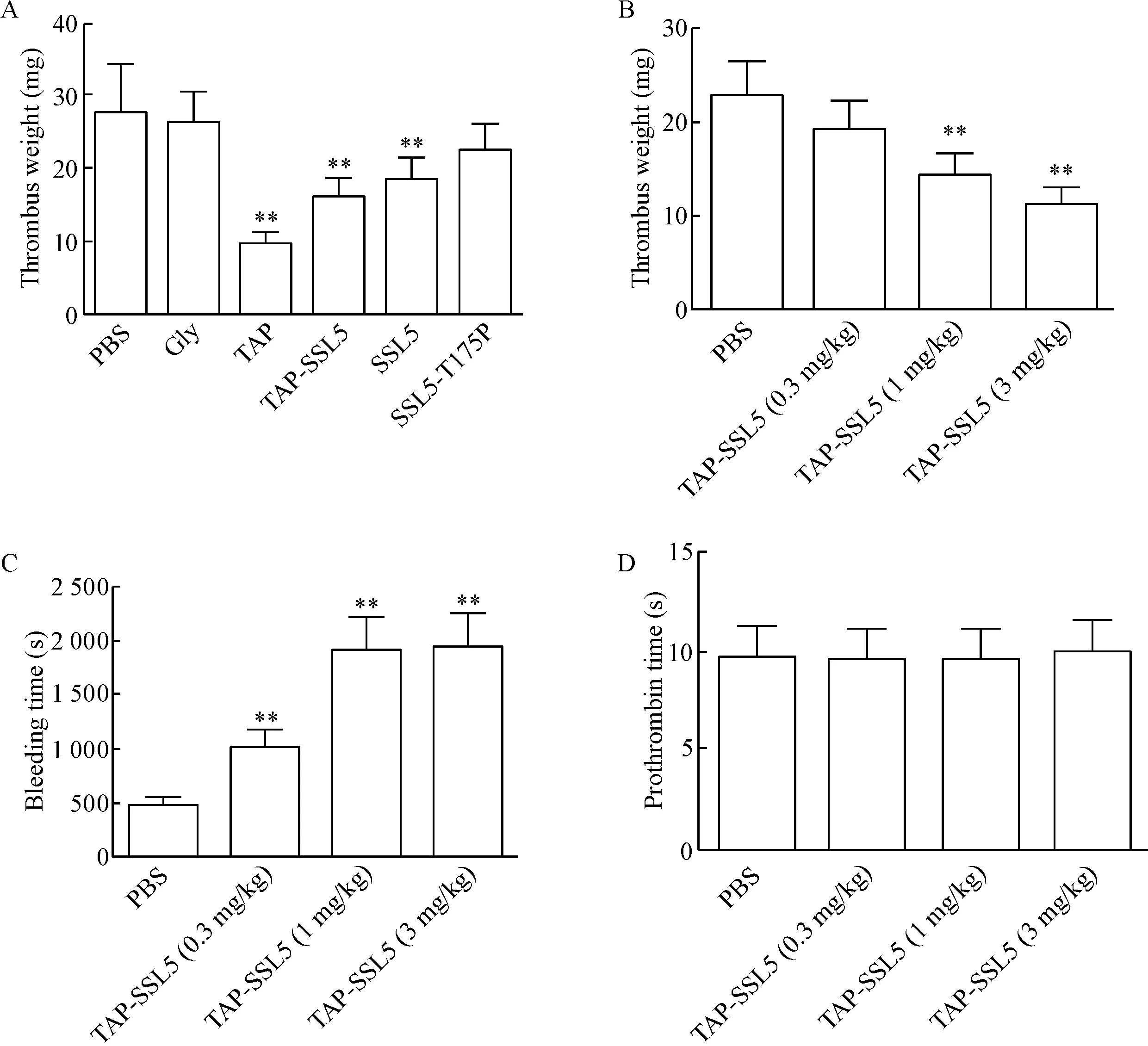
Figure 5.A: TAP-SSL5 inhibited FeCl3-induced formation of thrombi in the inferior vena cava of Sprague-Dawley rats. (n=8); B: TAP-SSL5 inhibits 10% ferric chloride-induced formation of thrombi in a dose-dependent manner (n=10); C: TAP-SSL5 prolonged tail bleeding time in rats (n=10); D: TAP-SSL5 did not prolong prothrombin time in rats (n=10). Mean±SEM.**P<0.01vsPBS group.
图5TAP-SSL5抑制FeCl3诱导的大鼠下腔静脉血栓形成
我们前期的研究发现,SSL5 可与血小板表面的GPIbα和GPVI 结合[5]。血小板表面的糖蛋白 GPIb-IX-V 复合物与vWF的结合在血小板与血管壁的黏附中发挥了关键作用,其中GPIbα是vWF的主要配体,其与 vWF 的结合介导了快速流动血液中的血小板在血管壁的黏附[21]。有研究显示,GPIbα 抑制剂能够抑制血栓形成,对出血时间的影响也较小[22]。因此TAP-SSL5可通过抑制 GPIb-V-IX 与 vWF、GPVI 与胶原的相互作用,而抑制血小板在损伤血管部位的黏附。
在血栓形成的过程中,血小板聚集和凝血系统的激活也是相互促进的。例如,凝血级联反应的最终产物凝血酶,不仅可以催化纤维蛋白原转化为纤维蛋白,还能够通过PAR-1/PAR-4受体激活血小板,促进血小板的聚集。由于FXa是外源性和内源性凝血级联的交汇点,可以直接活化凝血酶原,是理想的抗凝靶点。而TAP 是自然界中已知最强的 FXa 抑制剂,能够直接抑制 FXa 活性。同时,为降低抗凝治疗期间的出血风险,通过引导分子将抗凝物质靶向到病变部位,可以在局部达到较高的浓度而有效地抑制血栓形成;同时,血液循环中抗凝剂的浓度较低,对凝血系统性的影响较小,从而降低出血风险。鉴于此,本课题组将 TAP 和 SSL5 通过基因重组技术进行融合,构建了融合蛋白 TAP-SSL5,其中SSL5 在与 GPIbα 和GPVI 结合而抑制血小板与血管壁的黏附,还作为引导分子将 TAP 靶向到血小板表面以及血管病变局部,从而可更有效地抑制血栓形成。TAP-SSL5完整地保留了SSL5和TAP的功能,能够同血小板表面的GPIbα和 GPVI结合,并有效抑制 FXa 活性。
TAP可直接有效地抑制FXa的活性,而通过重组技术获得的融合蛋白TAP-SSL5具有对FXa的抑制作用。体外实验已经证实其对FXa活性的抑制作用,动物实验发现,TAP-SSL5可有效抑制FeCl3诱导的大鼠下腔静脉血栓形成,同时延长大鼠尾部出血时间,而且SSL5也可抑制血栓形成,这说明TAP-SSL5抑制血栓的形成的作用不仅源于TAP,同时也与SSL5的作用有关。因此,除了具备有抗FXa活性的功能之外,TAP-SSL5还可通过与血小板GPIbα相结合,发挥抗血栓形成的作用。体外实验发现,TAP-SSL5在高浓度时也可激活血小板,而之前与之类似的研究表明,血小板GPIIb/IIIa拮抗剂RGD肽、依替巴肽和替罗非班等发挥抗血小板作用的同时也有激活血小板的作用[25]。鉴于重组融合蛋白TAP-SSL5主要针对动脉粥样硬化斑块破裂所导致的血栓形成,且目前针对静脉血栓相关研究及药物已很成熟,故未在TAP-SSL5抑制静脉血栓形成方面做进一步研究。
我们应用双光子显微镜,成功实现了对FeCl3诱导的小鼠肠系膜动脉血栓形成过程的检测,其光毒性小、穿透力强、成像信噪比高,更适合于对活体组织的长时间观察。结果显示 采用10% FeCl3短时间损伤小鼠肠系膜动脉后,可迅速导致动脉血栓形成;而提前经小鼠尾静脉注射给予TAP-SSL5,可以显著抑制FeCl3诱导下小鼠肠系膜动脉的血栓形成。
本研究进一步证实了TAP-SSL5 对动脉和静脉血栓形成的预防作用,其具有的抗炎抗凝独特机制和靶向性,为进一步提高动脉粥样硬化性血栓事件防治的有效性和安全性提供了新的策略。

